甜菜碱对盐碱胁迫下海岛棉幼苗光合作用及生物量积累的影响
2019-06-25严青青张巨松代健敏窦巧巧
严青青 张巨松 代健敏 窦巧巧
甜菜碱对盐碱胁迫下海岛棉幼苗光合作用及生物量积累的影响
严青青 张巨松*代健敏 窦巧巧
新疆农业大学农学院/ 教育部棉花工程研究中心, 新疆乌鲁木齐 830052
研究盐碱胁迫下甜菜碱对海岛棉幼苗光合作用和生物量积累的影响, 及在生长发育中的作用, 为其在海岛棉抗盐碱栽培生产中的应用提供参考。本研究采用三因素随机区组试验设计, 以新海35号和新海48号为试材, 盐碱浓度为0、120、180、240 mmol L-1, 甜菜碱浓度为0、30、60 mmol L-1。随着盐碱浓度升高, 2种海岛棉幼苗株高、叶片净光合速率(n)、蒸腾速率(r)、气孔导度(s)、胞间CO2浓度(i)、植株鲜重及干重积累均呈显著下降趋势, 喷施甜菜碱后海岛棉幼苗生长发育、光合特性及生物量积累均有不同程度的提高; 同一盐碱浓度下, 随着甜菜碱浓度升高, 海岛棉幼苗各项指标均先升高后降低, 且30 mmol L-1>60 mmol L-1>0 mmol L-1, 30 mmol L-1与60 mmol L-1甜菜碱浓度之间无显著差异; 同一甜菜碱浓度下, 随着盐碱浓度的升高, 对海岛棉幼苗各项指标的促进作用均表现为持续下降趋势, 在盐碱浓度120 mmol L-1下, 喷施30 mmol L-1甜菜碱对提高海岛棉光合气体参数具有显著效果, 进而提高了海岛棉幼苗株高及增加了生物量积累; 新海35号较新海48号的促进作用更为明显。因此, 在盐碱地(0~120 mmol L-1)栽培中, 叶面喷施甜菜碱(30 mmol L-1)对海岛棉生长发育及光合作用具有显著改善作用。
海岛棉; 盐碱胁迫; 甜菜碱; 光合特性; 生物量
盐碱地是分布较广泛的一种土地资源, 随着现代工业和灌溉农业的发展, 环境持续恶化, 盐碱地的面积也在逐年扩大[1-2]。在设施农业快速发展的同时, 次生盐碱化现象已成为制约可持续发展的主要因素, 给农业生产和生态环境带来巨大的负面影响[3]。盐渍化导致土壤中盐分的积累, 会使植物发生渗透胁迫, 并阻碍植物体内与水分相关的渗透调节物质发挥作用, 使其无法实现水分向叶片的有效运输, 还会破坏植物自身组织结构[4-5]。当土壤盐分浓度达到某个阈值时, 对作物造成渗透胁迫和营养离子平衡干扰, 土壤盐碱化会导致植株体内的离子动态失衡, 细胞内活性氧代谢紊乱, 降低光合作用和减缓体内能量代谢, 抑制作物的生长和发育, 甚至导致作物的大面积枯萎和减产[6-7], 严重影响农业生产的经济效益。盐胁迫通过降低土壤水势, 减弱植物根系吸水能力, 进而降低木质部导水有效性, 使叶片气孔部分关闭, 减少蒸腾, 还会破坏植物叶绿体结构, 抑制光合磷酸化[4-5,8-9]。光合作用是影响植物的重要代谢过程, 对植物正常生长具有重要意义, 可有效指示植物的抗逆性强弱[10-11]。作物的光合作用对土壤盐碱度的反应极其敏感, 高盐胁迫会导致植物蛋白质合成受阻、叶绿体光合反应位点结构破坏, 叶片净光合速率(n)降低[12-13]; 盐碱胁迫下作物受到土壤中高pH值、低水势胁迫、渗透胁迫、营养失衡等多重伤害, 危害程度远超过中性盐胁迫[14]。研究发现, 通过化学调控可以提高植物的耐盐性, 缓解盐害对植物生长发育的影响[15]。因此, 在农业生产中研究施用外源物质增强作物抗盐碱能力具有重要意义。
甜菜碱(glycinebetain, GB)是一种天然无毒的渗透压调节物质, 是最有潜力的渗透保护剂, 在植物抗逆性研究中备受关注[7]。适宜浓度的甜菜碱可提高植物体内保护酶活性及叶绿素含量, 有效促进植物光合作用及干物质积累, 从而缓解高温、盐碱、干旱和低氧等逆境对植物的伤害[7,15]。绝大多数的植物在受到盐碱、干旱或低温等胁迫时都能合成并积累甜菜碱, 且与脯氨酸、可溶性糖协同发挥渗透调节作用, 以增强植物的抗逆性[4]。在逆境中, 植物细胞中积累的甜菜碱还可以保护细胞内蛋白质, 维持Rubisco羧化酶的活性, 稳定细胞膜, 并通过影响基因的表达调控降低胁迫对植物组织的伤害等[16-18]。甜菜碱可以提高棉花[19]、大豆[20]、小麦[21]、番茄[22]、油菜[23]、豌豆[16]、玉米[24]、水稻[25]等作物的抗盐性, 主要表现在对渗透调节物质、细胞质膜透性、离子吸收平衡的影响以及光合功能的改善。新疆是棉花的主产区之一, 但新疆的盐碱地面积广、土壤盐碱(NaCl、Na2SO4、NaHCO3、Na2CO3等)含量高, 严重制约了作物的产量, 而海岛棉是一种较耐盐碱的作物, 以其纤维长、纤维细、强度高及品质好而闻名, 但苗期抵抗盐碱环境的能力弱。因此, 本试验研究甜菜碱在盐碱胁迫下海岛棉幼苗生长发育及光合物质积累中的作用, 旨在为甜菜碱在盐碱地栽培海岛棉生产中的应用及海岛棉生产中保苗、全苗提供理论依据。
1 材料与方法
1.1 试验概况
在新疆农业大学教育部棉花工程研究中心棉花高产栽培与生理生态实验室开展试验。供试品种新海35号和新海48号[26], 由新疆农业科学院经济作物研究所提供。
1.2 试验方法
精选饱满、大小一致的种子, 采用HgCl2(0.1%)浸泡消毒10 min, 用自来水冲净, 蒸馏水冲洗5次, 最后用蒸馏水浸种24 h; 将1∶1 (v/v)营养土和蛭石复合基质于鼓风干燥箱120℃下高温灭菌24 h。将一定量的碱性盐完全溶解后均匀灌入不含Na+的营养土和蛭石复合基质内, 每盆装土300 g, 选择露白整齐一致的种子播入塑料营养钵中, 每盆6~8粒, 保持每粒种子的播种深度2~3 cm, 营养钵口覆盖一层地膜保湿, 每处理18盆, 在播种第7天将地膜揭去, 第10天剔去弱苗, 保证每个营养钵5株棉苗。将各处理置智能培养室中培养, 培养条件设置为昼/夜温度25℃/22℃、光照强度231/0 µmol m-2s-1, 相对湿度70%~ 75%, 光周期12 h /12 h (昼/夜)。播种后从第7天起, 每3 d称量1次营养钵, 如果复合基质含水量低于30%, 就按一定比例沿营养钵内侧缓慢加入蒸馏水, 保证复合基质含水量在30%~35%。
1.3 试验方案
采用三因素随机区组试验设计。品种为新海35号(耐盐)和新海48号(盐敏感); 盐碱胁迫采用NaCl和NaHCO3以摩尔质量比1∶1混合, 设Na+浓度为0 (S0)、120 (S120)、180 (S180)、240 (S240) mmol L-1, pH值分别为7.29、8.34、8.68、8.93; 海岛棉第1片真叶出现开始每隔1 d喷施1次不同浓度甜菜碱, 喷施5次, 共10 d, 确保每片叶片湿润即可, 使甜菜碱浓度为0 (G0)、30 (G30)、60 (G60) mmol L-1。盆栽土壤经盐化处理, 即在营养钵的标准土中加入设计的盐碱溶液, 搅拌均匀, 以模拟实际大田的持续盐胁迫。对照用蒸馏水代替盐碱溶液。喷施5次甜菜碱后, 测定相关指标。
1.4 测定项目
1.4.1 株高 喷施5次甜菜碱后第2天用直尺测量基质表面至植株生长点高度, 即株高, 15次重复。
1.4.2 光合参数 喷施5次甜菜碱后第2天采用TPS-2型便携式光合仪(英国pp systems)人工光源594 µmol m-2s-1光照强度下测定第一片真叶的净光合速率(n)、蒸腾速率(r)、气孔导度(s)、胞间CO2浓度(i), 10次重复。
1.4.3 光合物质积累量 测定完株高及光合参数后取完整植株15株, 随机5株为1个重复, 3个重复, 分别称量根系及茎叶的鲜重, 然后分别烘干至恒重, 称量干物质重。
1.5 数据处理
采用Microsoft Excel 2013、SPSS 19.0统计分析, 采用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 甜菜碱对盐碱胁迫下海岛棉幼苗株高的影响
由图1可知, 随着盐碱浓度的增加, 海岛棉幼苗株高呈显著下降的趋势, 喷施甜菜碱后海岛棉的幼苗株高均有不同程度的增加。新海35号在G30处理下较G0在S120、S180、S240处理下幼苗株高分别提高了3.6%、3.5%、3.6%; G60较G0在S120、S180、S240处理下幼苗株高分别提高了1.9%、1.4%、–6.6%。新海48号在S120处理下, G30、G60较G0处理的幼苗株高分别提高了3.5%、1.2%; S180处理下, G30、G60较G0处理的幼苗株高分别提高了3.2%、0.6%; S240处理下, G30、G60较G0处理的幼苗株高分别提高了3.6%、1.9%。S120处理时, 海岛棉幼苗在G30处理后与S0的株高无显著性差异, 甜菜碱提高了海岛棉幼苗在S120处理下的抗盐碱性。在喷施甜菜碱后新海35号较新海48号幼苗株高受盐碱胁迫程度小, 且S120、G30下株高受盐碱胁迫影响最小, 甜菜碱增加了海岛棉幼苗抵抗盐碱胁迫的能力。
2.2 甜菜碱对盐碱胁迫下海岛棉光合气体参数的影响
由图2可知, 随着盐碱浓度的增加, 海岛棉叶片r、n、s、i均呈显著下降的趋势, 喷施甜菜碱后海岛棉叶片的光合气体参数均有不同程度的增加。不同盐浓度下, 随着甜菜碱浓度的增加, 2个品种的n均表现为呈先增加后下降的趋势, 且G30与G60之间差异不显著。与S0相比, 2个品种在S120下G30、G60处理后的r与n无显著差异; 在S120下, 在G30、G60处理后新海48号叶片r比G0有显著的提高; 在G30、G60处理后新海35号叶片n比G0分别提高了8.1%、5.3%, 新海48号叶片n分别提高了7.0%、4.4%。在S180、S240下, 与G0相比, 2个品种在G30、G60处理后r与n无显著差异, 说明过高的盐碱浓度喷施甜菜碱对幼苗的n影响甚微。在S120下, 在G30处理后新海35号叶片s与i与S0无显著性差异, 相比G0也显著升高, 而G60处理后则显著低于S0, 相比G0则无显著性差异。在S120下, 在G30处理后新海48号叶片s与i显著高于G0, G60则与G0无显著性差异, G30、G60处理后显著低于S0。S180处理下, 与G0相比, G30处理后新海35号叶片i与s、新海48号叶片s有显著提高, G60无显著差异, G30、G60处理后新海48号的i与G0无显著差异。
2.3 甜菜碱对盐碱胁迫下海岛棉幼苗生物量积累的影响
2.3.1 甜菜碱对盐碱胁迫下海岛棉幼苗鲜重积累的影响
由表1可知, 随着盐碱浓度的增加, 海岛棉茎叶鲜重、根鲜重及总鲜重均呈显著下降的趋势, 喷施甜菜碱后均有不同程度的增加。S120处理下, G30、G60较G0新海35号茎叶鲜重分别提高了8.7%、6.0%, 新海48号茎叶鲜重分别提高了12.5%、8.8%, 新海35号根鲜重分别提高了7.7%、5.4%, 新海48号根鲜重分别提高了12.8%、7.8%, 新海35号总鲜重分别提高了8.5%、5.9%, 新海48号总鲜重分别提高了12.5%、8.6%; 新海35号在S240处理下, G30、G60较G0茎叶鲜重分别提高了6.3%、1.4%, 根鲜重分别提高了6.6%、1.5%, 总鲜重分别提高了6.3%、1.4%; 新海48号在S240处理下, G30、G60较G0茎叶鲜重分别提高了1.3%、-5.3%, 根鲜重分别提高了3.9%、-12.4%, 总鲜重分别提高了1.7%、-6.7%。喷施甜菜碱后植株鲜重积累量新海35号较新海48号高, S120下G30处理后海岛棉光合物质鲜重积累量与S0处理无显著 差异。
2.3.2 甜菜碱对盐碱胁迫下海岛棉光合物质干重积累的影响 由表2可知, 随着盐碱浓度的增加, 海岛棉茎叶干重、根干重及总干重均呈显著下降的趋势, S120、S180、S240与S0相比, 新海35号总干重分别下降了23.9%、43.2%、64.3%, 新海48号总干重分别下降了29.5%、54.3%、83.2%。喷施甜菜碱后海岛棉茎叶干重、根干重及总干重均有不同程度的增加, 尤其是新海35号在S120处理下, G30、G60较G0茎叶干重分别提高了19.4%、12.6%, 根干重分别提高了23.1%、6.7%, 总干重分别提高了19.7%、11.3%, 新海48号在S120处理下, G30、G60较G0茎叶干重分别提高了6.8%、5.5%, 根干重分别提高了11.5%、5.3%, 总干重分别提高了8.3%、5.5%; 但是, 盐碱胁迫浓度过大, 喷施甜菜碱对棉花的抗盐碱能力无显著作用, 新海35号在S240处理下, G30、G60较G0茎叶干重分别提高了25.4%、13.1%, 根干重分别提高了15.5%、-21.4%, 总干重分别提高了22.8%、5.1%; 新海48号在S240处理时, G30、G60较G0茎叶干重分别提高了21.1%、-0.5%, 根干重分别提高了60.0%、-38.5%, 总干重分别提高了23.2%、-4.1%。海岛棉茎叶干重、根干重及总干重在S120和G30处理下与S0处理无显著性差异。在喷施甜菜碱后干重积累量新海35号较新海48号大, 且在S120和B30处理下海岛棉干物质积累量与S0处理最接近。

图1 不同处理对海岛棉幼苗株高的影响
标以不同字母的柱值在< 0.05水平下差异显著。
Bars superscripted by different letters are significantly different at< 0.05.

图2 不同处理对海岛棉幼苗光合气体参数的影响
标以不同字母的柱值在< 0.05水平下差异显著。
Bars superscripted by different letters are significantly different at< 0.05.

表1 不同处理对海岛棉幼苗植株鲜重积累的影响
(续表1)
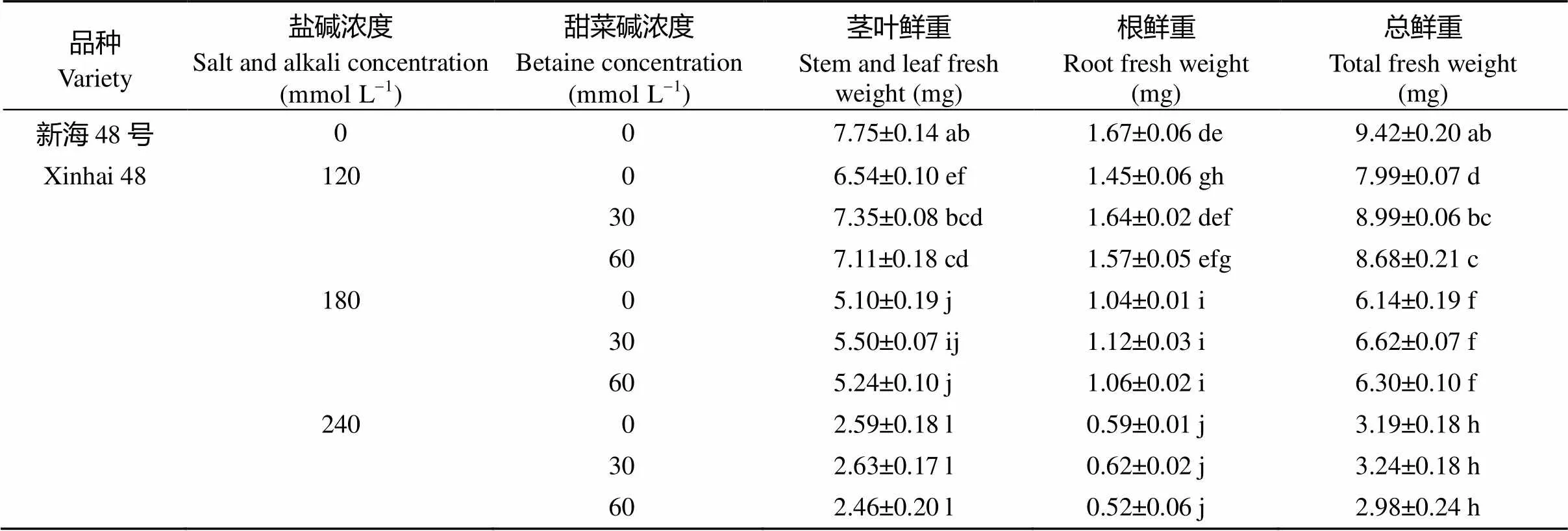
品种Variety盐碱浓度Salt and alkali concentration (mmol L-1)甜菜碱浓度Betaine concentration (mmol L-1)茎叶鲜重Stem and leaf fresh weight (mg)根鲜重Root fresh weight(mg)总鲜重Total fresh weight(mg) 新海48号007.75±0.14 ab1.67±0.06 de9.42±0.20 ab Xinhai 4812006.54±0.10 ef1.45±0.06 gh7.99±0.07 d 307.35±0.08 bcd1.64±0.02 def8.99±0.06 bc 607.11±0.18 cd1.57±0.05 efg8.68±0.21 c 18005.10±0.19 j1.04±0.01 i6.14±0.19 f 305.50±0.07 ij1.12±0.03 i6.62±0.07 f 605.24±0.10 j1.06±0.02 i6.30±0.10 f 24002.59±0.18 l0.59±0.01 j3.19±0.18 h 302.63±0.17 l0.62±0.02 j3.24±0.18 h 602.46±0.20 l0.52±0.06 j2.98±0.24 h
同列标以不同字母的值在< 0.05水平下差异显著。
Values within a column followed by different letters are significantly different at< 0.05.
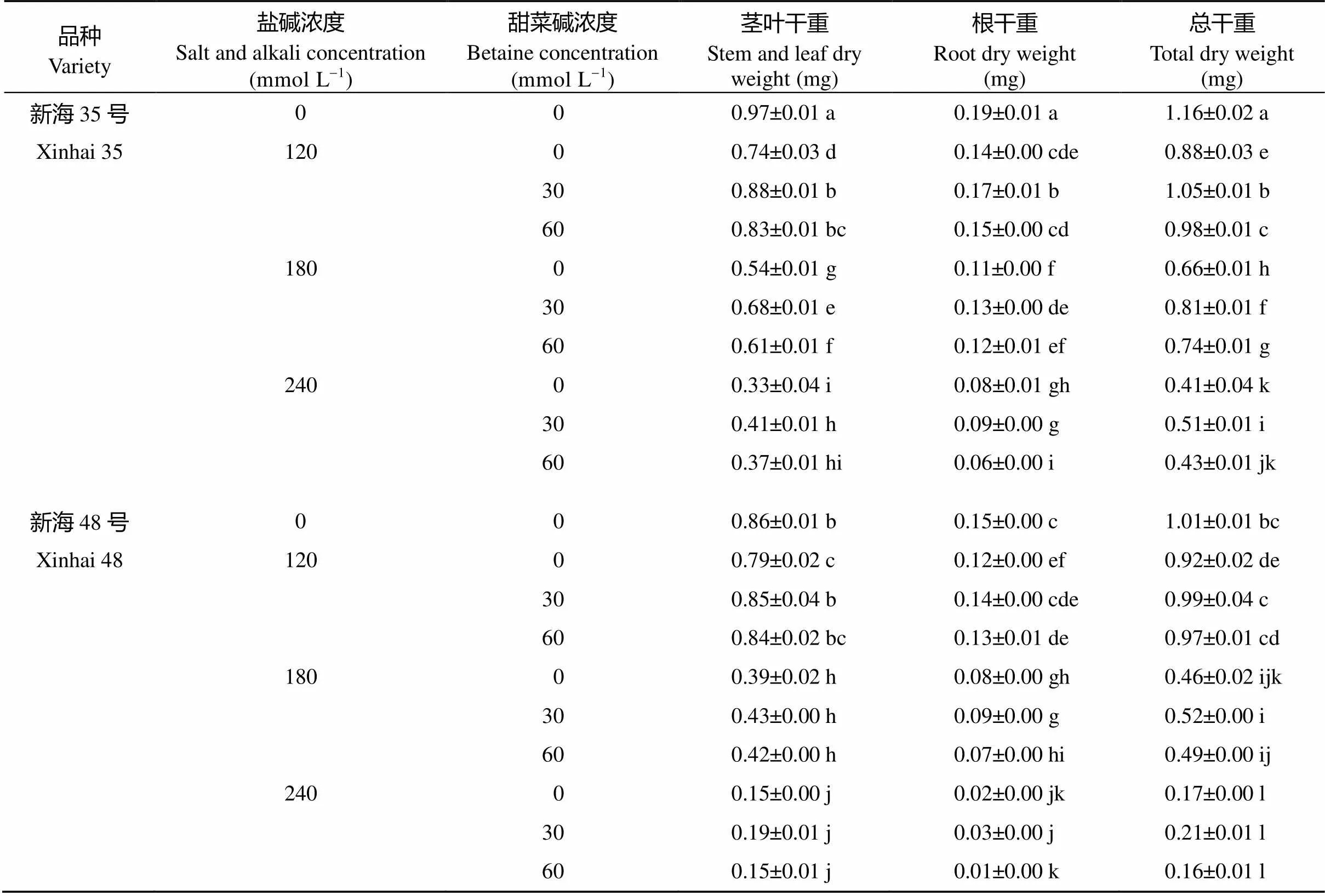
表2 不同处理对海岛棉干物质积累的影响
同列标以不同字母的值在< 0.05水平下差异显著。
Values within a column followed by different letters are significantly different at< 0.05.
3 讨论
植物叶片气体交换参数是衡量作物光合功能的重要指标。逆境条件下会导致作物光合速率下降, 这种抑制是由气孔限制因素或非气孔限制因素造成的。盐胁迫下作物幼苗叶片净光合速率(n)、蒸腾速率(r)、气孔导度(s)、胞间CO2浓度(i)均受到抑制[27], 且随着盐浓度的增加,n、r、s、i呈显著下降趋势(<0.05)[28]。其中叶片s与i同时减小, 说明叶片n的下降是由气孔阻力的增大即气孔导度的降低引起的, 喷施甜菜碱后, 各项气体交换参数值明显升高, 表明甜菜碱增强了盐胁迫下作物幼苗叶片的光合作用[15]。研究认为, 甜菜碱对叶绿体有显著的渗透调节作用, 这种调节作用有利于在逆境下保持叶绿体的光合性能, 进而缓解盐胁迫对植物的伤害[25], 且有利于植物对光能的捕获、吸收、传递和转换, 明显促进植物生长, 降低盐胁迫对植物的抑制作用, 能增加过氧化物酶活性, 延缓叶片叶绿素含量减少的趋势[25,29]。本试验条件下, 甜菜碱对海岛棉的光合气体参数的影响与前人研究结果基本一致。随着盐碱胁迫的增加, 海岛棉叶片光合气体参数呈显著下降趋势(<0.05), 喷施甜菜碱后, 叶片光合作用明显提高, 在盐碱浓度为120 mmol L-1、甜菜碱浓度为30 mmol L-1时对海岛棉光合气体参数提高程度最大。
盐碱混合胁迫处理的幼苗地下部和地上部鲜重均显著降低[30]。研究表明, 盐胁迫对棉花幼苗生长发育都有显著影响, 棉花幼苗鲜、干质量及茎高都显著降低, 喷施甜菜碱后增加棉花幼苗的鲜、干质量及茎高, 促进植物生长发育, 说明盐胁迫下喷施适宜浓度的甜菜碱可以改善植物幼苗的抗逆性, 有效缓解盐胁迫对棉花幼苗的伤害[19]。甜菜碱能有效减缓盐胁迫对黑果枸杞种子萌发及幼苗生长产生的伤害, 提高种子及幼苗的抗盐能力[31]。在盐胁迫下, 含有甜菜碱合成基因的玉米幼苗生长, 如干物质积累、叶片伸展速率和株高增长速率受到较小抑制, 这主要与其保持了较高的叶片相对含水量、较高的碳同化率、较大的膨压有关, 表明甜菜碱通过渗透调节功能提高了植物对盐胁迫的抗性[32]。本试验条件下, 盐碱胁迫显著降低了海岛棉的株高、鲜重及干重, 喷施甜菜碱后, 株高、鲜重与干重显著增加; 在不同盐碱胁迫浓度下均表现为30 mmol L-1甜菜碱浓度对海岛棉株高、鲜重及干重增加程度最大, 且在盐碱浓度为120 mmol L-1时, 海岛棉株高、鲜重及干重与对照(盐碱胁迫)最接近。生物量积累与光合气体参数的改善表现趋势一致。
此外, 甜菜碱还有重要的“非渗透调节”功能, 如保护细胞内蛋白质和代谢酶类, 维持酶的活性, 甚至可以起到稳定膜的作用[33]。研究认为, 在受到盐胁迫的细胞中, 甜菜碱似乎起到了一种低分子量的伴侣分子作用, 稳定酶蛋白的构象, 并使酶处于具备功能的状态, 从而部分抵消了高盐浓度的有害影响[34]。甜菜碱对作物的生理效应还需进一步研究, 明确甜菜碱对耐盐碱品种的生理机制, 从而完善在盐碱地栽培中甜菜碱对海岛棉促进作用的理论依据。
[1] 徐恒刚. 中国盐生植被及盐渍化生态治理. 北京: 中国农业科学技术出版社, 2004. Xu H G. Halophyte and Ecological Management of Salinization in China. Beijing: China Agricultural Science Technology Publisher, 2004 (in Chinese).
[2] 李建国, 濮励杰, 朱明, 张润森. 土壤盐渍化研究现状及未来研究热点. 地理学报, 2012, 67: 1233–1245. Li J G, Pu L J, Zhu M, Zhang R S. The present situation and hot issues in the salt-affected soil research., 2012, 67: 1233–1245 (in Chinese with English abstract).
[3] 任丽丽, 任春明, 赵自国. 植物耐盐性研究进展. 山西农业科学, 2010, 38(5): 87–90. Ren L L, Ren C M, Zhao Z G. Research advances in plant salt-tolerance., 2010, 38(5): 87–90 (in Chinese with English abstract).
[4] Singh M, Kumar J, Singh S, Singh V P. Roles of osmoprotectants in improving salinity and drought tolerance in plants: a review., 2015, 14: 407–426.
[5] 周洪华, 李卫红. 胡杨木质部水分传导对盐胁迫的响应与适应. 植物生态学报, 2015, 39: 81–91. Zhou H H, Li W H. Responses and adaptation of xylem hydraulic conductivity to salt stress in., 2015, 39: 81–91 (in Chinese with English abstract).
[6] 岳健敏, 任琼, 张金池. 植物盐耐机理研究进展. 林业工程学报, 2015, 29(5): 9–13. Yue J M, Ren Q, Zhang J C. Advances in salt tolerance mechanism of plants., 2015, 29(5): 9–13 (in Chinese with English abstract).
[7] Chen T H, Murata N. Glycinebetaine protects plants against abiotic stress: mechanisms and biotechnological applications., 2011, 34: 1–20.
[8] 王素平, 郭世荣, 李璟, 胡晓辉, 焦彦生. 盐胁迫对黄瓜幼苗根系生长和水分利用的影响. 应用生态学报, 2006, 17: 1883–1888. Wang S P, Guo S R, Li J, Hu X H, Jiao Y S. Effects of salt stress on the growth of root system and water use efficiency of cucumber seedlings., 2006, 17: 1883–1888 (in Chinese with English abstract).
[9] Rahnama A, James R A, Poustini K, Munns R. Stomatal conductance as a screen for osmotic stress tolerance in durum wheat growing in saline soil., 2010, 37: 255–263.
[10] 王玉萍, 高会会, 刘悦善, 慕平, 鱼小军, 安黎哲, 张峰. 高山植物光合机构耐受胁迫的适应机制. 应用生态学报, 2013, 24: 2049–2055. Wang Y P, Gao H H, Liu Y S, Mu P, Yu X J, An L Z, Zhang F. Adaptation mechanisms of alpine plants photosynthetic apparatus against adverse stress: a review., 2013, 24: 2049–2055 (in Chinese with English abstract).
[11] 丁俊祥, 邹杰, 唐立松, 刘卫国. 克里雅河流域荒漠–绿洲交错带3种不同生活型植物的光合特性. 生态学报, 2015, 35: 733–741. Ding J X, Zou J, Tang L S, Liu W G. Photosynthetic characteristics of three different life-form plants in the desert-Oasisecotone of Keriya river basin., 2015, 35: 733–741 (in Chinese with English abstract).
[12] 王宇超, 王得祥. 盐胁迫对木本滨藜叶绿素合成及净光合速率的影响. 农业工程学报, 2012, 28(10): 151–158. Wang Y C, Wang D X. Effects of salt stress on chlorophyll content and net photosynthetic rate of woody saltbush., 2012, 28(10): 151–158 (in Chinese with English abstract).
[13] 马荣, 王成, 马庆, 侯佩臣, 王晓冬. 向日葵芽苗期离子对复合盐胁迫的响应. 中国生态农业学报, 2017, 25: 720–729. Ma R, Wang C, Ma Q, Hou P C, Wang X D. Ion response of sunflower at sprouting stage to mixed salt stress., 2017, 25: 720–729 (in Chinese with English abstract).
[14] 张会慧, 张秀丽, 李鑫, 丁俊男, 朱文旭, 齐飞, 张婷, 田野, 孙广玉. NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响. 应用生态学报, 2012, 23: 625–631. Zhang H H, Zhang X L, Li X, Ding J N, Zhu W X, Qi F, Zhang T, Tian Y, Sun G Y. Effects of NaCl and Na2CO3stresses on the growth and photosynthesis characteristics ofseedlings., 2012, 23: 625–631 (in Chinese with English abstract).
[15] 许大全. 光合作用气孔限制分析中的一些问题. 植物生理学报, 1997, 33: 241–244. Xu D Q. Some problems in stomatal limitation analysis of photosynthesis., 1997, 33: 241–244 (in Chinese with English abstract).
[16] Nusrat N, Shahbaz M, Perveen S. Modulation in growth, photosynthetic efficiency, activity of antioxidants and mineral ions by foliar application of glycinebetaine on pea (L) under salt stress., 2014, 36: 2985–2998.
[17] 雷永康, 徐智敏, 李取生, 何宝燕, 梅秀芹, 陈艳芳, 曹刚. 外源甜菜碱对苋菜抗盐性与累积重金属特性的影响. 环境科学学报, 2015, 35: 1587–1595. Lei Y K, Xu Z M, Li Q S, He B Y, Mei X Q, Chen Y F, Cao G. Effect of exogenous glycinebetaine on the salinity tolerance and heavy metals accumulation of edible amaranth., 2015, 35: 1587–1595 (in Chinese with English abstract).
[18] 刘佳琪, 杨雪, 李迪, 杨海灵. 胡杨甜菜碱醛脱氢酶基因的功能分化. 生物工程学报, 2012, 28: 329–339. Liu J Q, Yang X, Li D, Yang H L. Functional divergence of betaine aldehyde dehydrogenase genes in., 2012, 28: 329–339 (in Chinese with English abstract).
[19] 高雁, 娄恺, 李春. 盐分胁迫下棉花幼苗对外源甜菜碱的生理响应. 农业工程学报, 2011, 27(增刊1): 244–248.Gao Y, Lou K, Li C. Effect of exogenous glycine betaine on the physiological responses of cotton seedlings under salt stress., 2011, 27(suppl-1): 244–248 (in Chinese with English abstract).
[20] 黄英运, 朱丹华, 李虹章, 董德坤. 外源甜菜碱对NaCl胁迫下大豆苗期生理指标的影响. 浙江农业学报, 2012, 24: 12–16. Huang Y Y, Zhu D H, Li H Z, Dong D K. Effects of exogenous glycine betaine on the physiological indexes of soybean seedlings under NaCl stress., 2012, 24: 12–16 (in Chinese with English abstract).
[21] 赵新西, 马千全, 梁超, 房燕, 王玮. 甜菜碱预处理对盐胁迫下小麦幼苗类囊体膜脂脂肪酸组分和功能的影响. 作物学报, 2006, 32: 703–708. Zhao X X, Ma Q Q, Liang C, Fang Y, Wang W. Effects of pretreated with glycinebetaine on the fatty acid composition and function of wheat thylakoid membrane under salt stress., 2006, 32: 703–708 (in Chinese with English abstract).
[22] Wei D, Zhang W, Wang C C, Meng Q W, Li G, Tony H H, Yang X H. Genetic engineering of the biosynthesis of glycinebetaine leads to alleviate salt–induced potassium efflux and enhances salt tolerance in tomato plants., 2017, 257: 74–83.
[23] Khalid A, Athar H U R, Zafar Z U, Akram A, Hussain K, Manzoor H, Al-Qurainy F, Ashraf M. Photosynthetic capacity of canola (L.) plants as affected by glycinebetaine under salt stress., 2015, 88: 78–86.
[24] Cengiz K, Osman S, Salih A, Murat D. Mitigation effects of glycinebetaine on oxidative stress and some key growth parameters of maize exposed to salt stress., 2013, 37: 188–194.
[25] Suriyan C U, Chalermpol K. Effect of glycinebetaine on proline, water use, and photosynthetic efficiencies, and growth of rice seedlings under salt stress., 2010, 34: 517–527.
[26] 严青青, 张巨松, 李星星, 王燕提. 盐碱胁迫对海岛棉种子萌发及幼苗根系生长的影响. 作物学报, 2019, 45: 99-109.Yan Q Q, Zhang J S, Li X X, Wang Y T. Effects of salinity stress on seed germination and root growth of seedlings in island cotton., 2019, 45: 99-109 (in Chinese with English abstract).
[27] 尹海龙, 田长彦. 根施甜菜碱对盐胁迫下玉米幼苗根系生长与光合特性的影响. 干旱区资源与环境, 2013, 27(9): 113–118. Yin H L, Tian C Y. Effects of root–applied glycinebetaine on the root growth and photosynthetic characteristics under salt stress in maize seedlings., 2013, 27(9): 113–118 (in Chinese with English abstract).
[28] 张浩, 郭丽丽, 叶嘉, 张雷, 王清涛, 李菲, 张茜茜, 曹旭, 徐明, 郝立华, 郑云普. 樱桃番茄叶片气孔特征和气体交换过程对NaCl胁迫的响应. 农业工程学报, 2018, 34(5): 107–113. Zhang H, Guo L L, Ye J, Zhang L, Wang Q T, Li F, Zhang Q Q, Cao X, Xu M, Hao L H, Zheng Y P. Responses of leaf stomatal traits and gas exchange process of cherry tomato to NaCl salinity stress., 2018, 34(5): 107–113 (in Chinese with English abstract).
[29] Athar H U R, Zafar Z U, Ashraf M. Glycinebetaine improved photosynthesis in canola under salt stress: evaluation of chlorophyll fluorescence parameters as potential indicators., 2015, 201: 428–442.
[30] 梁杨杨, 吴晓蕾, 李敬蕊, 宫彬彬, 高洪波, 王春燕. 盐碱胁迫下GABA对番茄幼苗活性氧代谢及光合性能的影响. 河北农业大学学报, 2016, 39(3): 7–13. Liang Y Y, Wu X L, Li J R, Gong B B, Gao H B, Wang C Y. Effects of exogenous GABA on reactive oxygen species metabolism and photosynthesis characteristics of tomatoes under mixed NaCl and NaHCO3stress., 2016, 39(3): 7–13 (in Chinese with English abstract).
[31] 李善家, 韩多红, 王恩军, 武燕. 外源甜菜碱对盐胁迫下黑果枸杞种子萌发和幼苗保护酶活性的影响. 草业科学, 2016, 33: 674–680. Li S J, Han D H, Wang E J, Wu Y. Effects of exogenous betaine on seed germination and antioxidase activities of lycium ruthenium seedlings under NaCl stress., 2016, 33: 674–680 (in Chinese with English abstract).
[32] Rhodes D. Salt tolerance of glyciebetaine-deficient and -containing maize lines., 1995, 107: 631–638.
[33] Goel D, Singh A K, Yadav V, Babbar S B, Murata N, Bansal K C. Transformation of tomato with a bacterialgene enhances tolerance to salt and water stresses., 2011, 168: 1286–1294.
[34] Nomura M, Hibino T, Takabe T, Sugiyama T, Yokota A, Miyake H, Takabe T. Transgenically produced glycinebetaine protects ribulose 1,5-bisphosphate carboxylase/oxygenase from inactivation insp. PCC7942 under salt stress., 1998, 39: 425–432.
Effects of glycinebetain on photosynthesis and biomass accumulation of island cotton seedlings under saline alkali stress
YAN Qing-Qing, ZHANG Ju-Song*, DAI Jian-Min, and DOU Qiao-Qiao
Agriculture College, Xinjiang Agricultural University / Research Center of Cotton Engineering, Urumqi 830052, Xinjiang, China
Xinhai 35 and Xinhai 48 varieties were used to study the effects of glycinebetain on photosynthesis, biomass accumulation and the role in the growth and development of sea island cotton seedlings under salt alkali stress, which will provide a reference for the application of glycinebetain in the salt alkali cultivation of island cotton. The concentration of saline alkali was 0, 120, 180, 240 mmol L-1, and the concentration of glycinebetain was 0, 30, 60 mmol L-1. With the increase of saline alkali concentration, island cotton seedling plant height, net photosynthetic rate (n), transpiration rate (r), stomatal conductance (s), intercellular CO2concentration (i), plant fresh and dry weight accumulation showed a significant downward trend, but after glycinebetain spraying, the growth, photosynthesis and biomass accumulation of sea island cotton seedlings were improved in different degrees. Under the same saline alkali concentration, the above indices of island cotton seedlings increased first and then decreased with the increase of glycinebetain concentration. Under the same glycinebetain concentration, the promotion degree of each index of island cotton seedlings showed a continuous downward trend with the increase of salinity and alkali concentration. Under 120 mmol L-1saline-alkali concentration, spraying 30 mmol L-1glycinebetain had a significant effect on improving the photosynthetic performance, thereby increasing the plant height and biomass accumulation of island cotton seedlings, which was more effective in Xinhai 35 than in Xinhai 48. Therefore, in the cultivation of saline alkali soil (0–120 mmol L-1), foliar application of glycinebetain (30 mmol L-1) can significantly improve the growth and photosynthesis of island cotton.
island cotton; saline alkali stress; glycinebetain; photosynthesis; biomass accumulation
2018-08-26;
2019-01-19;
2019-03-26.
10.3724/SP.J.1006.2019.84117
张巨松, E-mail:xjndzjs@163.com
E-mail: 1359055572@qq.com
本研究由国家重点研发计划项目(2017YFD0101605-05)和新疆研究生科研创新项目(XJGRI2017070)资助。
This study was supported by the National Key Research and Development Program of China (2017YFD0101605-05) and Xinjiang Graduate Research and Innovation Project (XJGRI2017070).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190325.1420.002.html
