贮藏温度对葡萄果胶含量及相关酶活性的影响
2019-06-20
(1 天津商业大学 天津市制冷技术重点实验室 天津 300134;2 国家农产品保鲜工程技术研究中心 天津市农产品采后生理与贮藏保鲜重点实验室 天津 300384)
葡萄因口感鲜美、营养丰富深受消费者喜爱,但其含水量较高,贮藏过程中易软化腐烂,是最不耐贮藏的浆果之一[1]。相比于传统冷藏和气调保鲜贮藏,冰温贮藏技术的诞生,为葡萄的保鲜开辟了新途径[2],可将贮藏温度精密控制在冰点,葡萄的生理活性降至最低,同时维持正常的生理代谢,利于葡萄长期保存[3-4],近几年在美日韩等地区发展迅猛[5]。超冰温技术是指贮藏温度即使在冰点以下食品也可以保持过冷状态而不发生冻结[6]。超冰温技术能够显著抑制果蔬采后贮藏过程中的呼吸速率,使其保持更好的色泽和口感,最大程度限制其代谢水平。
李志文等[7]将乍娜葡萄用1-MCP处理后分别于冷藏和冰温两种环境下贮藏,定期取样用质构仪测定乍娜葡萄的质地参数变化。M.A.Sahari等[8]研究了不同贮藏温度对伊朗草莓Vc含量及其它评价指标的影响,记录了3个不同温度下贮藏的草莓在3个月后色泽、Vc含量及pH的变化情况。张桂等[9]发现冰温贮藏能使草莓维持更好的口感和甜度,同时可以最大限度的限制草莓的呼吸速率,控制草莓中腐败微生物的生长繁殖速度,保持草莓的食用口感。
果胶属于一种多糖物质,广泛分布于植物的根茎叶和果皮中,能够与纤维素共同作用维持果蔬细胞的形态和完整性[10-11]。当果实内原果胶水解为可溶性果胶时,随着可溶性果胶含量的升高及原果胶含量的下降,果实硬度随之下降,导致果实出现软化的现象,而酶则对果胶的水解起到裂解作用[12-13]。因此,果实成熟软化是一系列复杂的生理变化反应。本文对贮藏过程中葡萄果胶含量及相关酶活性影响进行了研究。
1 材料与方法
1.1 材料与试剂
意大利品种葡萄2017年10月9日采自天津市武清区,选取无病害、褐变且组织完整无机械损伤的葡萄,称取3 kg小心放入PE保鲜袋中(3 kg/袋),再轻轻放进入无盖包装箱中,每个箱子中放一袋,然后放入提前调试好的冷库中贮藏。
1.2 仪器与设备
实验采用的仪器与设备:全能台式高速离心机,Biofuge®sratos;手持式折光仪,PAL-1;气相色谱仪,GC-7800;冰温库,室外装配式组合冷库型式。物性测试仪,TA.XT.PLUS;热流型差式量热扫描仪(DSC),Q1000。
1.3 方法
实验前期用差式量热扫描仪测得葡萄冰点温度。实验测得的曲线为DSC曲线,最终测得葡萄冰点温度为-1.2 ℃。
冻结点的测量与冰点的测量类似,不同的是通过向上的冻结峰来确定,冻结点取冻结峰的峰值点,此时测量的冻结点温度较准确。实验测得葡萄的冻结点温度为-3.8 ℃。超冰温技术是指贮藏温度即使在冰点以下食品也可以保持过冷状态而不发生冻结。通过继续实验发现,将葡萄置于-2 ℃、-3 ℃条件下贮藏,冻结曲线上无冰核生成迹象,故葡萄不会发生冻结。
实验共设置4个处理。处理A:超冰温贮藏I组(-3 ℃±0.3 ℃);处理B:超冰温贮藏Ⅱ组(-2 ℃±0.3 ℃);处理C:冰温贮藏(-1 ℃±0.3 ℃);处理D:普通冷库贮藏(4 ℃±0.3 ℃)。于采摘当天测初值,之后每隔10 d从各处理中取出1箱称量整箱的重量,从每箱内果穗的不同部位随机剪下15颗葡萄进行质地参数检测,再随机取果实进行组织形态学观察及保存样品用于生理生化测定,待葡萄果实失去商品性时取样结束,实验重复3次。
1.3.1 果胶含量测定[14-16]
1)提取可溶性果胶
(1)用天平准确称取1 g葡萄果肉在研钵中充分研磨,使其成为匀浆,将匀浆转入50 mL的离心管中,加入25 mL体积分数95%的乙醇溶液,沸水浴加热0.5 h(在此过程中要不断补充体积分数95%的乙醇),再冷却至室温;(2)离心管盖好盖子后小心放入离心机中(8 000 r/min)离心30 min,倒出上清液,再加入体积分数95%的乙醇溶液25 mL,重复步骤(1)3次;(3)向步骤(2)所得沉淀物中加20 mL蒸馏水,在50 ℃水浴中放置0.5 h,让可溶性果胶充分溶解后放入冷水中使其快速冷却至室温;(4)再次离心10 min,将所得上清液移入100 mL容量瓶中;(5)用蒸馏水充分洗涤沉淀,将离心所得上清液移入100 mL容量瓶中,加入蒸馏水定容至刻度线并摇匀,此为可溶性果胶。
2)提取原果胶
(1)向原离心管的沉淀中加入25 mL,0.5 mol/L的H2SO4溶液,沸水浴1 h使原果胶充分溶解,取出后放入冷水中使其快速冷却至室温;(2)将离心管放入离心机(8 000 r/min)离心15 min,将上清液移入100 mL容量瓶中,加蒸馏水稀释至定容线,得到原果胶。
3)测定
分别吸取原果胶和可溶性果胶各1 mL,加入到25 mL的试管中,向试管中加入6 mL浓硫酸,沸水浴加热20 min,取出冷却至室温,加入0.2 mL、1.5 g/L咔唑-乙醇溶液,摇匀,暗处放置30 min后,于530 nm下测定吸光值。
1.3.2 PE酶含量测定[17]
1)提取果胶酶粗酶液
(1)称取葡萄果肉60 g,加入60 mL、3 ℃条件下预冷的质量分数为12%的聚乙二醇及质量分数为0.2%的Na2SO3溶液,在冰浴中研磨2 min,直至成为匀浆;(2)离心10 min,倒出上清液,用3 ℃的质量分数为0.2%的Na2SO3水溶液洗涤沉淀;(3)将洗涤所得沉淀均匀分为3份,分别提取PE、PG。
2)测定
取5 mL粗酶液,加入至20 mL质量分数1%的果胶液中,在30 ℃条件下以0.01 mol/L NaOH滴定,维持pH在7.3,测定10 min,以NaOH的消耗量来标定酶活性。
1.3.3 PG酶含量测定[18]
(1)取0.75 mL酶提取液,加入0.75 mL以50 mL醋酸钠缓冲液(pH=5.5)配成的质量分数0.5%的多聚半乳糖醛酸溶液(pH=3.3),于30 ℃放置18 h;(2)加入pH=9.0的0.1 L硼酸盐缓冲溶液10 mL和质量分数1%的氰基乙酰胺1.5 mL,煮沸10 min后冷却至室温;(3)于273 nm下测定吸光值,重复3次;(4)根据半乳糖酸溶液标准曲线方程计算生成的半乳糖醛酸量。酶活力单位:以每小时单位质量样品生成的半乳糖醛酸表示酶活性。
1.3.4 硬度的测定
硬度测定采用TA.XT.Plus物性测定仪测定,每次取6个果去皮测定,每个果实重复4次取最大力,最后取这6个果实的平均值作为结果;P/2柱头(φ2 mm),测试速度为2 mm/s。
2 结果与分析
2.1 贮藏期间果胶含量的变化
2.1.1 葡萄果肉果胶含量的变化
图1所示为整个贮藏期间在4种温度条件下葡萄果肉中原果胶含量的变化,均呈不断下降的趋势,其中超冰温I组(-3 ℃±0.3 ℃)和超冰温Ⅱ组(-2 ℃±0.3 ℃)的葡萄果肉原果胶含量分别下降了6%和7.5%,冰温下降了15.4%,而普通冷库葡萄果肉原果胶含量几乎呈直线下降,下降高达25.2%。超冰温组的葡萄原果胶水解速度最慢,而普通冷库则最快。原果胶大部分水解为可溶性果胶或果胶酸,这也是导致葡萄硬度下降而使葡萄软化变质的重要原因。-3 ℃超冰温条件可以最大程度上降低原果胶的水解速度,使其含量一直维持在较高水平,这对于维持葡萄果实硬度,保持果肉细胞完整性,降低果实软化甚至腐烂变质率有很好的作用。
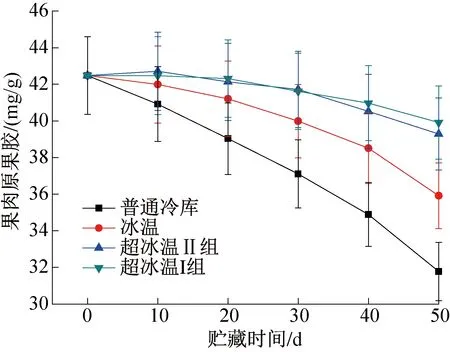
图1 果肉原果胶含量的变化Fig.1 Changes of pectin content in pulp
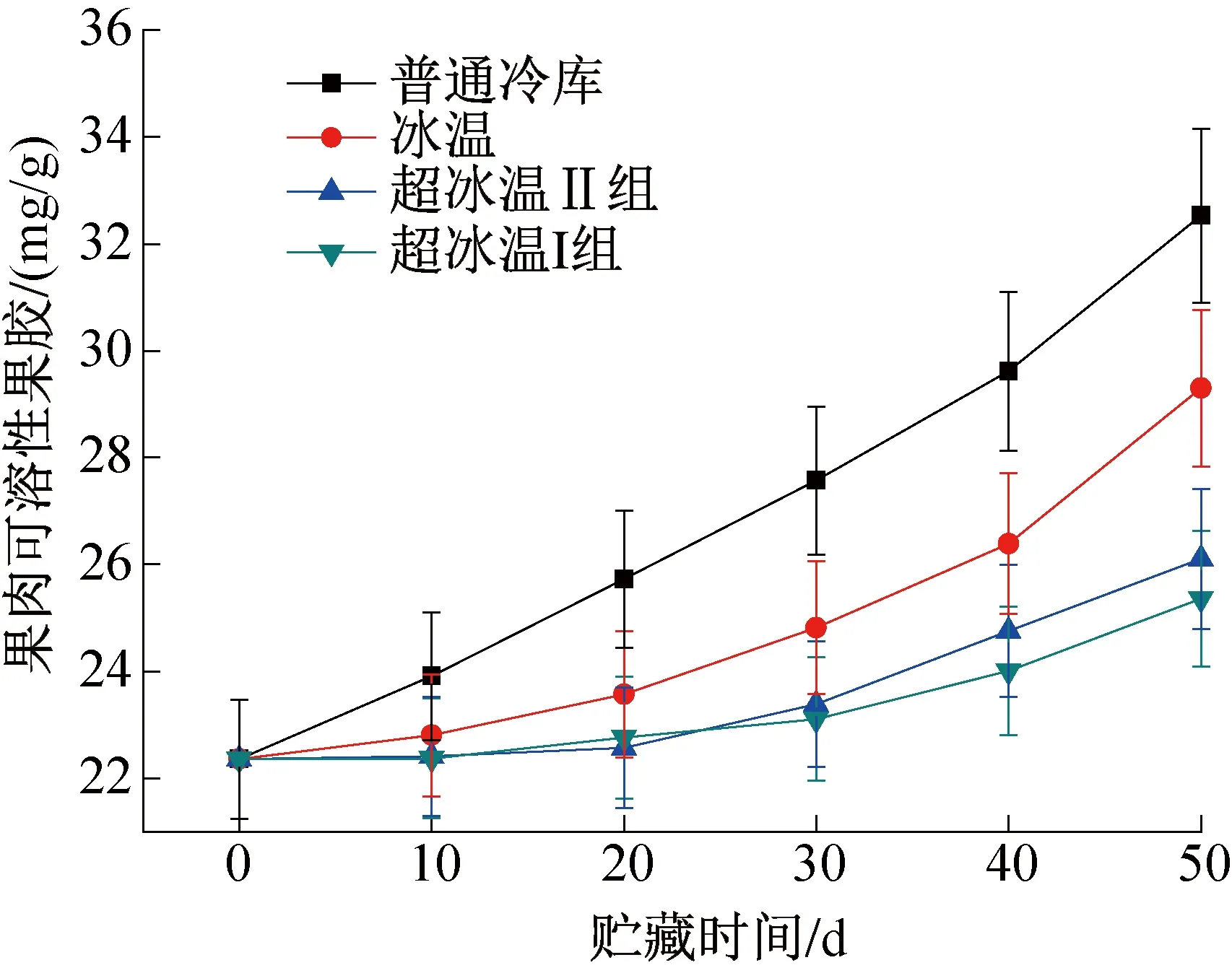
图2 果肉可溶性果胶含量变化Fig.2 Changes of soluble pectin content in pulp
图2所示为不同温度条件下葡萄果肉中可溶性果胶含量的变化,葡萄果肉可溶性果胶含量明显低于原果胶,在整个贮藏过程中表现出不断升高的趋势,且升高速率持续加快,尤其普通冷库中的葡萄,其果肉可溶性果胶含量几乎呈直线上升,在第50 d调查时升高了45.5%。而-3 ℃仅小幅上升13.4%,说明-3 ℃条件可以很好的抑制原果胶的水解速率,控制可溶性果胶含量在较低水平,防止葡萄出现软化现象。在贮藏的前20 d,-3 ℃超冰温条件下的葡萄可溶性果胶含量变化幅度很小,可以减慢葡萄成熟的速度,从而最大程度延长保质期。
2.1.2 葡萄果皮果胶含量的变化
果皮对于果实内部具有很好的保护作用,其果胶含量的变化对于果实的坚实度及完整性具有重要影响。果皮中可溶性果胶含量增大时容易使果皮出现软化,丧失果肉的保护作用,并最终导致整个果实软化腐烂。研究果皮中原果胶及可溶性果胶含量变化具有重要意义。
图3所示为不同温度条件下葡萄果皮中原果胶含量的变化。由图3可知,葡萄果皮中原果胶的含量远高于果肉中原果胶的含量,初期时约为其3.5倍。在贮藏期间所有条件下葡萄果皮原果胶含量也不断下降,其中超冰温I组(-3 ℃±0.3 ℃)的葡萄果皮原果胶含量在贮藏的前20 d下降速度非常缓慢,含量基本不变,从第20 d才开始出现明显的下降,但其下降速度在4组葡萄中一直处于最慢,仅下降2.9%。冰温及普通冷库环境下的葡萄果皮原果胶含量降低速率不断增大,在第50 d调查时,普通冷库中的葡萄果皮原果胶含量下降7.5%,远远高于其他组。当冷却温度越临近葡萄冻结点时,使其达到一种休眠状态,在“休眠”状态下保存,此时组织细胞的新陈代谢率最小,消耗的能量也最小。故-3 ℃超冰温环境可以有效降低果皮中原果胶含量的下降速度,使果皮保持较长时间的坚硬度,从而更好的保护果肉的完整性不受损害。
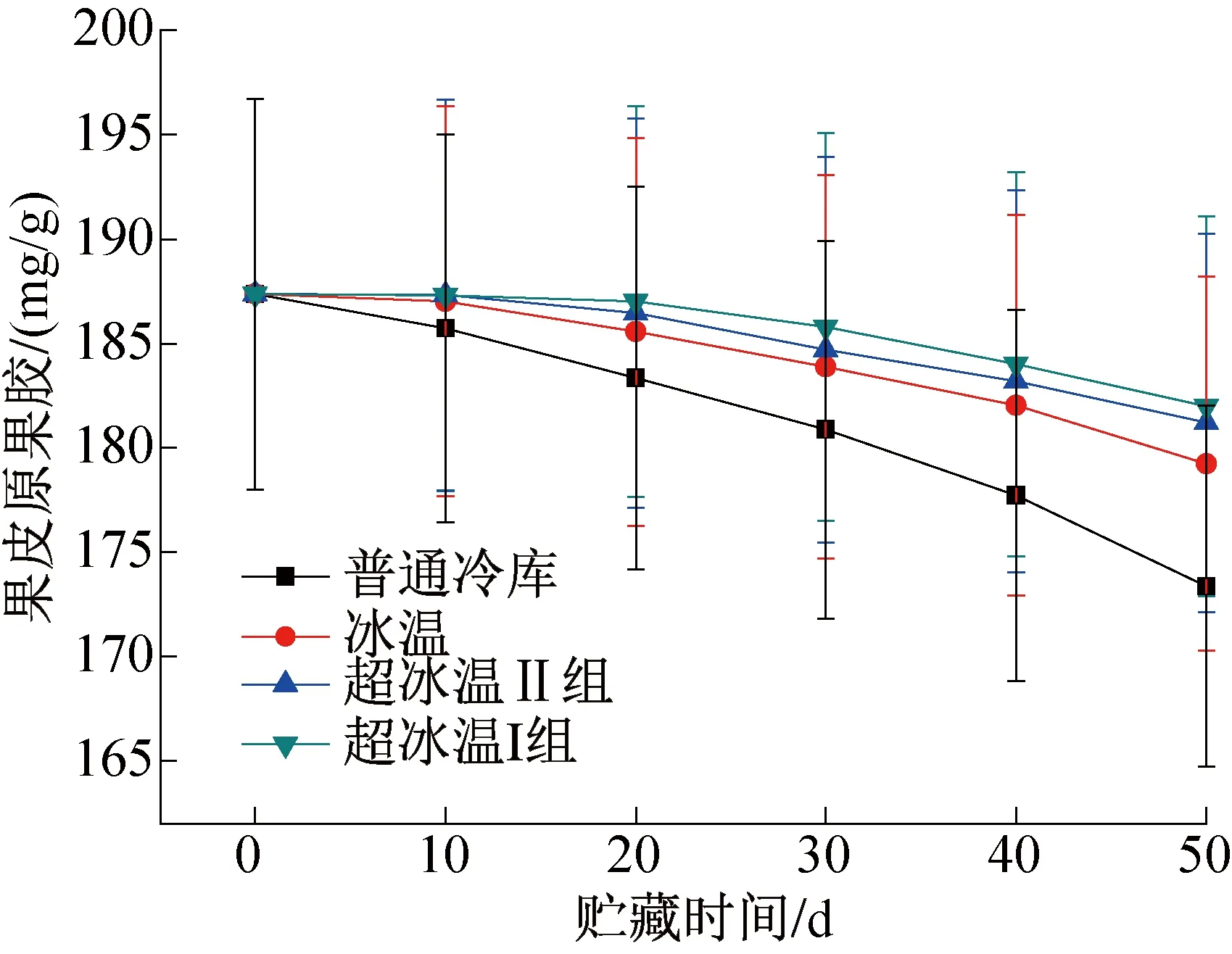
图3 果皮原果胶含量的变化Fig.3 Changes of pericarp pectin content in pericarp
图4所示为不同温度条件下葡萄果皮中可溶性果胶含量的变化。由图4可知,葡萄果皮可溶性果胶的含量明显高于果肉中可溶性果胶含量。不同温度条件下的葡萄果皮中可溶性果胶含量随时间的延长不断升高,普通冷库中的葡萄果皮可溶性果胶上升速率不断增大,且上升的量最多,在第50 d调查时为91.98 mg/g,上升了35.7%;而超冰温I组葡萄果皮可溶性果胶含量在整个贮藏期间仅小幅升高9.1%,-3 ℃超冰温条件可以很好的抑制果皮中原果胶的水解速率,从而控制可溶性果胶含量在较低水平,能够防止果实变软。-3 ℃超冰温条件不仅可以有效抑制葡萄果皮可溶性果胶含量的升高,还可以减慢贮藏前期葡萄果实进一步成熟的速率,使葡萄有更好的贮藏价值。
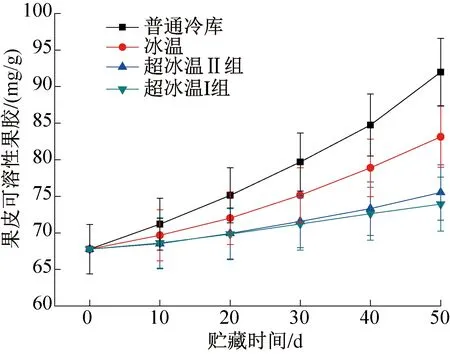
图4 果皮可溶性果胶含量的变化Fig.4 Changes of soluble pectin content in pericarp
2.2 贮藏期间果胶酶含量的变化
在果实细胞中,广泛分布着负责降解果胶物质的酶,目前为止,已发现多种降解果胶多糖的酶类,主要包括多聚半乳糖醛酸酶(PG)、果胶酯酶(PE)、果胶裂解酶(PEL),而PEL多存在于微生物,特别是某些感染植物的致病微生物中[19]。本文主要对PG、PE进行测定分析。
2.2.1 多聚半乳糖醛酸酶PG含量变化
多聚半乳糖醛酸酶是一种重要的果胶聚糖酶,根据作用方式不同可分为内切和外切两类,内切作用类型的PG酶具有果实成熟特异性[20]。PG酶主要催化多聚半乳糖醛酸的降解[21],在植物细胞壁降解过程中也起到了关键作用,尽管其含量高低直接影响果实成熟软化的进程,但在不同果蔬中PG酶活性却不尽相同。
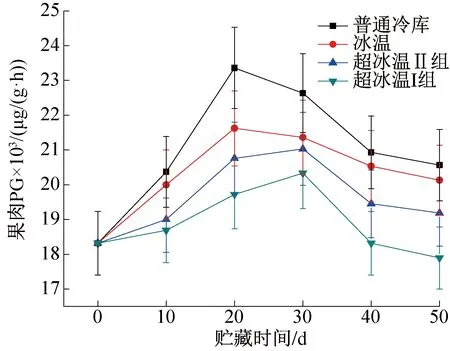
图5 果肉PG含量的变化Fig.5 Changes of PG content in pulp
图5所示为整个贮藏过程中葡萄果肉PG含量的变化。由图5可知,在不同温度条件下贮藏的葡萄果肉PG含量均呈先升高后下降趋势,原因是贮藏前期部分葡萄未完全成熟,处在成熟的中后期,因此各温度条件下的葡萄果肉中PG含量在贮藏前期均出现不同程度的升高,葡萄完全成熟时PG含量达到最大值然后下降。其中,超冰温的两组葡萄果肉PG含量在前30 d均不断上升,但上升速度越来越慢,超冰温I组(-3 ℃±0.3 ℃)相对更慢,从第30 d开始出现下降;冰温组的葡萄果肉PG含量在前20 d快速上升,第20 d开始出现下降;而普通冷库的葡萄果肉PG含量在前20 d上升速度最快,且在整个贮藏过程中PG酶含量始终处于最高水平。-3 ℃时葡萄组织细胞的新陈代谢率最小,所消耗的能量也最小。故-3 ℃超冰温条件能有效抑制PG酶活性的升高,减慢葡萄成熟的速度及原果胶的水解速度,对于葡萄软化起到更好的延缓作用。
图6所示为整个贮藏过程中葡萄果皮PG含量的变化。由图6可知,果皮PG含量整体高于果肉PG含量。不同温度环境下葡萄果皮PG含量均表现为先上升后下降,与果肉PG含量变化趋势一致。超冰温I组(-3 ℃±0.3 ℃)的葡萄果皮PG含量升高的幅度最小,变化速度最慢;超冰温Ⅱ组和冰温组葡萄果皮PG含量整个贮藏期间含量相差较小;普通冷库的果皮PG含量变化幅度最大,前期升高速度也最快,整个贮藏期间一直处于最高水平。在贮藏前期部分葡萄果实未完全成熟时,果皮PG含量不断上升,导致原果胶水解速度不断增大,直至果实完全成熟;贮藏后期虽PG含量有所下降,原果胶水解速率降低,但水解过程还在不断进行,致使果皮硬度持续下降,直至软化腐烂,失去对果肉的保护作用。-3 ℃超冰温条件最能抑制果皮PG活性的升高,降低原果胶的水解速度,防止果皮软化过快。
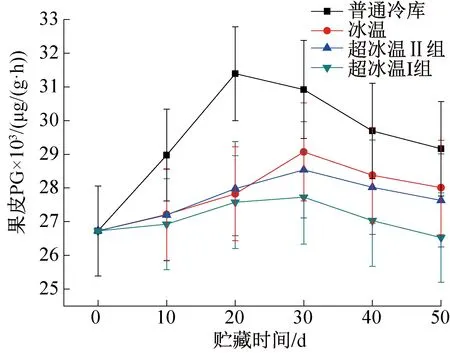
图6 果皮PG含量的变化Fig.6 Changes of PG content in pericarp
2.2.2 果胶酯酶PE含量变化
果胶酯酶是一种重要的果胶水解酶,能将甲酯化的果胶酯酸水解为果胶酸,产物可与Ca2+等二价阳离子结合形成蛋箱结构,或成为PG的作用底物,引起果胶降解,破坏细胞壁结构的完整性,导致果实软化变质。因此果胶酯酶对果胶的降解能起到一定的促进作用,且在果实发育早期时活性较大。
图7所示为不同温度条件下葡萄果肉PE含量的变化。由图7可知,4种温度下的葡萄果肉PE含量均出现不断降低的趋势,其中普通冷库葡萄的果肉PE下降速度最快,高达20.8%,冰温下降14.8%,超冰温I组下降速度最慢,仅为9.8%。普通冷库中葡萄果肉PE含量在贮藏的前20 d下降速度很快,后逐渐变慢,冰温组的下降速率第30 d开始变慢,而超冰温的两组葡萄果肉PE下降速度始终处于较低水平。PE是在果实成熟的前期进行酶促反应,而贮藏期属于果实成熟后期,所以出现贮藏过程中不断被消耗而下降的现象。此外,由于PE是作为PG底物的方式进行反应,随着PE的不断消耗降低,贮藏前期PG出现不断上升的趋势,这也会加快原果胶的水解速率,导致果实硬度下降,而-3 ℃超冰温条件可以有效抑制葡萄果肉PE的消耗,降低原果胶水解速率,从而减慢果肉软化的进程。
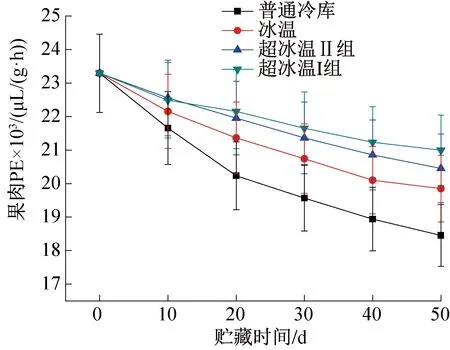
图7 果肉PE含量的变化Fig.7 Changes of PE content in pulp
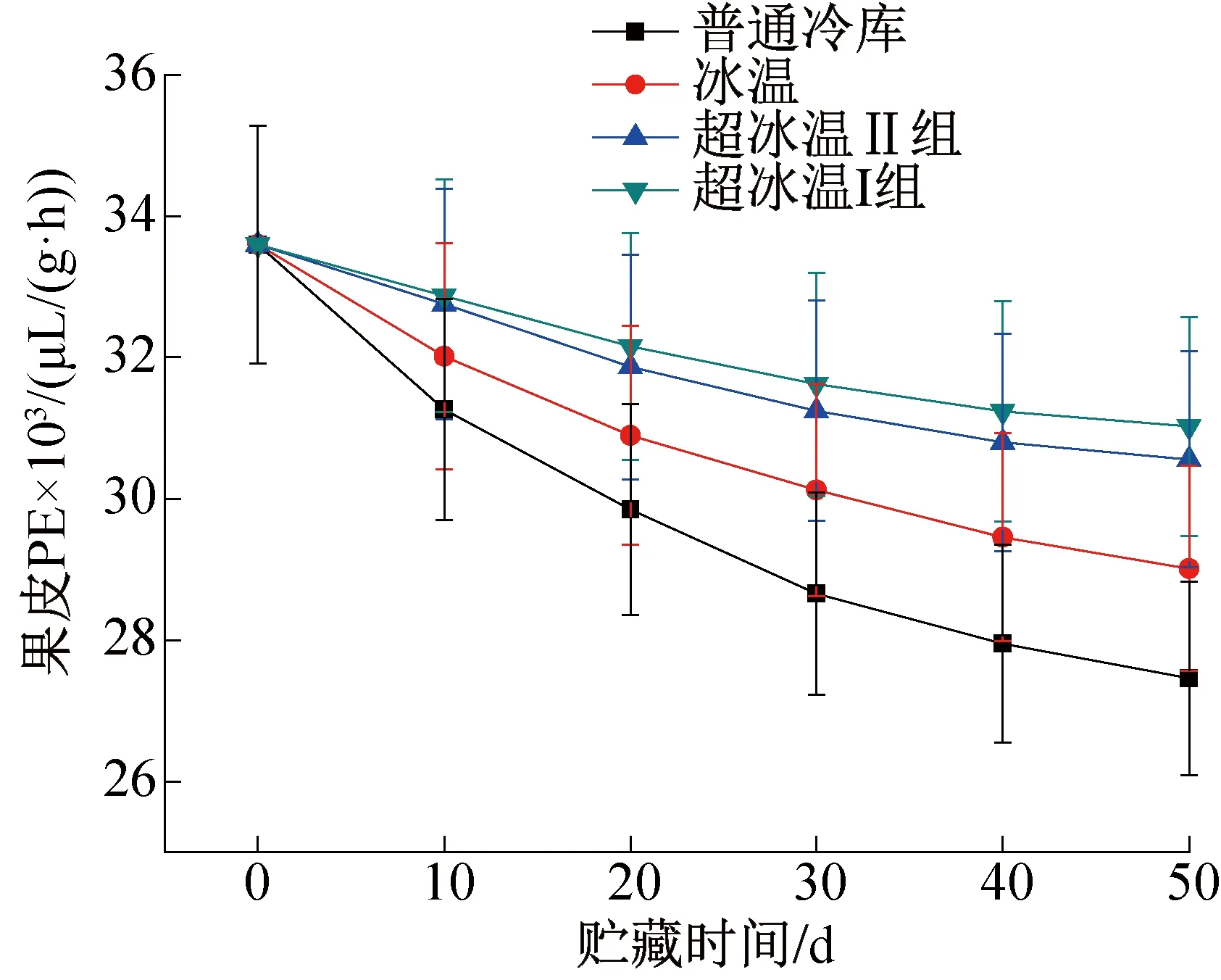
图8 果皮PE含量的变化Fig.8 Changes of PE content in pericarp
图8所示为整个贮藏过程中葡萄果皮PE含量的变化。由图8可知,4种贮藏条件下的葡萄果皮PE含量在整个贮藏期间也是不断下降的,变化趋势与果肉PE含量基本一致。-3 ℃超冰温条件下葡萄果皮PE含量一直保持在最高水平,说明PE作为PG的反应底物消耗量较小,表明原果胶的水解也相对较少,因此-3 ℃超冰温条件能够有效抑制葡萄果皮PE的消耗,降低PG对原果胶水解的促进作用,从而减慢果皮软化的进程,对于维持葡萄硬度,防止葡萄贮藏期出现腐烂变质,延长其保质期有更好的效果。
2.3 相关性分析
2.3.1 果胶与硬度间相关性分析
原果胶水解为可溶性果胶时,随着可溶性果胶含量的升高及原果胶含量的下降,植物细胞组织的完整性和坚实度会受到破坏,出现软化,果实硬度也会下降,通过对果胶及硬度间进行相关性分析,得出硬度与果胶含量间的相关系数及拟合曲线,为研究硬度变化的原因提供更准确的依据。
表1为硬度与葡萄果皮及果肉果胶含量间的相关性分析,硬度与果皮及果肉原果胶含量间表现为极显著的正相关性(P<0.01),相关系数均大于0.9,且与果皮原果胶的相关系数大于果肉原果胶,表明葡萄的硬度受果皮组织结构的影响更大;而硬度与果皮及果肉的可溶性果胶含量均为极显著的负相关性(P<0.01),与果皮可溶性果胶的相关系数高达0.989,果皮的果胶含量对于葡萄的硬度影响非常大,随着可溶性果胶含量的不断增高,葡萄的硬度会持续降低;果皮原果胶与可溶性果胶之间,果肉原果胶与可溶性果胶之间均表现出极显著的负相关性(P<0.01),在贮藏过程中原果胶不断地水解为可溶性果胶,这进一步加剧了果实软化,因此抑制原果胶的水解是防止葡萄发生软化的关键。

表1 硬度与果胶间相关性统计Tab.1 Correlation between hardness and pectin
注:*表示P<0.05;**表示P<0.01。
图9所示为葡萄在贮藏期间硬度与果胶之间的线性拟合线。由图9可知,硬度与果皮及果肉的原果胶间均呈极显著的正相关性,与可溶性果胶之间呈显著的负相关性,线性拟合线R2均大于0.9。原果胶是构成植物细胞骨架和结构关键物质,与纤维素共同承担着细胞壁的支撑作用,对于细胞硬度有十分密切的影响,伴随着葡萄的成熟,原果胶不断水解为可溶性果胶,葡萄硬度会出现持续下降的情况。
2.3.2 果胶酶与硬度间相关性分析
根据以上分析发现葡萄的硬度与其果胶含量之间有着密切关系,而果胶酶对于果胶的水解反应又具有重要的促进作用,因此硬度与果胶酶之间也存在一定的联系,对其进行相关性分析统计。
表2为葡萄的硬度与其果胶酶之间的相关性统计,硬度与果肉及果皮的PG之间无明显的相关性,而与果皮及果肉的PE之间均表现出极显著的正相关(P<0.01),在整个贮藏过程中PE活性与硬度的变化情况一致,均伴随贮藏时间的增加持续降低,PE对于果胶的降解具有一定的促进作用,果胶的降解进一步加剧了葡萄果实硬度降低,使其发生软化变质。
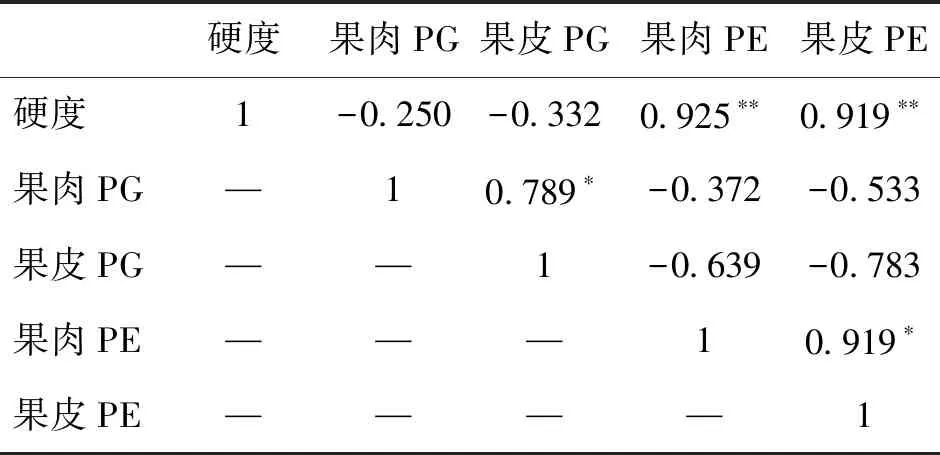
表2 硬度与果胶间相关性统计Tab.2 Correlation between hardness and pectin
注:*表示P<0.05;**表示P<0.01。
图10所示为葡萄的硬度与PE酶之间的线性拟合线。由图10可知,R2均小于0.85,说明偏差较大,但观察散点图可以发现,硬度与PE含量间可能存在二次拟合关系。因此对其再进行二次多项拟合如图11所示,可知二次多项拟合曲线的R2均大于0.9,表明葡萄的硬度与PE酶含量之间更加符合二次多项拟合关系,这对于更好的研究硬度与PE活性的关系提供了依据。
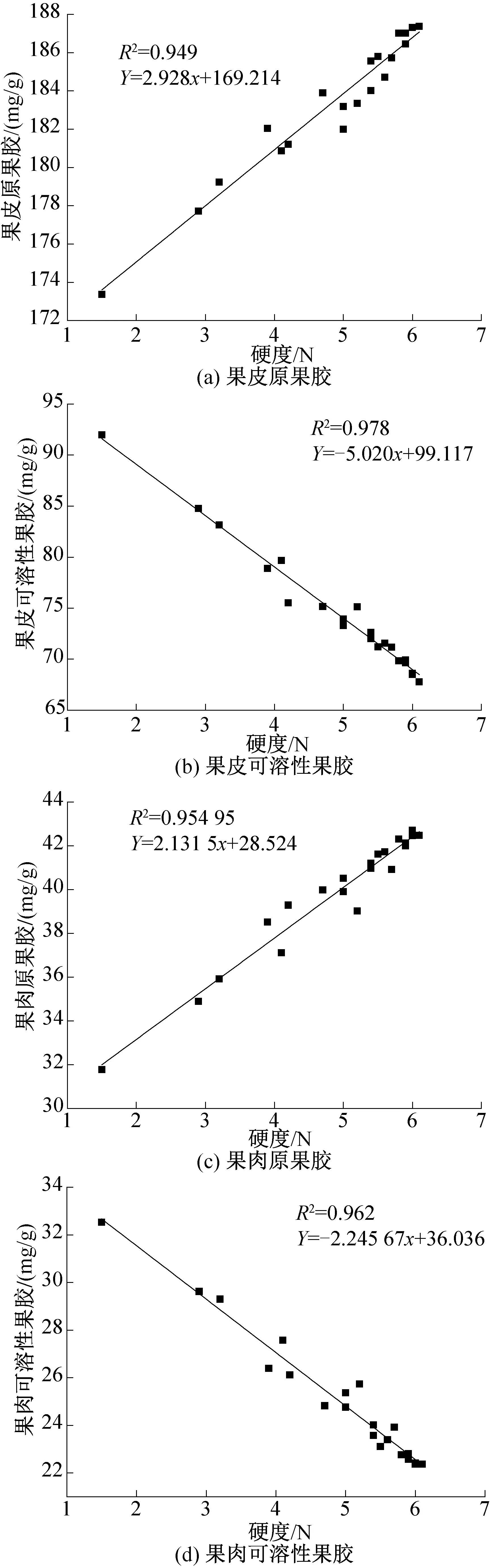
图9 硬度与果胶之间的线性拟合线Fig.9 Linear fitting curve between hardness and pectin
2.3.3 果胶与果胶酶间相关性分析
表3、表4分别为葡萄果肉PE与果胶以及果皮PE与果胶间的相关性统计,果肉PE与其原果胶呈极显著的正相关性(P<0.01),与可溶性果胶呈极显著的负相关性(P<0.01);果皮PE与其原果胶也呈极显著的正相关性(P<0.01),与可溶性果胶呈极显著的负相关性(P<0.01),且PE与可溶性果胶间的负相关系数>与原果胶间的正相关系数。在贮藏期间,原果胶随着PE含量的降低逐渐降低,PE作为PG的反应底物被消耗,促进原果胶不断水解为可溶性果胶,而可溶性果胶含量变大正是葡萄硬度下降的主要原因。
基于以上分析,将葡萄果肉PE与果胶之间进行线性拟合如图12所示。由图12可知,葡萄的果肉原果胶含量与PE活性存在正相关,在贮藏期间都伴随藏时间增长持续降低,线性拟合方程R2=0.871,偏差较小;而果肉的可溶性果胶含量与PE活性之间表现为负相关,随着PE活性的降低,可溶性果胶含量逐渐升高,说明PE对于葡萄果肉中原果胶水解过程的确具有一定的辅助作用。
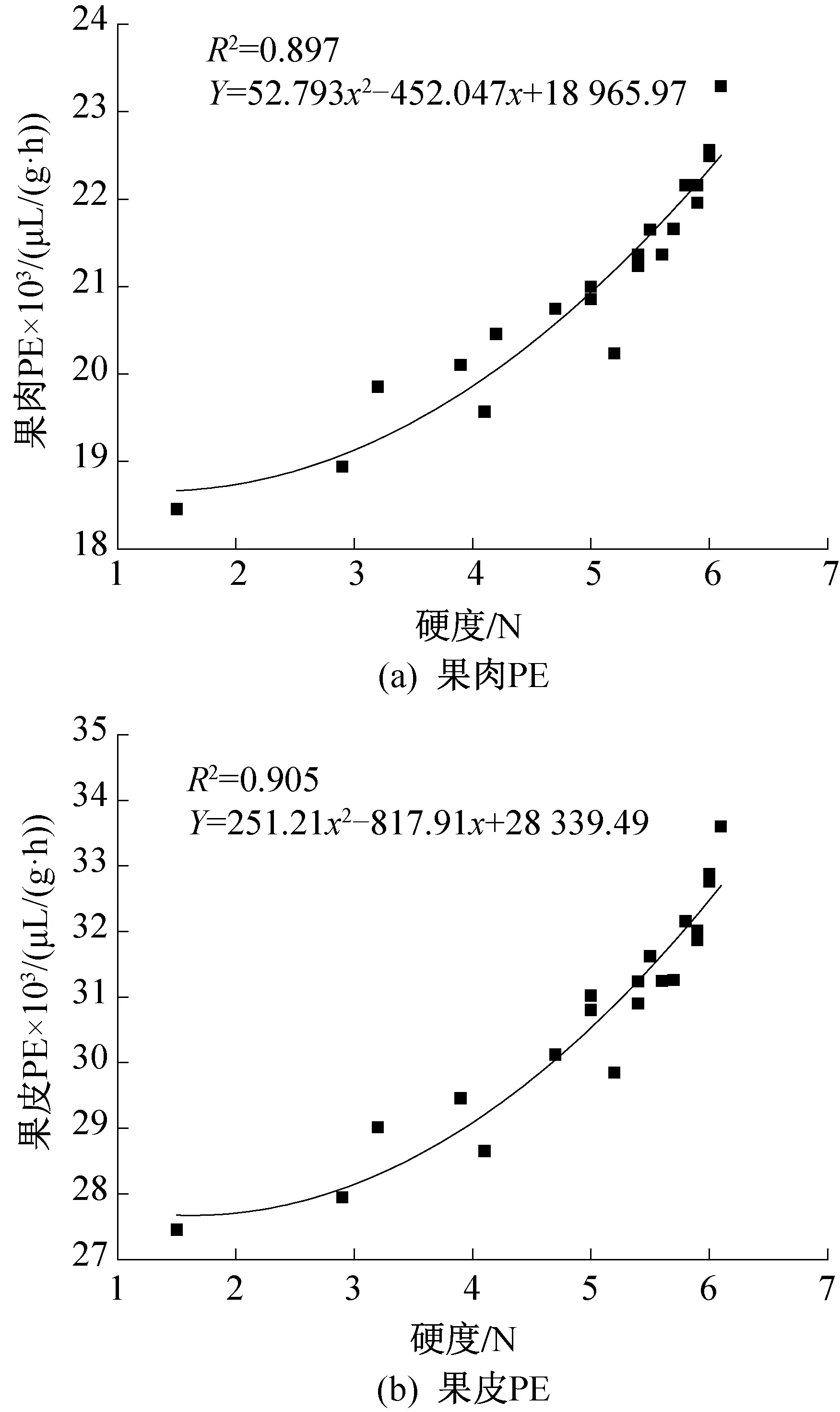
图11 硬度与PE酶间二次多项拟合曲线Fig.11 Two multinomial fitting line between hardness and PE enzyme

表3 果肉PE酶与果胶含量间相关性统计Tab.3 Correlation between PE enzyme and pectin content in pulp
注:*表示P<0.05;**表示P<0.01。
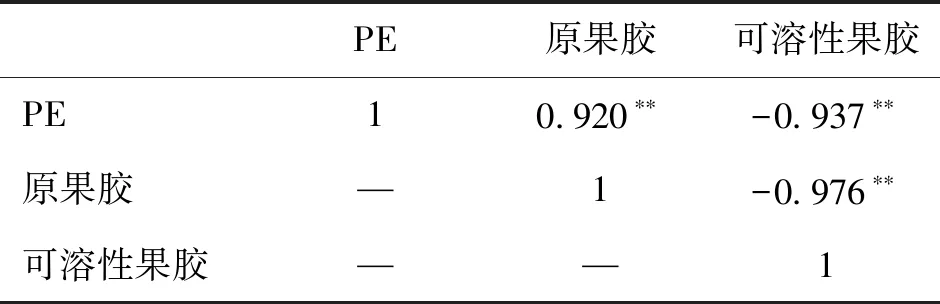
表4 果皮PE酶与果胶含量间相关性统计Tab.4 Correlation between PE enzyme and pectin content in pericarp
注:*表示P<0.05;**表示P<0.01。
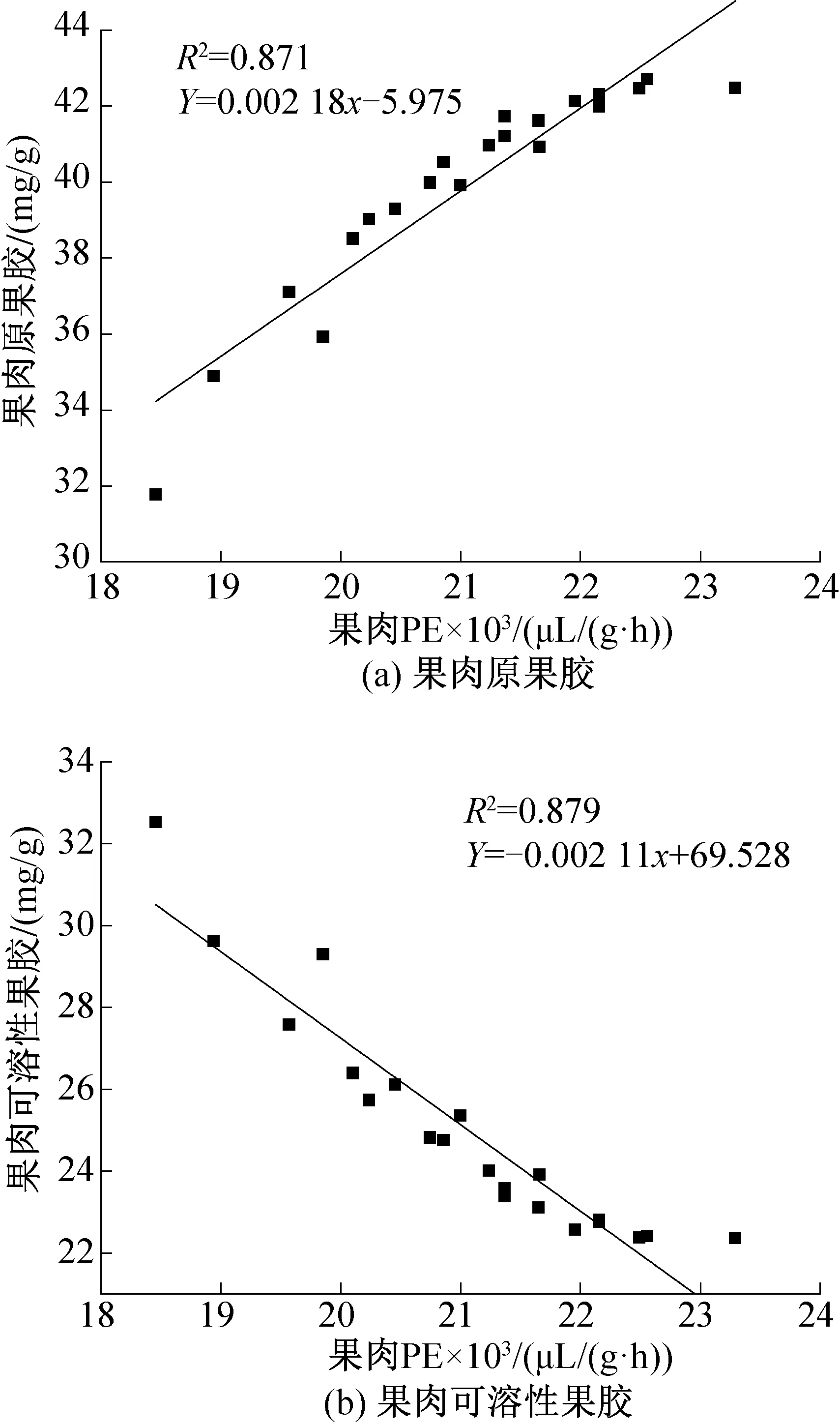
图12 果肉PE酶与果胶间线性拟合Fig.12 Linear fitting between PE enzyme and pectin
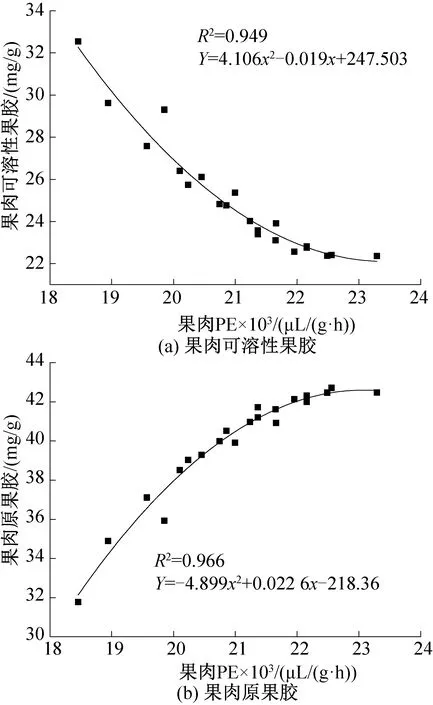
图13 果肉PE酶与果胶间二次多项拟合曲线Fig.13 Two multinomial fitting line between PE enzyme and pectin
观察图12中的散点可以发现,其分布符合二次多项式曲线,因此对其分别进行二次多项拟合可得图13,可得果肉PE与其原果胶间二次拟合方程R2=0.966,与可溶性果胶二次拟合方程R2=0.939,均大于线性拟合方程R2,说明葡萄果肉PE含量与其果胶之间更加符合二次方程的关系,偏差更小,为研究葡萄果肉果胶及其PE活性间的关系提供了更加准确的定量分析依据。
图14所示为葡萄果皮果胶与其PE含量间的线性拟合线。由图14可知,果皮PE含量与原果胶含量拟合方程斜率为正,说明葡萄果皮PE与其原果胶含量在贮藏期间的走势相同,但R2=0.837,偏差较大;而PE与果皮可溶性果胶含量间拟合方程斜率为负数,表明可溶性果胶含量升高时PE活性反而下降。由于PE主要是在葡萄成熟前期发挥作用,而在成熟的中后期即贮藏期间主要作为PG的底物参与原果胶的水解反应,因此随着贮藏时间的延长PE含量反而由于不断被消耗呈现下降趋势。
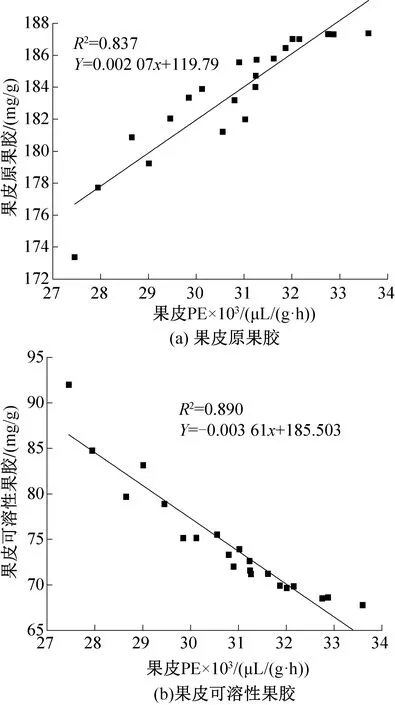
图14 果皮PE酶与果胶间线性拟合线Fig.14 Linear fitting between PE enzyme and pectin
图15所示为葡萄果皮PE与其果胶含量间二次多项拟合曲线。对比线性拟合方程可以发现,二次拟合后R2更大,说明偏差更小,有助于更加准确的判断葡萄PE与其果胶含量间的关系。由图15可以看出,尽管葡萄的原果胶含量随着PE含量的增大不断升高,但升高速率越来越小,表明在前期PG活性不断升高时,原果胶水解速度和PE活性下降速度均较大,后期逐渐变小。因此,有效抑制贮藏过程中PE含量的迅速下降对抑制原果胶的水解速率具有一定的缓解作用,这也能降低葡萄果实硬度下降的速度,延长保质期。
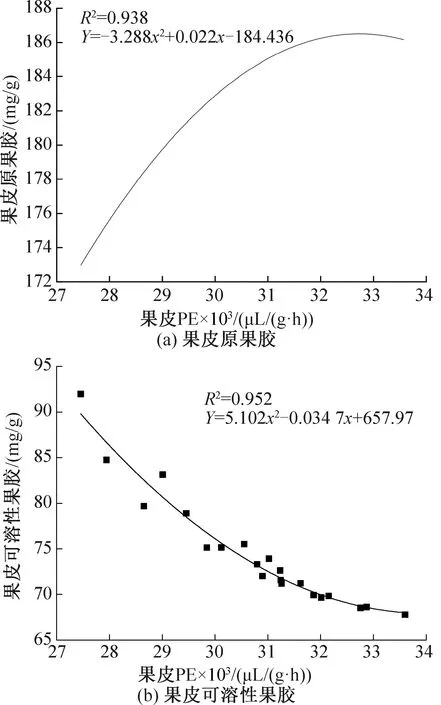
图15 果皮PE酶与果胶间二次多项拟合曲线Fig.15 Two multinomial fitting line between PE enzyme and pectin
3 结论
本文对超冰温(-3 ℃及-2 ℃)、冰温(-1 ℃)及普通冷库(4 ℃)4种不同贮藏温度下的葡萄的果胶物质含量和果胶酶活性进行测定并分析,得到如下结论:
1)无论是葡萄的果皮还是果肉,其原果胶含量均伴随贮藏时间的延长持续下降,而可溶性果胶含量持续升高,且贮藏温度越低变化幅度越小,-3 ℃超冰温条件下原果胶下降及可溶性果胶升高的幅度均最小。
2)葡萄果皮及果肉中PG含量均随贮藏时间的延长呈先升高后下降的趋势,而PE含量则不断下降;-3 ℃超冰温环境下的葡萄PG活性在第40 d达到最大,且最大值相对较小,在该环境下葡萄可以进一步成熟且速度缓慢,有利于延长葡萄贮藏时间。
3)葡萄的硬度与原果胶间呈极显著的正相关性,与可溶性果胶呈极显著的负相关性,原果胶不断水解为可溶性果胶是葡萄硬度下降的最主要原因;PE与原果胶及可溶性果胶间均有明显的二次拟合关系。
