2型糖尿病模型小鼠造模时间的选择*
2019-06-20杨张良童海玲孙梦蝶王旭焘齐敏友
杨张良,童海玲,孙梦蝶,袁 杰,胡 莺,王旭焘,齐敏友
(浙江工业大学药学院药理研究所,杭州 310014)
糖尿病(diabetes mellitus,DM)可引起多系统损害,导致心脏、肾、眼、神经和血管等组织器官的慢性进行性病变,功能减退及衰竭,严重影响患者的生活质量,对其病因病理及治疗亟待研究,故建立合适的糖尿病模型至关重要[1-3]。2型糖尿病动物模型可以分为自发性糖尿病动物模型、转基因糖尿病动物模型和药物诱导致糖尿病动物模型。自发性糖尿病动物模型有KK-Ay小鼠、ob/ob小鼠和db/db小鼠等类型;转基因型动物模型有MKR小鼠、MC4R-KO模型等种类[4-7]。第三类为通过药物诱导致糖尿病动物模型的方法。由于其成本低、操作简便等优点,已被广泛应用。
目前较多的文献都聚焦于如何获得或者制备糖尿病动物模型,而对糖尿病动物模型病理和生化等指标随时间变化的规律的报导较少,尤其是对组织和器官等出现明显适合研究的病变时间点报导较为模糊。基于此,本实验通过建立高脂饲料联合小剂量STZ诱导的2型糖尿病小鼠动物模型,检测和分析造模后不同时期2型糖尿病小鼠血生化指标及心和肾组织病理变化情况,观察2型糖尿病小鼠心和肾疾病的病变过程,判断组织器官发生病理和生化改变的时间,为2型糖尿病模型小鼠选择造模最佳时间提供参考依据。
1 材料与方法
1.1 试剂与设备
链脲佐菌素(HPLC≥98%,美国Sigma公司);强生稳豪型血糖仪、血糖试纸(Onetouch ultraeasy,美国Johnson公司);超低温冰箱(702,美国Thermo公司);电子天平(AL104,瑞士Mettler Toledo公司);超纯水仪(PURELAB Classical,英国ELGA);大容量高速冷冻离心机(Z36HK,德国Hermle公司);恒温水浴箱(WB22LA,德国Memmert公司);倒置荧光显微镜(TI-S,日本Nikon公司)。
1.2 实验动物和模型建立
雄性ICR小鼠40只,SPF级,体重(20±2)g,由浙江省实验动物中心提供,合格证号:SCXK(浙)2017-0001。32只小鼠高脂饲料(常规饲料78.5%,猪油10%,蛋黄粉10%,胆固醇1%,胆盐0.5%),喂养8周后连续5 d腹腔注射链脲佐菌素(30 mg/kg),制备2型糖尿病模型小鼠。9 d后,禁食12 h后,通过尾部取血,测量空腹血糖,若空腹血糖值>11.1 mmol/L,即可判定为小鼠造模成功[8]。将造模成功的小鼠随机分成3组:造模4周、6周、8周组。分别于成模后第4、6、8周处死一组小鼠。另各取8只雄性ICR小鼠作为对照组,常规饲料喂养,与糖尿病组小鼠同时处死。
1.3 一般指标检测
小鼠隔夜禁食不禁水,次日称体重并测定空腹血糖。
1.4 样本收集及脏器系数计算
血样本留取:小鼠摘眼球取血,常温静置6 h,取上清,-20℃冰箱保存待用。脏器系数测定:取血后立即处死小鼠,迅速取出心脏,挤出心腔血液,剪心耳及心包膜,生理盐水洗净称取全心重;剪心房及右心室,称取左室重;取出小鼠两侧肾脏去除肾包膜后用生理盐水洗净擦干后称重。计算公式如下:心脏脏器系数 = 心脏质量(g)/体重(g)×100%,肾脏脏器系数=肾脏质量(g)/体重(g)×100%。组织样本留取:各组小鼠处死后分别取小鼠心脏和肾脏组织,放入4%多聚甲醛溶液中24 h。
1.5 生化指标检测
采用全自动生化分析仪检测血清肌酸激酶(creatine kinase,CK)、血清乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酐(creatinine,CR)和尿素氮(blood urea nitrogen,BUN)的含量。
1.6 病理学检测
心肌组织:心肌组织固定72 h后,乙醇梯度脱水,二甲苯透明,浸蜡,包埋,切片,进行HE染色、Masson染色,400倍光镜下观察。肾脏组织:肾脏组织固定72 h后,乙醇梯度脱水,二甲苯透明,浸蜡,包埋,切片,进行HE染色、PAS染色,400倍光镜下观察。
1.7 统计学处理
2 结果
2.1 糖尿病小鼠造模情况
造模前各组小鼠之间血糖和体重不存在统计学差异,注射STZ造模成功后各组小鼠之间血糖和体重同样不存在统计学差异(表1)。说明分组后各组小鼠状态一致,对本实验结果不存在影响。注射STZ后,小鼠的血糖值超过11.1 mmol/L的阈值,表明造模成功[8]。

Tab. 1 Blood glucose and weight levels in four groups of mice n =8)
**P<0.01vscontrol group
2.2 糖尿病小鼠一般特征及脏器系数随时间变化的改变
与对照组相比,除了第4周组的体重和心脏脏器系数未呈现显著性差异,其他指标均呈显著性差异(P<0.05,表2)。而且成模后小鼠体重随时间的增长逐渐下降;成模后心脏脏器系数和肾脏脏器系数则随时间的增长逐渐增大,且第8周组小鼠心脏脏器系数与第4周组之间存在统计学差异(P<0.05,表2)。说明随患病时间增加,小鼠体重会随之降低,而心脏和肾脏会逐渐肥大。
2.3 糖尿病小鼠心肌功能和肾功能随时间变化的改变
在造模成功后,随时间增长,CK、LDH、Cr和BUN都有增长的趋势。第8周组小鼠CK、LDH、Cr和BUN均显著大于第4周组小鼠(P<0.01,表3),且CK、LDH和BUN显著大于第6周组小鼠(P<0.05,表3)。与对照组相比较,第4周组小鼠除了Cr外,其余均未呈现出显著性差异;第6周组小鼠各指标均与对照组呈现显著差异(P<0.05,表3),第8周组小鼠各指标也与对照组呈现显著差异(P<0.01,表3)。
2.4 糖尿病小鼠各组织病理学观察
心肌采用HE染色和Masson染色。HE染色(图1)可以观察心肌病变的整体情况,Masson染色(图2)侧重观察小鼠心肌纤维化情况。由图1和图2可知,对照组组小鼠心肌细胞排列整齐、紧致,细胞间及血管周围的蓝色纤维物质肉眼难以察觉。成模后第4周组小鼠心肌细胞排列整齐,细胞间空隙小,但细胞间以及血管周围存有少量蓝色的纤维物质。第6周组的小鼠心肌细胞排列松散、紊乱,细胞之间有较大的空隙,心肌细胞肥大、肿胀,通过Masson染色可见细胞间以及血管周围出现明显的蓝色呈堆积状分布的纤维物质,这些纤维物质大都分布杂乱。心肌组织已经出现明显炎症现象。第8周组小鼠的心肌组织病理情况持续恶化,细胞间几乎都出现了空隙,心肌细胞肥大甚至破裂,切片中的蓝色纤维物质几乎呈网状与心肌细胞交织在一起。心脏的炎症情况加重,一些细胞甚至出现死亡现象。
肾脏组织采用HE染色和PAS染色;其中HE染色观察整体情况;PAS染色可以观察肾小球系膜基质和系膜细胞增生。图2中对照组小鼠的肾小球结构外形正常,边界清晰,基底膜未出现增厚现象。第4周组小鼠肾小球结构较为清晰,肾小球基底膜稍有增厚,毛细血管襻开放较好,系膜区轻度增生,肾小管未出现萎缩。第6周组小鼠肾小球轻度肥大,肾小球基底膜增厚,出现“双轨”现象,毛细血管襻狭窄、部分闭塞,系膜区轻度增生,肾小管萎缩。第8周组组肾小球严重肥大,大量毛细血管襻堵塞,系膜区增生严重,肾小管基底膜增厚,肾小管管腔萎缩,肾间质可见部分炎性细胞存在。
Fig.1Morphological changes of the myocardial tissues in the mice(HE ×400)
A:Control group,8thweek;B:4thweek;C:6thweek;D:8thweek

Tab. 2 Effects of diabetes mellitus on cardiac organ index and renal organ index n = 8)
*P<0.05,**P<0.01vscontrol group;#P<0.05vs4thgroup
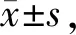
Tab. 3 The serum levels of CK,LDH,Cr and BUN in four groups of mice(mmol/L, n = 8)
CK:Creatine kinase;LDH:Lactate dehydrogenase;Cr:Creatinine;BUN:Urea nitrogen
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vs4thgroup;△P<0.05,△△P<0.01vs6thgroup

Fig.2Morphological changes of the myocardial tissues in the mice(Masson ×400)
A:Control group,8thweek;B:4thweek;C:6thweek;D:8thweek

Fig.3Morphological changes of the renal tissues in the mice(HE ×400)
A:Control group,8thweek;B:4thweek;C:6thweek;D:8thweek
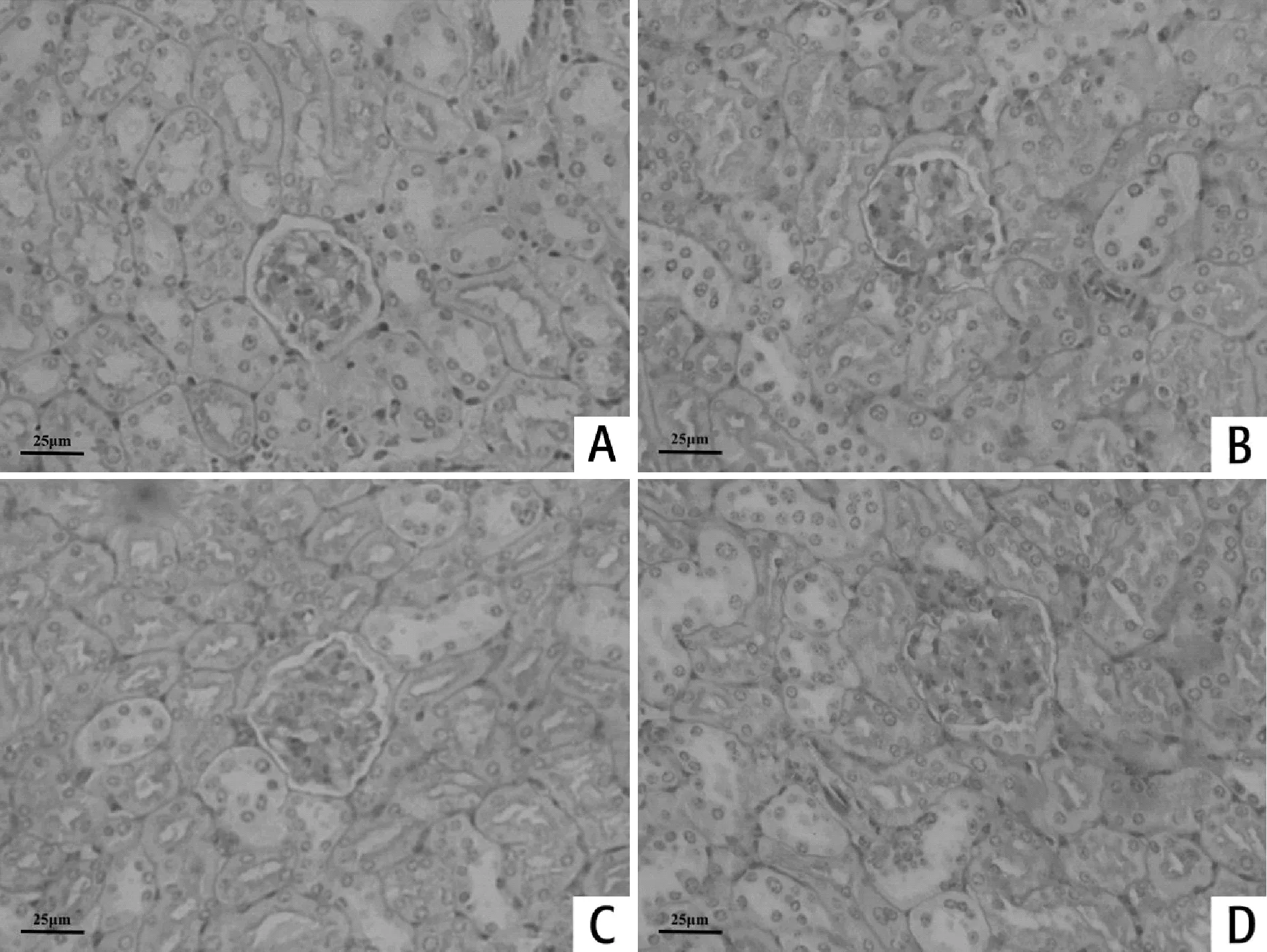
Fig.4Morphological changes of the renal tissues in the mice(PAS ×400)
A:Control group,8thweek;B:4thweek;C:6thweek;D:8thweek
3 讨论
本实验通过高脂饮食结合STZ制备2型糖尿病小鼠模型。小鼠空腹血糖>11.1 mmol/L,伴随出现“三多一少”的现象,即说明糖尿病小鼠模型造模成功。在成模后,第4周、6周、8周各处死一组小鼠,进行病理生化方面的观察与检测。
糖尿病心肌病是一种由糖尿病引起的心肌结构和功能改变的疾病[9]。糖尿病全身系统性的变化如高血糖将会引起糖尿病患者心肌的病变[10]。在本实验中,分别将四组小鼠处死后,采用HE和Masson染色,观察心肌组织病变情况。与对照组对比可见,第4周组情况尚好。第6周组则出现较为明显的异常,细胞排列松散,且细胞间分布纤维化组织,而第8周组则情况继续加重。在生化指标方面,选择测定了与心肌损伤相关的肌酸激酶(creatine kinase,CK)和乳酸脱氢酶(lactic dehydrogenase,LDH)。CK和LDH广泛分布于心肌中;当心肌组织细胞膜受到损伤时,CK和LDH会进入血液中,故可以作为心肌受损的定量指标[11]。与对照组相比,三组数值依次增大,且从第6周组开始,CK和LDH与对照组存在显著性差异。说明患糖尿病的小鼠,随患病时间增加,心肌损伤越严重。
糖尿病肾病是糖尿病微血管并发症之一。糖尿病肾病在病理组织学上的典型表现为肾小球基底膜增厚、系膜扩张或肾小球硬化等病变,且随着疾病的发展损伤更加明显[3]。对照组小鼠肾小球结构清晰无异样。第4周组肾小球总体情况良好,而第6周组小鼠的肾小球则出现较为明显的病变,第8周组小鼠的肾小球情况则继续恶化。生化检测选用血清肌酐(creatina,Cr)和血尿素氮(blood urea nitrogen,BUN),其浓度大小决定于氮类物质的分解和肾脏的排泄功能,故其浓度可以反映肾小球的滤过功能[12]。Cr与BUN的变化情况大致上也与CK和LDH类似,说明患糖尿病的小鼠随患病时间增加肾小球的滤过作用降低,肾功能下降。
综上所述,在成模后,比较成模后第4周、6周和8周的糖尿病小鼠的病理观测和生化检测情况,从第4周开始,生化指标和脏器系数并未全部与正常小鼠呈现出显著差异;且病理切片也显示心肌和肾小球的病变仍较为轻微。而到第6周时,生化指标继续与正常组小鼠扩大差异;从病理切片可见心肌组织和肾脏开始出现明显的病变。第8周时,脏器系数和生化指标均与正常组小鼠出现极显著差别;病理切片显示病变极为明显,小鼠各项情况均为最差,但考虑到实验耗时、成本和老鼠病死等问题,所以若选择第8周为进行实验造模后进行药物干预的时间点,可能已进入病变晚期,难以达到治疗效果。而选择第4周作为药物干预的时间,也存在器官和组织病变情况未达到稳定时期不易观察的问题。所以选择成模后第6周病变处理中期,作为糖尿病小鼠造模后进行药物干预等操作的时间点最为合适。
