MRTFA在卵巢癌组织中的表达及对细胞增殖、迁移和侵袭能力的影响
2019-06-19李娈英杨丽霞李雪玲吴飒司晓辉
李娈英,杨丽霞,李雪玲,吴飒,司晓辉
1漯河市第三人民医院妇产科,河南漯河462000
2河南省焦作煤业集团中央医院妇产科,河南焦作454000
上皮性卵巢癌是女性生殖系统常见的三大恶性肿瘤之一,近年来其发病率逐渐升高,且呈年轻化趋势[1]。该肿瘤发病隐匿,多数患者确诊时已进展至晚期,且术后复发率高,容易产生化疗耐药,具有较高的病死率[2]。研究表明,卵巢癌细胞高侵袭性和转移性是影响患者预后的主要因素[3]。血清应答因子(serum response factor,SRF)作为重要的转录因子,在细胞增殖、分化、迁移、凋亡等生理功能中发挥重要作用。近年来研究发现,SRF在多种恶性肿瘤组织中高表达,且与肿瘤细胞的迁移和侵袭特性有关[4]。心肌素相关转录因子A(myocardin related transcription factor A,MRTFA)作为SAP结构域转录因子家族成员,是SRF的重要辅助因子,在SRF介导的生理功能中发挥重要作用[5]。有研究指出,MRTFA参与了肿瘤细胞的侵袭过程[6]。本研究分析卵巢癌组织中MRTFA的表达情况,并通过下调MRTFA基因表达观察其对卵巢癌细胞生物学特性的影响,以期为卵巢癌发生发展机制的研究提供基础资料,现报道如下。
1 材料与方法
1.1 标本选取
选取2014年2月至2017年8月于漯河市第三人民医院接受手术治疗的82例卵巢癌患者的卵巢组织标本。纳入标准:术前未行放化疗;术后经病理检查确诊。排除标准:临床资料不全者。82例患者,年龄36~78岁,平均(54.2±9.8)岁;组织学类型:浆液性48例,非浆液性34例;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期:Ⅰ期18例,Ⅱ期15例,Ⅲ期43例,Ⅳ期6例;分化程度:低分化44例,中分化24例,高分化14例;淋巴结转移37例,无淋巴结转移45例。术中留取卵巢癌组织和癌旁组织,液氮速冻,保存于-80℃冰箱。本研究经过医院伦理委员会批准,所有患者均对本研究知情并签署知情同意书。
1.2 主要试剂和设备
总RNA提取试剂盒(Trizol法)和Lipofectamine 2000转染试剂均购自美国Invitrogen公司,cDNA合成试剂盒和聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒均购自日本Takara公司,MRTFA及内参引物均由上海生工生物工程股份有限公司设计合成,卵巢癌SKOV3细胞购自美国模式菌种收集中心(American Type Culture Collection,ATCC),DMEM培养基、胎牛血清和胰蛋白酶均购自美国HyClone公司,MRTFA干扰序列及阴性对照序列均由上海美轩生物科技有限公司设计合成,噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)和二甲基亚砜(dimethyl sulfoxide,DMSO)均购自美国Sigma公司,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司,抗MRTFA抗体购自上海华壹生物科技公司,兔抗人SRF、E-钙黏素(E-cadherin)多克隆抗体均购自美国Santa Cruz公司,兔抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体购自美国Epitomics公司,实时荧光定量PCR仪和凝胶电泳分析系统均购自美国Bio-Rad公司。
1.3 方法
1.3.1 实时荧光定量PCR技术检测MRTFAmRNA的表达取卵巢癌组织和癌旁组织,剪碎研磨,加入细胞裂解液,按RNA提取试剂盒说明书提取总RNA,并用紫外分光光度计检测纯度,以A260/A280在1.80~2.20为合格。按cDNA合成试剂盒说明书将总RNA合成cDNA,应用实时荧光定量PCR仪按PCR扩增试剂盒说明书对引物进行扩增。MRTFA上游引物为5'-GGAGCCTGTAAATCTGT-3',下游引物为5'-GACTGCATTCTGGACTAT-3';甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上 游 引 物 为5'-CGAGACACGATGGTGAAGG-3',下游引物为5'-TAGTTCACCCCACTACGACC-3'。反应条件:95 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,循环36次,以GAPDH为内参,应用2-△△Ct法计算卵巢癌组织和癌旁组织中MRTFAmRNA的相对表达量。
1.3.2 细胞培养及分组将卵巢癌SKOV3细胞置于DMEM培养基(含10%胎牛血清、1%链霉素和1%青霉素)中,于5%CO2、37℃培养箱中培养,胰蛋白酶消化,传代。取对数生长期细胞,按照Lipofectamine 2000转染试剂盒说明书对细胞进行转染:MRTFA干扰组,转染MRTFAsiRNA序列5'-CUGCGUGCAUAUCAAGAACAA-3';阴性对照组,转染阴性对照序列5'-AUGUUUGCCAUGAGUAUUA-3';对照组,不作任何处理。转染后,各组细胞继续培养48 h,完成后续实验操作。
1.3.3 MTT法检测细胞的增殖活性取各组转染后培养48 h的细胞,胰蛋白酶消化,按1×105/孔接种于96孔板,每组设6个复孔,恒温培养。分别于培养 24、48、72、96 h时,向各孔中加入 5 mg/ml MTT溶液20 μl,培养4 h,弃去孔内培养基,各加入150 μl DMSO溶液,充分振荡使结晶物溶解,应用酶标仪检测490 nm波长处各孔的吸光度值。
1.3.4 划痕实验检测细胞的迁移能力取各组转染后培养48 h的细胞,胰蛋白酶消化,按2×105/孔接种于6孔板,37℃恒温培养过夜,用200 μl的移液枪枪头垂直于孔板进行划线,用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗掉划出的细胞,加入无血清培养基继续恒温培养,分别在0、24、48 h时拍照。细胞划痕愈合率=[0 h时宽度-24 h(或48 h)时宽度]/0 h时宽度×100%。
1.3.5 Transwell小室检测细胞的侵袭能力取Matrigel基质胶,用不含胎牛血清的培养液按9∶1进行稀释,平铺于Transwell小室的上室,37℃过夜凝固。取各组转染后培养48 h的细胞,胰蛋白酶消化,调整细胞密度为 4×105/ml,取 200 μl加入小室的上室,将600 μl含20%胎牛血清的培养液加入下室,37℃培养24 h,取出小室,甲醛固定,结晶紫染色,显微镜观察拍照,计数穿膜细胞数。
1.3.6 蛋白质印迹(Western blot)法检测MRTFA、SRF、E-cadherin和 α-SMA蛋白的表达 取各组转染后培养48 h的细胞,细胞裂解液裂解,提取总蛋白,按BCA法对蛋白浓度进行检测。取30 μg总蛋白,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳对蛋白进行分离,电转移至醋酸纤维素膜,TBST冲洗3次,室温下用5%脱脂奶粉封闭120 min,加入一抗MRTFA抗体以及兔抗人SRF、E-cadherin、α-SMA多克隆抗体(稀释比例分别为1∶400、1∶800、1∶1200、1∶500),4 ℃孵育过夜,加入二抗,室温反应60 min,加入化学发光试剂,避光反应20 min,拍照,应用Image J软件对条带进行分析。
1.4 统计学分析
采用SPSS 21.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌组织和癌旁组织中MRTFA mRNA相对表达量的比较
卵巢癌组织中MRTFAmRNA的相对表达量为(1.86±0.12),明显高于癌旁组织的(1.15±0.10),差异有统计学意义(t=40.058,P<0.01)。
2.2 不同临床特征的卵巢癌患者卵巢癌组织中MRTFA mRNA相对表达量的比较
不同年龄、组织学类型和肿瘤部位的卵巢癌患者卵巢癌组织中MRTFAmRNA的相对表达量比较,差异均无统计学意义(P>0.05);不同肿瘤直径、FIGO分期、分化程度和淋巴结转移情况的卵巢癌患者卵巢癌组织中MRTFAmRNA的相对表达量比较,差异均有统计学意义(P<0.05)。(表1)

表1 不同临床特征的卵巢癌患者卵巢癌组织中MRTFAmRNA相对表达量的比较( n=82)
2.3 细胞增殖活性的比较
培养24、48、72、96 h后,对照组、阴性对照组、MRTFA干扰组细胞的吸光度值比较,差异均有统计学意义(P<0.05);且MRTFA干扰组细胞的吸光度值均低于阴性对照组和对照组,差异均有统计学意义(P<0.05)。(表2)
表2 不同时间点各组细胞吸光度值的比较(± s)

表2 不同时间点各组细胞吸光度值的比较(± s)
注:a与对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别2 4 h 4 8 h 7 2 h 9 6 h
2.4 细胞迁移和侵袭能力的比较
培养24、48 h后,对照组、阴性对照组、MRTFA干扰组细胞的划痕愈合率比较,差异均有统计学意义(P<0.01);且MRTFA干扰组细胞的划痕愈合率均低于对照组和阴性对照组,差异均有统计学意义(P<0.05)。培养24 h后,对照组、阴性对照组、MRTFA干扰组的侵袭细胞数比较,差异有统计学意义(P<0.01);且MRTFA干扰组的侵袭细胞数少于对照组和阴性对照组,差异均有统计学意义(P<0.05)。(表3、图1)
表3 各组细胞划痕愈合率和侵袭细胞数的比较(± s)
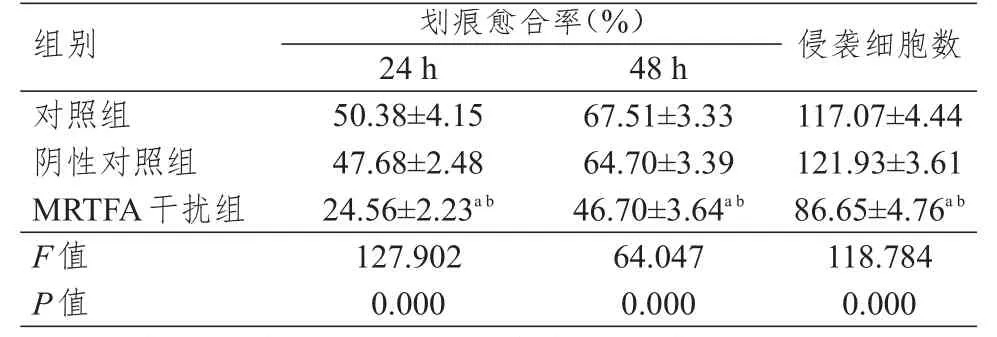
表3 各组细胞划痕愈合率和侵袭细胞数的比较(± s)
注:a与对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别对照组阴性对照组M R T F A干扰组F值P值划痕愈合率(%)2 4 h 5 0.3 8±4.1 5 4 7.6 8±2.4 8 2 4.5 6±2.2 3 a b 1 2 7.9 0 2 0.0 0 0 4 8 h 6 7.5 1±3.3 3 6 4.7 0±3.3 9 4 6.7 0±3.6 4 a b 6 4.0 4 7 0.0 0 0侵袭细胞数1 1 7.0 7±4.4 4 1 2 1.9 3±3.6 1 8 6.6 5±4.7 6 a b 1 1 8.7 8 4 0.0 0 0

图1 细胞划痕实验检测各组细胞的迁移能力
2.5 MRTFA、SRF、E-cadherin和 α-SMA蛋白相对表达量的比较
对照组、阴性对照组和MRTFA干扰组细胞中MRTFA、SRF、E-cadherin和α-SMA蛋白的相对表达量比较,差异均有统计学意义(P<0.01)。阴性对照组和对照组细胞中MRTFA、SRF和α-SMA蛋白的相对表达量比较,差异均无统计学意义(P>0.05);MRTFA干扰组细胞中 MRTFA、SRF和α-SMA蛋白的相对表达量均低于阴性对照组和对照组,E-cadherin蛋白的相对表达量高于阴性对照组和对照组,差异均有统计学意义(P<0.05)。(表4)
表4 各组细胞中MRTFA、SRF、E-cadherin和 α-SMA蛋白相对表达量的比较(± s)

表4 各组细胞中MRTFA、SRF、E-cadherin和 α-SMA蛋白相对表达量的比较(± s)
注:a与对照组比较,P<0.05;b与阴性对照组比较,P<0.05
组别对照组阴性对照组MRTFA干扰组F值P值MRTFA 0.75±0.03 0.85±0.18 0.30±0.07a b 40.445 0.000 SRF 0.66±0.13 0.71±0.11 0.34±0.06a b 22.252 0.000 E-cadherin 0.35±0.06 0.37±0.05 0.73±0.07a b 74.836 0.000 α-SMA 0.69±0.05 0.64±0.04 0.27±0.06a b 123.039 0.000
3 讨论
卵巢癌是致死率较高的妇科恶性肿瘤之一,尽管目前治疗手段不断进步,且患者初始缓解率较高,但超过70%的患者会出现复发[7],而复发是导致患者预后不佳的主要因素[8]。研究表明,肿瘤细胞高迁移性和侵袭性是导致复发的重要原因[9]。MRTFA是一种由807个氨基酸残基组成的SAP蛋白家族成员,是SRF重要的辅助因子,在调控SRF依赖的基因转录中发挥重要作用,与细胞增殖、分化、周期改变及迁移密切相关[10]。本研究结果显示,卵巢癌组织中MRTFAmRNA的相对表达量明显高于癌旁组织(P<0.01),说明MRTFA在卵巢癌组织中高表达,可能参与了卵巢癌的发生。进一步分析发现,肿瘤直径≥10 cm、FIGO分期为Ⅲ~Ⅳ期、低分化和有淋巴结转移的卵巢癌患者卵巢癌组织中MRTFAmRNA的相对表达量均高于肿瘤直径<10 cm,FIGO分期为Ⅰ~Ⅱ期、中高分化和无淋巴结转移的患者(P<0.05),提示MRTFA可能参与了卵巢癌的发展过程。
本研究利用siRNA技术特异性抑制SKOV3细胞中MRTFA基因的表达,Western blot结果显示,MRTFA干扰组细胞中MRTFA蛋白的相对表达量低于阴性对照组和对照组(P<0.05),提示SKOV3细胞中MRTFA基因表达被成功抑制。本研究结果显示,培养24、48、72、96 h后,MRTFA干扰组细胞的吸光度值均低于阴性对照组和对照组(P<0.05),说明特异性抑制细胞中MRTFA基因的表达可有效抑制细胞的增殖活性,提示MRTFA可能参与了细胞的增殖过程。培养24、48 h后,MRTFA干扰组细胞的划痕愈合率均低于阴性对照组和对照组;培养24 h后,MRTFA干扰组的侵袭细胞数少于阴性对照组和对照组,差异均有统计学意义(P<0.05),说明特异性抑制细胞中MRTFA基因的表达可减少细胞的迁移及侵袭能力。研究表明,上皮-间充质转化(epithelial-mesenchymal transition,EMT)在肿瘤细胞的迁移与侵袭过程中发挥关键作用[11]。而SRF则在EMT过程中发挥重要作用,与促进肿瘤细胞获得间质细胞特性密切相关[12]。E-cadherin是EMT过程的直接标志物,而α-SMA则是EMT过程的间接标志物,发生EMT时,E-cadherin蛋白表达量降低,而α-SMA蛋白表达量升高[13]。本研究结果显示,MRTFA干扰组细胞中MRTFA、SRF和α-SMA蛋白的相对表达量均低于阴性对照组和对照组,E-cadherin蛋白的相对表达量高于阴性对照组和对照组,(P<0.05),说明特异性抑制细胞中MRTFA基因表达,可能抑制了SRF蛋白介导的EMT过程,提示MRTFA可能通过SRF蛋白介导的EMT过程参与细胞的迁移和侵袭过程。
综上所述,卵巢癌组织中MRTFA蛋白呈高表达,且表达水平与肿瘤的恶性程度有关,特异性抑制MRTFA基因表达可有效抑制细胞的增殖、迁移和侵袭能力,其机制可能与抑制SRF蛋白介导的EMT过程有关。
