上调miRNA-145表达对非小细胞肺癌细胞增殖、凋亡及放射敏感性的影响
2019-06-11王亚飞宋长亮张振军杨琼杨庚武张磊田云霄宋小天
王亚飞,宋长亮,张振军,杨琼,杨庚武,张磊,田云霄,宋小天
邯郸市中心医院1肿瘤科,3病理科,河北 邯郸056000
2邯郸市骨科医院骨科,河北 邯郸056000
4河北医科大学基础医学院免疫学教研室,石家庄0500170
肺癌是全球疾病致死的最主要原因,是一种侵袭能力和转移能力很强的恶性肿瘤。大部分肺癌患者就诊时已处于中晚期,5年生存率很低,预后效果极差,严重威胁着人们的健康[1]。非小细胞肺癌的发病率约占肺癌的85%[2-3],是一种中度放疗敏感的恶性肿瘤。随着医学的快速发展,近几年临床上针对非小细胞肺癌的放疗取得了突出成绩,放疗已逐渐成为中晚期非小细胞肺癌治疗的有效手段之一,但是由部分患者在治疗的中后期出现抗辐射效应,放疗效果并不理想。因此,如何提高放射敏感性备受学术界的关注。微小RNA(microRNA,miRNA)是一类短小、非编码RNA,在维持机体自身稳态、免疫应答、生长发育和新陈代谢等过程中发挥重要的作用。大量的研究表明,miRNA能够影响肿瘤细胞的放射敏感性[4-6]。其中,关于miRNA-145的研究较多,其在多种肿瘤组织或细胞中低表达,与肿瘤的增殖、凋亡等生理过程密切相关[7-8]。有研究报道,miRNA-145还能够增强宫颈癌等肿瘤细胞的放射敏感性[9],但其在非小细胞肺癌中的作用及其对肿瘤细胞放射敏感性的研究报道较少。本研究分析了miRNA-145在A549细胞中的表达情况,并探讨了干扰其表达对A549细胞增殖、凋亡的作用及其对细胞放射敏感性的影响。
1 材料与方法
1.1 材料及试剂仪器
人正常肺上皮细胞株BEAS-2B和非小细胞肺癌细胞株A549均购于中国科学院上海细胞库。RPMI1640培养基、青链霉素和胎牛血清均购于美国Hyclone公司。LipofectamineTM2000转染试剂、聚合酶链反应(polymerase chain reaction,PCR)试剂盒均购于美国Invitrogen公司。miRNA-145模拟物(miRNA-145 mimic)、miRNA-145阴性对照(control miRNA)质粒、内参U6引物和miRNA-145引物均购于广州锐博生物科技技术有限公司。RNA反转录试剂盒购于大连TaKaRa公司,总RNA提取试剂盒购于北京索莱宝科技有限公司。四甲基偶氮唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂和膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡试剂盒均购于上海碧云天生物技术有限公司。流式细胞仪购于美国BD公司。凝胶成像系统、电泳仪和逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)仪均购于美国BioRad公司。核酸浓度检测仪(NanoDrop 2000c)购于美国Thermo Scientific公司。医用加速器购于美国Varian公司。
1.2 实验方法
1.2.1 细胞培养 从液氮中取出保存的BEAS-2B细胞和A549细胞,迅速置于37℃水浴锅中解冻复苏后,接种到RPMI1640培养基(含有10%胎牛血清+100 U/ml青霉素+0.1 mg/ml链霉素)中,在37℃、5%CO2和95%湿度的培养箱中常规培养。当细胞融合度达80%左右时,以0.25%胰蛋白酶消化,按1∶2传代培养。
1.2.2 细胞分组与转染 收集对数生长期的A549细胞,以105/ml细胞密度,每孔2 ml接种于6孔细胞板上,将其随机分为miRNA-145组、NC组和对照组3组。次日,参照LipofectamineTM2000转染试剂说明书将终浓度为80 nmol/L的miRNA-145模拟物转染至miRNA-145组细胞中,miRNA-145阴性对照质粒转染至NC组细胞中,对照组细胞只加入转染试剂。采用RT-PCR检测各组细胞中miRNA-145的相对表达量以评价其转染效果。
1.2.3 RT-PCR检测miRNA-145表达情况 收集生长良好的BEAS-2B细胞和A549细胞,以总RNA提取试剂盒提取总RNA,NanoDrop 2000c检测RNA的纯度和浓度。采用RNA反转录试剂盒合成cDNA后,进行PCR。PCR扩增条件:95℃预变性300 (s1个循环);95℃变性30 s,60℃退火30 s和72℃延伸120 s,共40个循环;72℃总延伸360 s(1个循环)。每组重复3次。内参基因为U6,采用2-△△Ct法计算miRNA-145的相对表达量。1.2.4 MTT法检测细胞增殖情况 收集对数生长期的A549细胞,调整细胞浓度为5×104/ml后接种于96孔板上,于CO2恒温培养箱中常规培养。次日,将其按照1.2.2中的步骤进行分组与转染,分别在处理24、48、72 h时收集各组细胞,加入MTT溶液,孵育4 h后,再加入二甲基亚砜,反应20 min,采用酶标仪在570 nm处检测各组细胞的光密度(optical density,OD)值。每组设3个复孔。
1.2.5 流式细胞术检测细胞凋亡情况 收集转染48 h生长良好的对照组、NC组和miRNA-145组细胞,用胰蛋白酶消化后制成浓度为105/ml的细胞悬液。根据细胞凋亡检测试剂盒说明书操作,依次加入 Annexin V-FITC 5 μl和 PI 10 μl,振荡混匀,37℃下避光培养15 min,通过流式细胞术(flow cytometry,FCM)检测各组细胞的凋亡率。每组重复3次。
1.2.6 细胞放射敏感性检测 收集生长良好的对数生长期A549细胞接种于6孔板上,随机分为2组,以转染miRNA-145模拟物的细胞为miRNA-145组,以未做处理的细胞为对照组。常规培养至细胞贴壁后,两种细胞均给予剂量为2、4、6、8 Gy的6MV X线进行照射。照射条件:剂量率为100 cGy/min,照射源-皮距(source-skin distance,SSD)为100 cm。照射结束后,采用克隆形成实验检测细胞的放射敏感性。更换培养液,继续培养24 h后,以冷甲醇固定,姬姆萨溶液染色。在显微镜下进行计数,以大于50个细胞为有效克隆。以单击多靶模型拟合细胞存活曲线,经GraphPad Prism 7软件生成平均致死剂量(mean lethal dose,简称 D0)、准域剂量(quasi-domain dose,Dq)、外推数(N)、2 Gy照射后的存活分数(survival fraction at 2 Gy,SF2)和放射增敏比(sensitization enhancement ratio,SER)等参数值。每个剂量点设3个平行实验。
1.3 统计学方法
采用SPSS 21.0统计学软件分析数据。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-145的表达情况
RT-PCR检测结果显示,A549细胞中miRNA-145的相对表达量为(0.08±0.03),明显低于正常肺上皮BEAS-2B细胞的(1.02±0.05),差异有统计学意义(t=27.92,P<0.01)。将miRNA-145模拟物和miRNA-145阴性对照质粒分别转染至A549细胞后,miRNA-145组、NC组、对照组细胞中miRNA-145的相对表达量分别为(13.53±1.25)、(0.95±0.08)、(1.03±0.06),3组比较,差异有统计学意义(F=300.01,P<0.01);NC组和对照组细胞中miRNA-145的相对表达量比较,差异无统计学意义(P>0.05);miRNA-145组细胞中 miRNA-145的相对表达量高于对照组,差异有统计学意义(t=21.146,P<0.05)。
2.2 A549细胞的增殖情况
对照组、NC组、miRNA-145组细胞转染24、48、72 h的OD值比较,差异均有统计学意义(P<0.05);同一作用时间点,miRNA-145组细胞的OD值均低于对照组,差异均有统计学意义(t24h=2.887、t48h=4.070、t72h=3.203,P<0.05),而NC组与对照组细胞的OD值比较,差异均无统计学意义(P>0.05)。(表1)
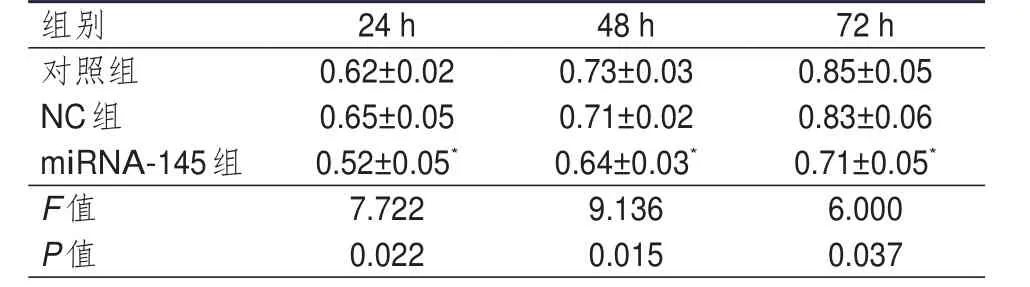
表1 转染后不同时间点各组细胞OD值的比较
2.3 A549细胞的凋亡情况
转染48 h后,对照组、NC组和miRNA-145组细胞的凋亡率分别为(7.45±0.74)%、(8.26±0.82)%和(16.13±1.60)%,3组比较,差异有统计学意义(F=54.736,P<0.01);NC组与对照组细胞的凋亡率比较,差异无统计学意义(P>0.05);miRNA-145组细胞的凋亡率高于对照组,差异有统计学意义(t=9.471,P<0.05)。(图1)
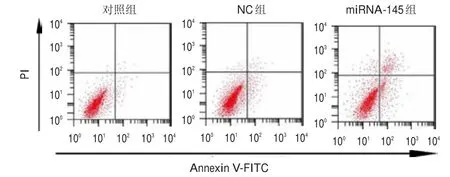
图1 FCM法检测A549细胞的凋亡情况
2.4 上调miRNA-145表达对非小细胞肺癌A549细胞放射敏感性的影响
以2、4、6、8 Gy不同剂量的X线照射对照组和miRNA-145组细胞,根据打击多靶模型拟合A549细胞的存活曲线,结果显示,不同剂量的X线照射后miRNA-145组细胞的存活分数(survival fraction,SF)均高于对照组,差异均有统计学意义(P<0.05)(图 2)。miRNA-145组细胞的D0、Dq、N、SF2分别为1.439 Gy、1.292 Gy、2.454、0.505,对照组细胞的 D0、Dq、N、SF2分别为 2.146 Gy、2.262 Gy、2.869、0.762。上调miRNA-145表达后A549细胞的SER为1.491。

图2 打击多靶模型拟合 A549细胞的存活曲线
3 讨论
miRNA-145位于人类5q32染色体上,是一种高度保守的RNA,具有茎环结构前体,经相关酶切后可形成由21个碱基组成的成熟miRNA-145[10-11]。miRNA-145在肿瘤组织或细胞中异常低表达,其作为抑癌基因参与多种肿瘤的发生发展。Lu等[12]的研究发现,miRNA-145在肾癌组织中表达下调,恢复其表达后肿瘤细胞的增殖、侵袭和迁移过程明显受到抑制,且细胞凋亡显著增加。王寰昱等[13]的研究发现,上调miRNA-145表达能有效抑制肝癌细胞的细胞周期进展和侵袭转移,并促进细胞凋亡。近年来,有报道发现miRNA-145在非小细胞肺癌患者的组织和血清中低表达,与非小细胞肺癌的发生发展密切相关[14]。但miRNA-145表达与非小细胞肺癌细胞增殖、凋亡关系的研究较少。本研究发现,与正常肺上皮BEAS-2B细胞比较,miRNA-145在A549细胞中低表达;以脂质体法上调其表达后,同一作用时间点,miRNA-145组细胞的OD值均低于对照组,细胞的增殖能力受到抑制;而转染48 h后miRNA-145组细胞的凋亡率高于对照组,细胞的凋亡能力增强。提示上调miRNA-145表达可通过抑制肿瘤细胞的增殖并促进其凋亡来抑制非小细胞肺癌的发生发展。
放疗是非小细胞肺癌中晚期常用的一种治疗方法,主要是通过放射线的辐射能量作用于DNA分子,引起DNA损伤,促进细胞凋亡,进而起到治疗非小细胞肺癌的作用[15]。miRNA在非小细胞肺癌的发生发展过程中发挥着重要的作用[16]。miRNA-145是miRNA中的重要一员,在调节肿瘤细胞放射敏感性方面发挥着重要的作用。Ye等[17]的研究结果显示,miRNA-145在宫颈癌组织和细胞中的表达明显降低,过表达miRNA-145可通过靶向DNA损伤修复相关基因解旋酶样转录因子,增强体内和体外宫颈癌细胞的放射敏感性。同时,Yan等[18]还发现miRNA-145可通过下调八聚体结合转录 因 子 4(octamer-binding transcription factor 4,OCT4)的表达增强宫颈癌细胞的放射敏感性。Gong等[19]在前列腺癌小鼠模型实验中发现,异常高表达的miRNA-145可增强辐射对细胞的杀伤作用。为了进一步探讨miRNA-145对非小细胞肺癌A549细胞的放射敏感性,本研究以不同放射剂量照射A549细胞后,经克隆形成实验检测发现,miRNA-145组细胞的 D0、Dq、N、SF2均低于对照组,上调miRNA-145表达后A549细胞的SER为1.491。结果提示,上调miRNA-145表达可增强非小细胞肺癌A549细胞的辐射杀伤作用。
综上所述,miRNA-145在非小细胞肺癌细胞中相对表达量较低,上调其表达能够抑制非小细胞肺癌细胞增殖,促进细胞凋亡,增强肿瘤细胞的放射敏感性。本研究结果丰富了非小细胞肺癌的发生机制,同时也为以miRNA-145为靶点的非小细胞肺癌放疗的临床应用提供了理论依据。然而,miRNA-145调控肿瘤的发生发展及放射敏感性的分子机制十分复杂,有待进一步深入研究。
