不同梅树品种的花芽发育过程及花芽中成花基因和看家基因的表达特性
2019-06-11董天宇葛孟清
陈 政, 董天宇, 葛孟清, 王 晨
(南京农业大学园艺学院, 江苏 南京 210095)
目前对梅树(PrunusmumeSieb. et Zucc.)花期预测主要基于开花物候期与气象因子的相关性研究,通过分析其开花物候期的变化规律及其与气象因子的相关性,得出影响梅树花期的关键气象因子[1];也有研究者通过观察花芽外观形态的动态变化,建立梅树花期需冷量等计算模型[2-4],作为预测梅树花期的依据。 梅树花期预测多采用形态测量法以及建立地区预报模型法等[5]。
植物表型性状的形成是基因与环境共同作用的结果,但表型性状具有滞后性,针对外界条件的改变,基因表达的响应早于表型性状,因而,在基因水平上及早判断,可提升对植物真实生长状态的预见性和采取措施的目的性[6-7]。 植物从营养生长向生殖生长的转变受基因调控,通过基因启动花发育和开花过程[8];基因表达信息可以精确反映植物的生长发育以及营养代谢状态[9]。 梅树成花基因pm-FD、pm-AP2和pm-LFY是梅树花发育的关键基因;其看家基因S3a、homol、hsc、somX2、FRIGIDA-like和Subunit37e是葡萄(VitisviniferaLinn.)花发育期表达量波动相对较大的看家基因,通过NCBI(https:∥www.ncbi.nlm.nih.gov/)比对获得[10]。 梅树花芽中成花基因和看家基因的表达状况基本可以反映其花芽的发育情况。基于此,可通过检测梅树开花基因的表达状况预测其花期。
为了验证利用基因表达状况预测梅树花期的可行性,作者以不同花期的6 个梅树品种为研究对象,观察花芽发育过程中其外部形态和纵剖面结构的变化,同时采用RT-qPCR 技术分析了花芽中3 个成花基因和6 个看家基因的相对表达量变化,探讨成花基因和看家基因相对表达量与开花日期的关系,以期为梅树的花期预测和管理提供参考依据。
1 材料和方法
1.1 实验材料
供试6 个梅树品种均栽植于南京市紫金山南麓的梅花山景区。 该景区面积约102.2 hm2;气候类型属亚热带季风气候,年均降水量1 106.5 mm,空气相对湿度76%,无霜期237 d;土壤类型为壤土。
供试6 个梅树品种为‘粉红朱砂’(‘Fenhong Zhusha’)、‘淡妆宫粉’(‘Danzhuang Gongfen’)、‘淡粉’(‘Dan Fen’)、‘寒红’(‘Han Hong’)、‘南京红’(‘Nanjing Hong’)和‘晚跳枝’(‘Wantiao Zhi’),其中,‘粉红朱砂’和‘淡妆宫粉’为早花品种,‘淡粉’和‘寒红’为中花品种,‘南京红’和‘晚跳枝’为晚花品种。 每个品种选取株龄20 ~30 a 的样树5 株,共30 株样树,分别进行挂牌编号。
1.2 方法
1.2.1 采样时间和采样方法 从2017 年11 月20日开始采样,至2018 年1 月19 日(花芽萌动期)结束,每4 d 取样1 次,共取样16 次,取样日期分别为2017 年的11 月20 日、11 月24 日、11 月28 日、12 月2 日、12 月6 日、12 月10 日、12 月14 日、12 月18 日、12 月22 日、12 月26 日和12 月30 日,2018 年的1 月3 日、1 月7 日、1 月11 日、1 月15 日和1 月19 日。
分别在各样树的南向选择10 根1 年生枝条,在上、中、下节位随机采集花芽,每个品种采集30 枚,用于花芽纵径和横径的测量;其中10 枚花芽用于外部形态和纵剖面结构观察,其余20 枚花芽在液氮中冷冻,-80 ℃保存,用于RNA 提取。
1.2.2 花芽形态观察和测定 用游标卡尺(精度0.01 mm,北京新诺立华仪器有限公司)分别测量花芽纵径和横径,结果取平均值。
取5 枚完整花芽,用DM1000 Leica 体式显微镜(德国Leica 公司)观察花芽的外部形态,并拍照;另取5 枚花芽,用解剖刀纵向剖开,同法观察花芽的纵剖面结构,并拍照。
1.2.3 开花情况调查和统计 于2018 年1 月4 日至1 月24 日,即从花芽出现小面积鳞片开裂至花芽鳞片完全开裂,对各品种的花芽鳞片开裂和开花情况进行调查,每4 d 调查1 次,共调查6 次,调查日期分别为2018 年的1 月4 日、1 月8 日、1 月12 日、1 月16 日、1 月20 日和1 月24 日。
分别在各样株的南向选择10 根1 年生枝条,定株、定时观测和记录枝条上的花芽鳞片开裂总数和花芽总数,同时观测并记录开花数。 按照公式“花芽鳞片开裂率=(花芽鳞片开裂总数/花芽总数)×100%”计算花芽鳞片开裂率;以“花蕾露瓣50%以上且有少许花朵开放”为标准确定可观赏期(花期)[11]。
1.2.4 总RNA 提取及RT-qPCR 反应 将花芽于液氮中研磨,称取80 μg,采用改良的CTAB 法[12]分别提取总RNA;以总RNA 为模板,并参考PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒〔宝生物工程(大连)有限公司〕说明书合成cDNA。

表1 用于梅树花芽中成花基因和看家基因RT-qPCR 反应的引物序列Table 1 Primer sequences used for RT-qPCR reaction of flowering and house-keeping genes in flower bud of Prunus mume Sieb. et Zucc.
以cDNA 为 模 板, 用 Primer3 Input (version 0.4.0)软件分别设计成花基因pm-FD、pm-AP2和pm-LFY以 及 看 家 基 因S3a、homol、hsc、somX2、FRIGIDA-like和Subunit37e的正向引物和反向引物(表1),并由南京金斯瑞生物科技股份有限公司合成引物。 以梅树花芽蛋白延伸因子EF-1a为内参基因进行RT-qPCR 反应,扩增体系及程序根据SYBRⒸPremixExTaqTMⅡ试剂盒〔宝生物工程(大连)有限公司〕说明书完成。 PCR 反应体系包括SYBRⒸPremix ExTaqTMⅡ 10.0 μL、cDNA 1.0 μL、10.0 mol·L-1正向引物和反向引物各0.4 μL,双蒸水补足至20.0 μL。反应程序为:95 ℃预变性60 s;95 ℃变性5 s、60 ℃退火15 s、72 ℃延伸20 s,40 个循环;最后于72 ℃延伸10 min。 每个样品3 次重复,采用2-ΔΔCt计算各基因的相对表达量[13]。
1.3 数据统计和分析
采用EXCEL 2007 和Origin 2017 软件对数据进行统计和分析。
2 结果和分析
2.1 不同梅树品种花芽生长发育的动态变化
不同时期,供试6 个梅树品种花芽纵径和横径的变化见图1,花芽外部形态和纵剖面结构的变化分别见图2 和图3。
由图1 可见:在整个花芽发育过程中,供试6 个梅树品种花芽的纵径和横径总体呈增大趋势;其中,2017 年11 月20 日至12 月6 日期间花芽的纵径和横径增长速率较快。 总体上看,供试6 个品种中,早花品种的花芽生长速率最快,而晚花品种的花芽生长速率较慢。
由图2 和图3 可见:品种‘粉红朱砂’和‘淡妆宫粉’花芽鳞片开裂时间为2017 年12 月22 日,之后,品种‘粉红朱砂’花芽鳞片开裂程度明显大于品种‘淡妆宫粉’;品种‘淡粉’花芽鳞片开裂时间为2017年12 月26 日,品种‘南京红’花芽鳞片开裂时间为2018 年1 月7 日,而品种‘寒红’和‘晚跳枝’花芽的鳞片开裂时间均为2018 年1 月15 日。 总体上看,早花品种花芽鳞片开裂时间最早。
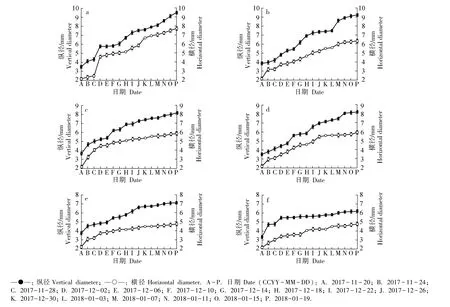
图1 供试6 个梅树品种花芽纵径和横径的变化Fig. 1 Changes in vertical and horizontal diameters of flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested

图2 供试6 个梅树品种花芽外部形态的变化Fig. 2 Changes in external morphology of flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested
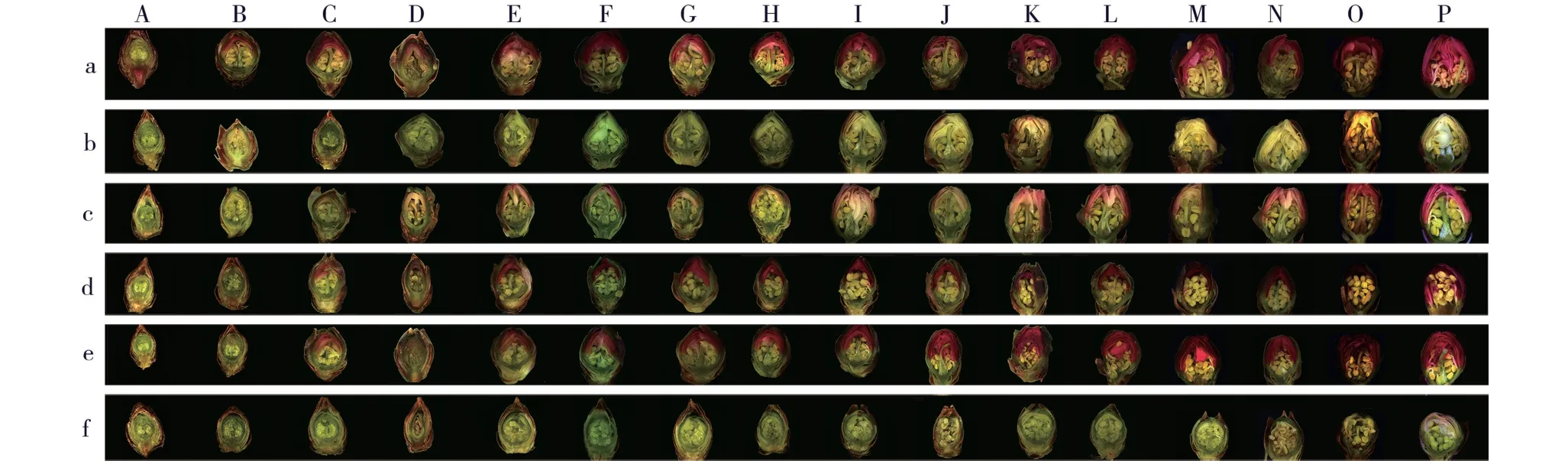
图3 供试6 个梅树品种花芽纵剖面结构的变化Fig. 3 Changes in structure of longitudinal section of flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested
2.2 不同梅树品种开花指标分析
供试6 个梅树品种花芽鳞片开裂率的变化见图4。 结果显示:品种‘粉红朱砂’花芽鳞片开裂率最大,在2018 年1 月16 日即超过50%,此时单株开花数量达到85;之后1 月20 日和1 月24 日花芽鳞片开裂率增长速率较快,分别达到58%和65%,单株开花数量也分别增加至175 和205,表明该品种在2018 年1 月16 日进入花期。 其余5 个品种的花芽鳞片开裂率均明显小于品种‘粉红朱砂’,且在2018 年1 月16日至1 月24 日的20 d 内花芽鳞片开裂率均未超过50%,单株开花数量也均在10 以下,说明这5 个品种的花期均晚于品种‘粉红朱砂’,且均在1 月24 日以后进入花期。
通过比较分析可见:在供试6 个梅树品种中,早花品种花芽鳞片开裂率总体上最高,而晚花品种花芽鳞片开裂率总体上最低,表明梅树花芽鳞片开裂率与该品种的花期早晚特性相对应。
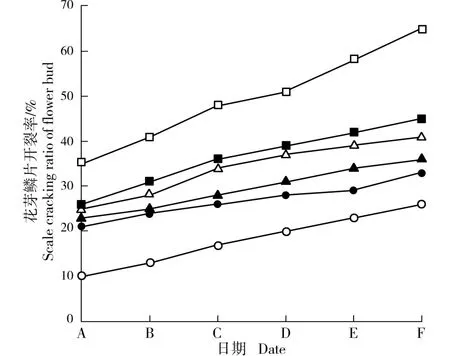
图4 供试6 个梅树品种花芽鳞片开裂率的变化Fig. 4 Changes in scale cracking ratio of flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested
2.3 不同梅树品种花芽中成花基因和看家基因的表达差异
2.3.1 成花基因的表达差异 在花芽发育过程中供试6 个梅树品种花芽中成花基因的相对表达量变化见表2。 结果显示:在不同梅树品种的花芽发育过程中,3 个成花基因的相对表达量呈现不同的变化趋势。
由表2 可见:从基因的表达过程看,pm-FD基因在品种‘粉红朱砂’和‘淡妆宫粉’花芽发育的多数时期均没有表达(相对表达量为0.000),但在中花和晚花品种的花芽发育过程中均不同程度表达,仅相对表达量存在差异;pm-AP2基因在6 个品种的花芽发育过程中均间断表达,特别是在品种‘淡粉’、‘南京红’和‘晚跳枝’花芽发育的多数时期均没有表达;而pm-LFY基因在6 个品种的花芽发育过程中均持续表达,但相对表达量存在较大差异。
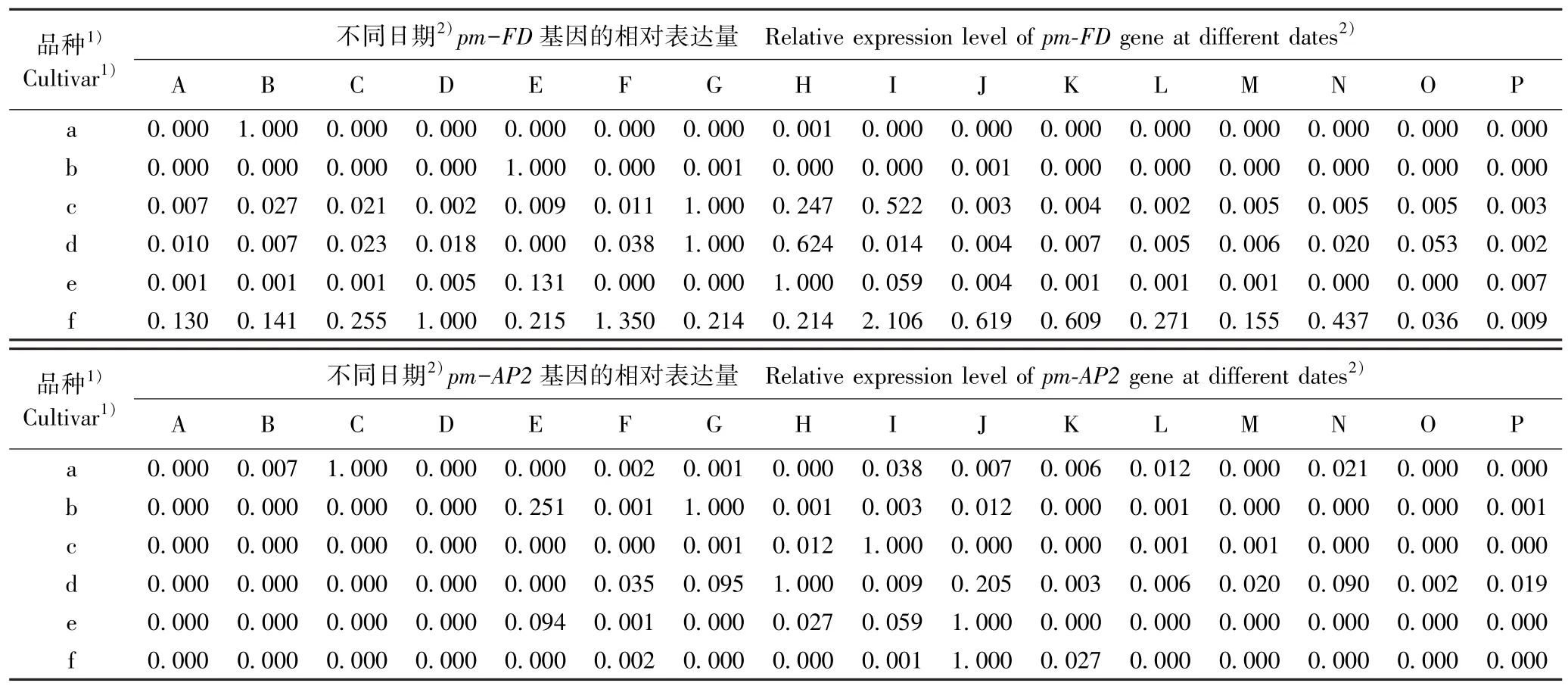
表2 供试6 个梅树品种花芽中成花基因的相对表达量变化Table 2 Changes in relative expression level of flowering gene in flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested
从相对表达量看,pm-FD基因在品种‘粉红朱砂’、‘淡妆宫粉’、‘淡粉’、‘寒红’、‘南京红’和‘晚跳枝’花芽中的最高表达日期分别为2017 年的11 月24 日、12 月6 日、12 月14 日、12 月14、12 月18 日和12 月22 日;pm-AP2基因在上述6 个品种花芽中的最高表达日期分别为2017 年的11 月28 日、12 月14日、12 月22 日、12 月18 日、12 月26 日和12 月26日;pm-LFY基因在上述6 个品种花芽中的最高表达日期分别为2017 年的11 月20 日、12 月10 日、11 月24 日、12 月10 日、12 月26 日和12 月26 日。 除早花品种‘粉红朱砂’外,其余5 个品种的pm-FD、pm-AP2和pm-LFY基因的最高表达日期多出现在12 月中下旬。 总体上看,3 个成花基因最高表达日期与其花期的早晚基本对应。
续表2 Table 2 (Continued)
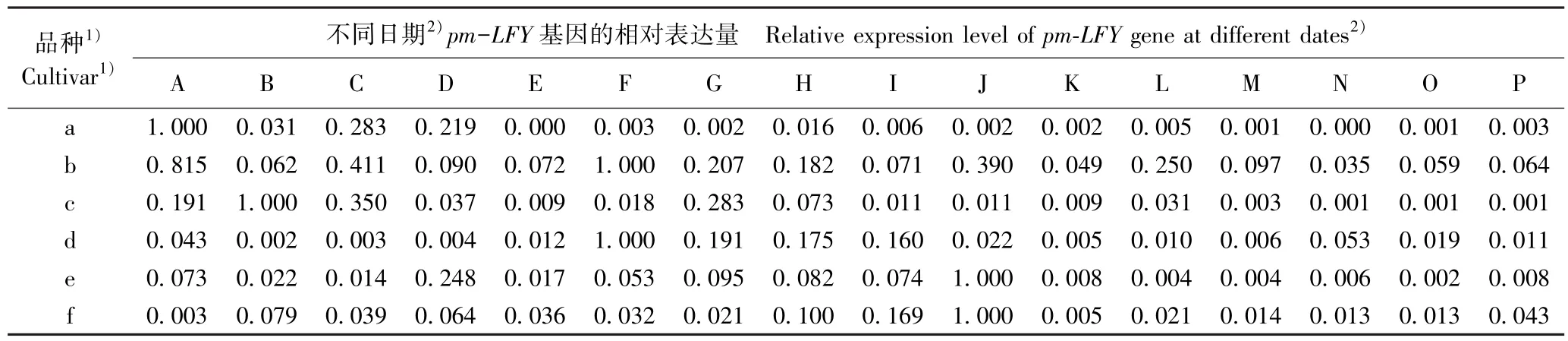
2.3.2 看家基因的表达差异 在花芽发育过程中供试6 个梅树品种花芽中看家基因的相对表达量变化见表3。 结果显示:在不同梅树品种的花芽发育过程中,与成花基因类似,6 个看家基因的相对表达量也呈现不同的变化趋势。
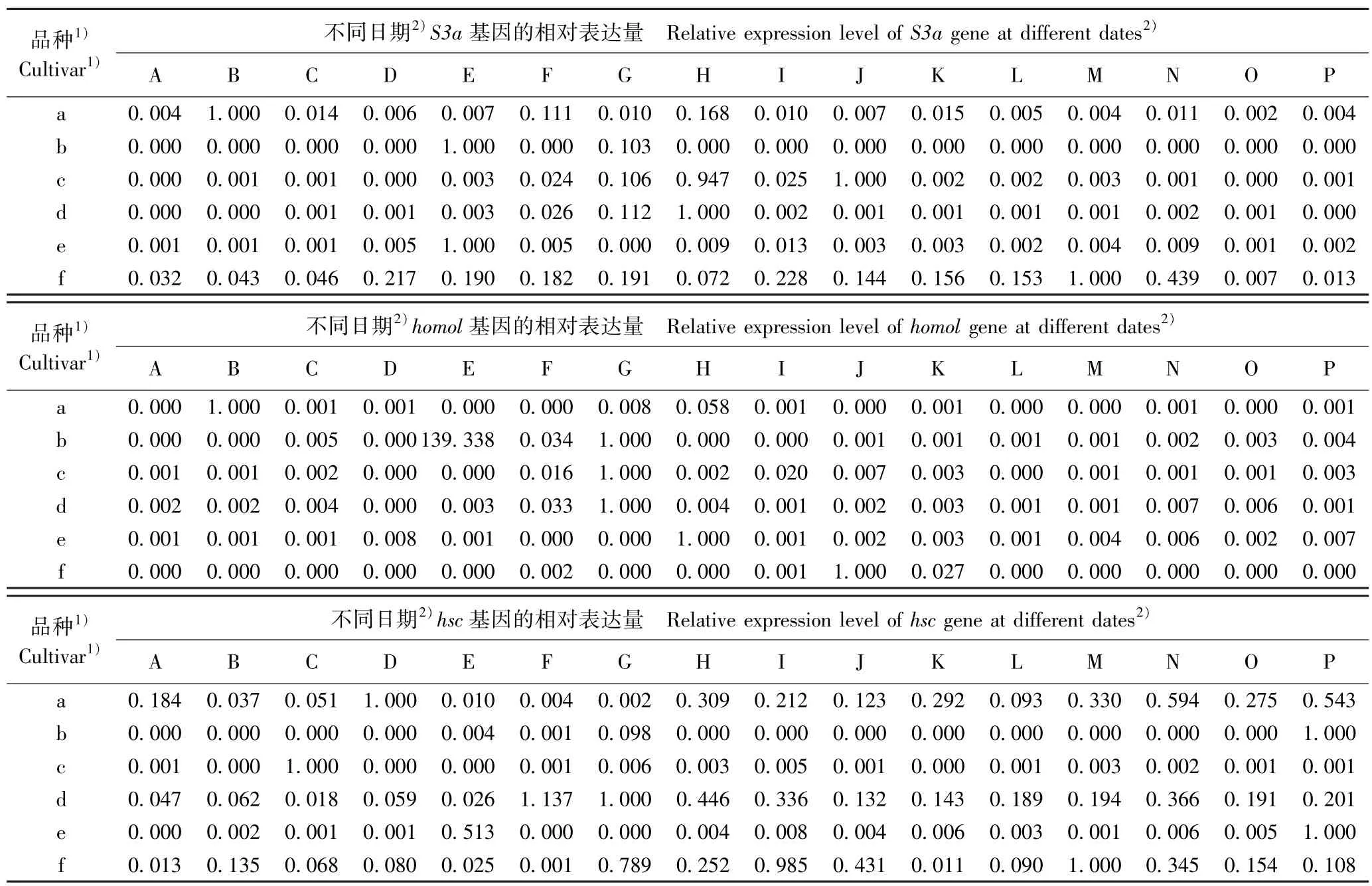
表3 供试6 个梅树品种花芽中看家基因的相对表达量变化Table 3 Changes in relative expression level of house-keeping gene in flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested
由表3 可见:从基因的表达过程看,S3a基因在品种‘粉红朱砂’、‘南京红’和‘晚跳枝’的花芽发育过程中均持续表达,而在其余3 个品种的花芽发育过程中则间断表达;homol基因在6 个品种的花芽发育过程中均间断表达,特别是在品种‘晚跳枝’花芽发育的多数时期均没有表达;hsc基因在品种‘粉红朱砂’、‘寒红’和‘晚跳枝’的花芽发育过程中均持续表达,但在其余3 个品种的花芽发育过程中均间断表达,特别是在品种‘淡妆宫粉’花芽发育的多数时期均无表达;somX2基因在品种 ‘寒红’和‘晚跳枝’的花芽发育过程中均持续表达,但在其余4 个品种的发芽发育过程中均间断表达,特别是在品种‘淡妆宫粉’花芽发育的多数时期均无表达;FRIGIDA-like基因在中花和晚花品种的花芽发育过程中总体上均持续表达,但在早花品种的发芽发育过程中间断表达,特别是在品种‘淡妆宫粉’花芽发育的多数时期均无表达;Subunit37e基因在6 个品种的花芽发育过程中基本上均持续表达,但相对表达量均在一定差异。 总体上看,除homol基因外,其余5 个看家基因在品种‘晚跳枝’的花芽发育过程中均可持续表达,且相对表达量也较高。

续表3 Table 3 (Continued)
从相对表达量看,S3a基因在品种‘粉红朱砂’、‘淡妆宫粉’、‘淡粉’、‘寒红’、‘南京红’和‘晚跳枝’花芽中的最高表达日期分别为2017 年的11 月24日、12 月6 日、12 月26 日、12 月18 日、12 月6 日和2018 年1 月7 日;homol基因在上述6 个品种花芽中的最高表达日期分别为2017 年的11 月24 日、12 月6 日、12 月14 日、12 月14 日、12 月18 日和12 月26日;hsc基因在上述6 个品种花芽中的最高表达日期分别为2017 年12 月2 日、2018 年1 月19 日、2017年的11 月28 日和12 月10 日以及2018 年的1 月19日和1 月7 日;somX2基因在上述6 个品种花芽中的最高表达日期分别为2017 年的11 月24 日、12 月6日、12 月22 日、12 月14 日、12 月22 日和12 月18日;FRIGIDA-like基因在上述6 个品种花芽中的最高表达日期分别为2017 年的12 月18 日、12 月6 日、12月22 日、12 月14 日、12 月22 日和12 月10 日;Subunit37e基因在上述6 个品种花芽中的最高表达日期分别为2017 年12 月30 日和2018 年1 月19 日以及2017 年的12 月22 日、12 月14 日、12 月6 日和12月6 日。
2.4 不同梅树品种花期与花芽中成花基因和看家基因表达量的关系
从供试6 个梅树品种花芽中成花基因和看家基因的最高表达日期到各品种开花日期的间隔天数见表4。
结果显示:各品种花芽中成花基因和看家基因的最高表达日期及开花日期均存在差异,导致间隔天数差异明显。 其中,间隔天数最短的是品种‘粉红朱砂’的看家基因Subunit37e,仅17 d;间隔天数最长的是品种‘晚跳枝’的看家基因Subunit37e,达到88 d。早花品种的成花基因和看家基因最高表达日期与开花日期的间隔天数平均值分别为58 和51 d,中花品种的平均值分别为69 和65 d,晚花品种的平均值分别为68 和70 d。 从成花基因最高表达日期与开花日期的间隔天数看,早花品种短于中花和晚花品种,但中花和晚花品种间差异不大;而从看家基因最高表达日期与开花日期的间隔天数看,早花和中花品种间差异不大,但均明显短于晚花品种。
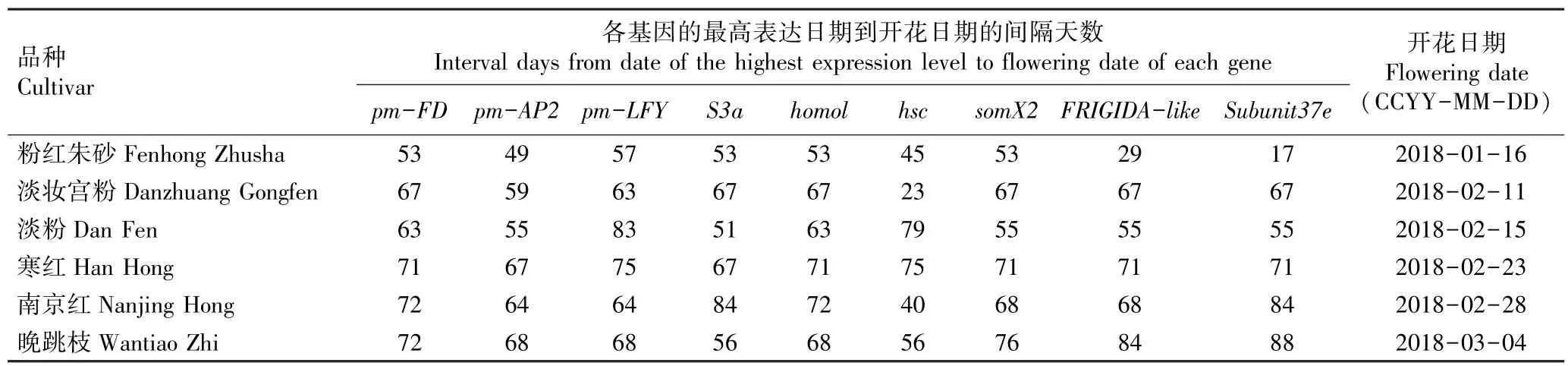
表4 供试6 个梅树品种花芽中成花基因和看家基因的最高表达日期到开花日期的间隔天数Table 4 Interval days from date of the highest expression level to flowering date of flowering and house-keeping genes in flower bud of six cultivars of Prunus mume Sieb. et Zucc. tested
3 讨论和结论
在梅树的花发育过程中,pm-FD基因与pm-FT基因相互作用,促进花的转变以及诱导花的发育[14];pm-AP2基因则对萼片和花瓣的发育有控制作用[15];pm-LFY基因是成花过程中最早表达的花分生组织特异性基因,其影响效应几乎贯穿花序和花发育的整个过程,在维持花分生组织的正常功能、启动花器官基因的活化以及防止花分生组织逆转等方面具有重要作用[16]。 在供试6 个梅树品种的花芽发育过程中,pm-LFY基因在各品种的花芽发育过程中均持续表达,仅相对表达量存在一定差异,佐证了该基因对梅树花芽发育的全过程均有控制作用;而pm-AP2基因在6 个品种的花芽发育过程中均间断表达,说明pm-AP2基因仅对梅树花芽发育的部分过程(花萼和花瓣的发育)有控制作用。 此外,早花品种(‘粉红朱砂’和‘淡妆宫粉’)的pm-FD、pm-AP2和pm-LFY基因的最高表达日期总体上早于中花品种(‘淡粉’和‘寒红’)和晚花品种(‘南京红’和‘晚跳枝’),而晚花品种的pm-FD、pm-AP2和pm-LFY基因的最高表达日期最晚,显示梅树花芽中pm-FD、pm-AP2和pm-LFY基因的表达规律与其花期早晚基本对应。值得注意的是,成花基因pm-FD在早花品种花芽发育的多数时期均没有活跃表达,但在中花和晚花品种的花芽发育过程中均持续表达,其原因有待进一步的研究和探索。
张积森等[17]和王瑛等[18]的研究结果表明:看家基因是在所有类型细胞中都能表达的一类基因,其产物对维持细胞的基本结构和各种代谢活动是必需的;相较于成花基因,看家基因在植物生长发育过程中的表达更稳定。 本研究选择的6 个看家基因S3a、homol、hsc、somX2、FRIGIDA-like和Subunit37e在梅树的花芽生长发育过程中多次出现高表达,其中,有些看家基因与成花基因的最高表达日期相近,如品种‘粉红朱砂’、‘淡妆宫粉’、‘淡粉’、‘寒红’和‘南京红’的看家基因homol与其成花基因pm-FD的最高表达日期一致,因此,研究此类看家基因的最高表达日期与开花日期的间隔规律,有助于梅树花期的预测。 此外,在不同品种梅树花芽发育过程中,各看家基因的表达规律及相对表达量存在明显差异,例如:在6 个品种的花芽发育过程中,homol基因均间断表达,而Subunit37e基因基本上持续表达,FRIGIDA-like基因则在中花和晚花品种的花芽中基本上持续表达,但在早花品种中却间断表达,表明在不同品种的花芽发育过程中,有些看家基因的影响效应贯穿于花芽发育的全过程,而有些看家基因的影响效应则在品种间存在差异或与花期特性相关,但这些看家基因在梅树花芽发育过程中的作用靶点以及与开花日期的相关性还需进一步研究。 此外,除homol基因外,其余5个看家基因在品种‘晚跳枝’的花芽发育过程中均可持续表达,且相对表达量也较高,说明这些看家基因对品种‘晚跳枝’花芽发育的作用较为稳定,但这些看家基因在梅树晚花品种的花芽发育过程中是否有相似的作用规律及其对花期的具体推迟作用,均有待深入研究。
根据花芽纵径和横径的变化规律、花芽外部形态的变化以及花芽鳞片开裂率,确定品种‘粉红朱砂’、‘淡妆宫粉’、‘淡粉’、‘寒红’、‘南京红’和‘晚跳枝’的开花日期分别为2018 年的1 月16 日、2 月11 日、2 月15 日、2 月23 日、2 月28 日和3 月4 日,各品种的开花日期与其花期特性相对应。 而从各基因的最高表达日期看,早花品种的成花基因pm-FD和pm-AP2以及看家基因S3a、homol和somX2均最早进入最高表达日期,而且,早花品种的成花基因和看家基因的最高表达日期距开花日期最近;说明早花品种的“早开花”特性与其花芽发育过程中成花基因和看家基因的快速启动有关。 因此,对梅树花芽发育过程中成花基因和部分看家基因的表达规律进行分析,对于梅树花期的预测有一定的参考意义。
由于本研究并未进行不同年份间的重复观察和研究,且涉及的梅树品种较少,研究结果具有一定的局限性。 而植物的花期除受遗传和生理代谢等内因控制外,还受到气温、水分、光照以及栽培管理措施等多种外因的影响,因而,对不同梅树品种花期与基因表达的相关性还有待深入研究。
致谢:中山陵园管理局孙琴园林高级工程师和李长伟园林工程师等对梅树花期观察提供了帮助,在此表示感谢!
