薄荷柠檬烯-6-羟化酶基因(MhL60H)的克隆与表达分析
2019-06-11亓希武徐东北陈泽群房海灵梁呈元
陈 吟, 亓希武, 徐东北, 陈泽群, 房海灵, 梁呈元
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
薄荷(MenthahaplocalyxBriq.)隶属于唇形科(Labiatae)薄荷属(MenthaLinn.),为常见的芳香植物之一,广泛分布于北半球的温带地区,在中国南方和北方各省均有栽培[1]。 薄荷的茎为方柱形,叶具短柄,叶片呈宽针形,叶缘具细锯齿,搓揉后散发出特殊的清凉香气[2]。 薄荷叶中含有多种生物活性物质,具有重要的药用价值,包括清凉止痒、抗早孕着床、抑制子宫收缩、利胆、祛痰、抗真菌和抗病毒等[3]。
薄荷叶精油丰富,主要为萜类化合物。 不同薄荷属植物精油成分差异较大[4],留兰香(M.spicataLinn.)叶精油的主要成分为香芹酮(carvone),椒样薄荷(M.piperitaLinn.)叶精油的主要成分为薄荷醇(menthol)和薄荷酮(menthone),而薄荷叶精油的主要成分为薄荷醇。 根据挥发油成分差异,薄荷属植物可分成不同的化学型,包括薄荷醇化学型(menthol chemotype)、薄荷酮化学型(menthone chemotype)、香芹酮化学型(carvone chemotype)和辣薄荷烯酮氧化物化学型(piperitenone oxide chemotype)[5-6]。 相关研究结果表明:薄荷精油的合成途径起源于质体中的丙酮酸-磷酸甘油醛(MEP)途径,上游的牻牛儿基二磷酸(geranyl diphosphate)经柠檬烯合酶(limonene synthase,LS)催化生成柠檬烯(limonene),而柠檬烯是多种精油成分合成的共同前体[7-9];柠檬烯-3-羟化酶(limonene-3-hydroxylase,L3OH)和柠檬烯-6-羟化酶(limonene-6-hydroxylase,L6OH)能够催化柠檬烯羟基化反应, 分别生成反式异紫堇醇(transisopipertenol)和反式香芹酮(trans-carvone),其中,反式异紫堇醇可被进一步催化成顺式异戊酮(cisisopulegone),而反式香芹酮可被进一步催化成香芹酮[10-12]。 可见,柠檬烯羟基化反应是薄荷属植物精油合成的重要一步,对其精油组成具有重要影响,因此,研究柠檬烯羟化酶基因对于了解薄荷属植物精油的生物合成及组成差异具有重要意义。
鉴于此,根据前期薄荷转录组测序获得的L6OH基因序列设计1 对特定引物,以薄荷叶cDNA 为模板克隆到1 个L6OH基因,并对该基因进行了序列分析、二级结构预测、多重序列比对及系统进化分析;并且,利用实时荧光定量PCR 技术分析了该基因在薄荷根、茎和叶中的表达特性;同时,对该基因编码的蛋白质进行了原核表达分析,以期明确薄荷L6OH基因的组织表达特性及其与薄荷精油组成的关系。
1 材料和方法
1.1 材料
以江苏省中国科学院植物研究所种质资源圃种植的薄荷品种‘68-7’的1 年生苗为实验材料,随机选择3 株生长良好、长势基本一致且无病害的植株,分别采集每个单株的根、茎(植株中部节间的茎段)和叶(植株顶端的叶)各1 g 左右,分别放入液氮中速冻后置于-80 ℃冰箱中保存,备用。
扩增引物由北京擎科新业生物技术有限公司合成。
1.2 方法
1.2.1 总RNA 提取及cDNA 合成 将薄荷样品置于液氮中研磨成细粉,按照植物多糖多酚总RNA 快速提取试剂盒(北京百泰克生物技术有限公司)说明书提取总RNA,用V-1600 型紫外分光光度计(上海美普达仪器有限公司)检测总RNA 的质量;检测合格后,取3 μg 总RNA,按照M-MLV 逆转录聚合酶试剂盒〔普洛麦格(北京)生物技术有限公司〕说明书逆转录合成cDNA。
1.2.2 基因克隆 根据本项目组前期对薄荷转录组测序结果中预测的L6OH基因序列,利用Primer Premier 5 软件设计1 对特异引物,上游引物L6OH-F的序列为5′-ATGGAGCTCAACCTTTTGTCG-3′,下游引物L6OH-R 的序列为5′-TTATTTATGGAGTGT GGGAACC-3′。 扩增体系总体积50.0 μL,包括10×buffer 5.0 μL,25 mmol·L-1Mg2+4.0 μL,20 mmol·L-1dNTPs 4.0 μL,叶cDNA 模板2.0 μL,10 μmol·L-1上游和下游引物各2.0 μL,ExTaqDNA聚合酶0.4 μL,ddH2O 30.6 μL。 反应程序为:94 ℃预变性4 min;94 ℃变性40 s、55 ℃退火40 s、72 ℃延伸90 s,共30 个循环;最后72 ℃延伸10 min。 用质量分数1.0%琼脂糖凝胶对扩增产物进行电泳检测,切下目的条带,用Agarose Gel DNA Extraction 试剂盒〔宝生物工程(大连)有限公司〕回收目的片段,将回收产物连接到pMD19-T Simple Vector〔宝生物工程(大连)有限公司〕上,并转化到大肠杆菌〔Escherichia coli(Migula) Castellani et Chalmers〕DH5α 感受态细胞(北京擎科新业生物技术有限公司)中,置于37 ℃条件下暗培养,挑取单菌落,筛选出阳性克隆并交给北京擎科新业生物技术有限公司进行测序。
1.2.3 生物信息学分析 使用BioEdit 软件对克隆的L6OH基因序列进行蛋白质编码区(CDS)预测和氨基酸翻译[13],在ExPASy 网站(http:∥web. expasy.org/cgi-bin/compute_pi/pi_tool)对该基因编码蛋白质的理论相对分子质量和理论等电点进行预测,使用SMART 软件(http:∥smart.embl-heidelberg.de/)对该基因编码蛋白质的结构域进行预测,使用SOPMA 软件(https:∥npsa-prabi. ibcp. fr/cgi-bin/npsa_automat.pl?page=npsa_sopma. html)对该基因编码蛋白质的二级结构进行预测,使用DNAMAN 7.0 软件将薄荷与NCBI 数据库中椒样薄荷和留兰香的L6OH基因编码蛋白质的氨基酸序列进行多重比对,并基于相关蛋白质的氨基酸序列、使用MEGA 4.0 软件中的Neighbor-joining 法构建薄荷及其他植物CYD71 家族D 亚家族成员的系统进化树[14]。
1.2.4 组织表达特性分析 根据测序得到的薄荷L6OH基因序列设计用于实时荧光定量PCR 反应的引物,上游引物qL6OH-F 的序列为5′-CGATTTCG AGTTCATCCCATTC-3′,下游引物qL6OH-R 的序列为5′-GTCGGCATCAGTCATTCCTTG-3′;使用薄荷Actin基因作为内参基因,用于Actin基因PCR 反应的上游引物序列为5′-CCAGGAATTGCTGATAGGATG AG-3′,下游引物序列为5′-GCGCCACCACCTTAAT CTTC-3′。 使用qTOWER 2.2 荧光定量PCR 仪(德国Analytic Jena 公司)进行PCR 反应,扩增体系总体积20.0 μL,包括SYBR®PremixExTaqTMⅡ 10.0 μL,10 μmol·L-1上游引物和下游引物各0.5 μL,根、茎或叶cDNA 模板2.0μL,ddH2O7.0μL。 反应程序为:95 ℃预变性1 min;95 ℃变性10 s、60 ℃退火5 s、72 ℃延伸10 s,共40 个循环;最后72 ℃采集荧光信号。 采用2-ΔΔCT法[15]计算薄荷根、茎和叶中L6OH基因的相对表达量。 实验进行3 次生物学重复。
1.2.5 原核表达分析 使用限制性内切酶BamHⅠ和SalⅠ对原核表达载体pET28a 进行双酶切,使用TaKaRa MiniBEST DNA Fragment Purification 试剂盒〔宝生物工程(大连)有限公司〕回收酶切后的载体;根据克隆的L6OH基因序列和pET28a 载体序列设计含有同源臂的引物,上游引物exL6OH-F 的序列为5′-AATGGGTCGCGGATCC ATGGAGCTCAACCTTTTG TCG-3′,下游引物exL6OH-R 的序列为5′-CCGCAAG CTTGTCGAC TTATTTATGGAGTGTGGGAACC-3′(引物中下划线部分为同源臂序列);利用同源重组法获得重组载体pET28a-L6OH;提取重组质粒,将其转入大肠杆菌表达菌株Rosetta 感受态细胞中,涂布在含25 mg·L-1卡那霉素的LB 固体培养基中,置于37 ℃条件下暗培养;挑取单菌落,置于LB 液体培养基中,在37 ℃、220 r·min-1摇床上振荡培养;当OD600值为0.6~0.8 时,加入诱导剂异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)至终浓度1 mmol·L-1,置于37 ℃条件下暗培养,诱导L6OH 蛋白表达。 分别取诱导0(诱导前)、1、2、3和4 h 的菌液,在4 ℃条件下6 000 r·min-1离心10 min,收集沉淀,使用SDS-PAGE 法[16]检测目的蛋白的表达情况。
2 结果和分析
2.1 基因克隆及序列分析
根据转录组测序数据预测的L6OH基因序列设计引物,以薄荷叶cDNA 为模板进行PCR 扩增,结果(图1)表明:从薄荷叶cDNA 中克隆到1 条长度约1 500 bp 的明亮条带。 经测序,该条带为L6OH基因,命名为MhL6OH,GenBank 登录号为MK285052。
生物信息学分析结果表明:MhL6OH基因蛋白质编码区(CDS)全长1 479 bp,共编码492 个氨基酸残基(图2);该基因编码的蛋白质命名为MhL6OH,该蛋白质的理论相对分子质量为55 855.69,理论等电点为pI 8.71;该蛋白质的二级结构中,α-螺旋的比例为51.02%,无规则卷曲的比例为30.49%,延伸链的比例为12.40%,β-转角的比例为6.10%(图3)。 此外,该蛋白质还含有保守的细胞色素P450 结构域(图4),根据细胞色素P450 超家族分类标准[17],MhL6OH蛋白属于CYP71 家族的D 亚家族。
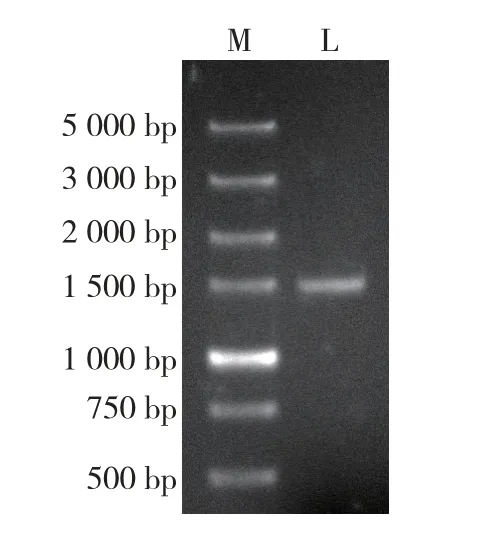
图1 薄荷MhL6OH 基因扩增结果Fig. 1 Amplification result of MhL6OH gene of Mentha haplocalyx Briq.

图2 薄荷MhL6OH 基因蛋白质编码区(CDS)及其氨基酸序列Fig. 2 Coding sequence region (CDS) of MhL6OH gene of Mentha haplocalyx Briq. and its amino acid sequence

图3 薄荷MhL6OH 蛋白的二级结构预测Fig. 3 Prediction of secondary structure of MhL6OH protein of Mentha haplocalyx Briq.

图4 薄荷MhL6OH 蛋白的结构域预测Fig. 4 Prediction of domain of MhL6OH protein of Mentha haplocalyx Briq.
2.2 多重比对和进化分析
对获得的薄荷MhL6OH 蛋白与NCBI 网站中薄荷属植物椒样薄荷MpL6OH 蛋白(登录号AIS36970)和留兰香MsL6OH 蛋白(登录号Q6WKZ1.1)的氨基酸序列进行多重比对。 比对分析结果(图5)表明:MhL6OH 蛋白与MpL6OH 蛋白和MsL6OH 蛋白的氨基酸序列高度相似,均具有细胞色素P450 的血红素结合区(heme binding region);这3 种薄荷属植物L6OH 蛋白的底物识别位点(substrate recognition site,SRS)中SRS3 和SRS5 的序列完全相同,且SRS1、SRS2、SRS4 和SRS6 的序列仅有个别氨基酸存在差异。 并且,MhL6OH 蛋白与MpL6OH 蛋白的SRS 序列的相似性更高,二者的SRS2、SRS3、SRS5 和SRS6序列完全相同,仅分别在SRS1 和SRS4 序列上存在1 个氨基酸的差异,说明MhL6OH 蛋白与MpL6OH 蛋白可能具有相似的底物识别特异性。

图5 薄荷MhL6OH 蛋白与椒样薄荷和留兰香L6OH 蛋白的氨基酸序列的多重比对Fig. 5 Multiple alignment of amino acid sequences of MhL6OH protein of Mentha haplocalyx Briq. with L6OH proteins of M. piperita Linn. and M. spicata Linn.
系统进化树分析结果(图6)表明:MhL6OH 蛋白与MpL6OH 蛋白首先聚在一起,并与苏格兰薄荷(Mentha
gracilisSole)CYP71D94 蛋白和MsL6OH 蛋白聚为一组,与其他植物CYD71 家族D 亚家族蛋白明显分离,说明薄荷与椒样薄荷的亲缘关系最近,与苏格兰薄荷和留兰香的亲缘关系也较近,但与其他植物的亲缘关系却相对较远。
2.3 组织表达特性分析
实时荧光定量PCR 分析结果(图7) 表明:MhL6OH基因的相对表达量在薄荷叶中最高,在茎中次之,在根中最低;并且,该基因在叶中的相对表达量远高于其在茎和根中的相对表达量。
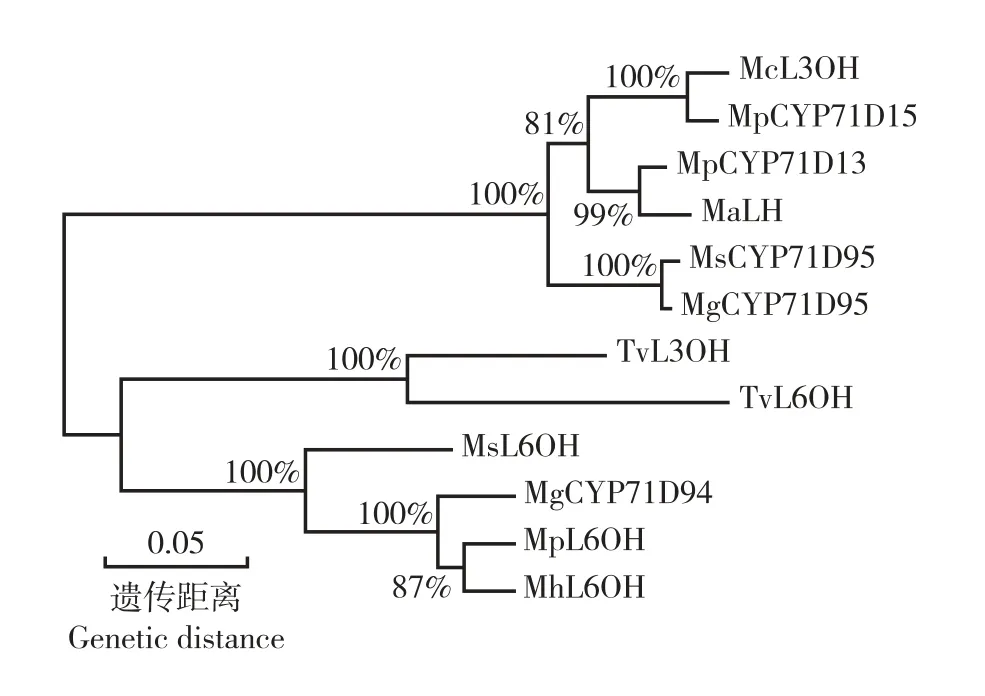
图6 薄荷MhL6OH 蛋白与其他植物CYP71 家族D 亚家族蛋白的氨基酸序列的系统进化树分析Fig. 6 Phylogenetic tree analysis on amino acid sequences of MhL6OH protein of Mentha haplocalyx Briq. and proteins of D subfamily of CYP71 family of other species
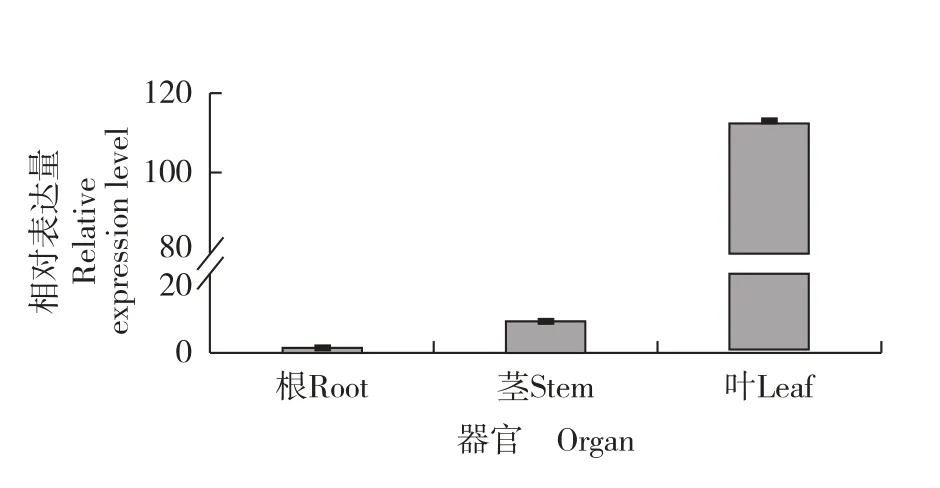
图7 薄荷不同器官中MhL6OH 基因的相对表达量Fig. 7 Relative expression level of MhL6OH gene in different organs of Mentha haplocalyx Briq.
2.4 原核表达分析
SDS-PAGE 电泳检测结果(图8)表明:经IPTG诱导后,在理论相对分子质量60 000 附近有1 条明显的条带,该蛋白质大小与目的蛋白MhL6OH 的理论相对分子质量相符;在诱导1 h 即可大量表达,且随着诱导时间延长,该蛋白质的表达量逐渐增大。

图8 不同诱导时间薄荷MhL6OH 蛋白的SDS-PAGE 电泳图谱Fig. 8 SDS-PAGE electrophoresis pattern of MhL6OH protein of Mentha haplocalyx Briq. at different induction times
3 讨论和结论
L6OH 蛋白能够催化柠檬烯发生羟基化反应,是薄荷属植物精油合成途径中的一个重要酶。 目前,已经在部分薄荷属植物中克隆到编码L6OH 蛋白的基因[18-19],其CDS 长度为1 485~1 491 bp,且编码的蛋白质均属于细胞色素P450 超家族CYP71 家族的D亚家族。 本研究克隆到的薄荷MhL6OH基因CDS 全长1 479 bp,含有保守的细胞色素P450 结构域,也属于CYP71 家族的D 亚家族。
不同薄荷属植物的精油组成差异很大,L6OH 蛋白催化活性差异是造成薄荷属植物精油组成差异的重要原因[11]。 底物识别位点对L6OH 蛋白的催化活性具有重要作用,留兰香MsL6OH 蛋白的底物识别位点中单个氨基酸的变化就能改变其催化活性[20]。 薄荷MhL6OH 蛋白与椒样薄荷MpL6OH 蛋白的底物识别位点高度相似,仅分别在SRS1 和SRS4 序列上存在1 个氨基酸差异,说明二者具有相似的底物识别特异性。 薄荷精油的主要成分为薄荷醇[4],该成分与椒样薄荷中的薄荷酮为同一类型的成分,据此推测MhL6OH 蛋白和MpL6OH 蛋白底物识别位点的特异性导致其催化柠檬烯6-羟基化反应的活性降低,致使薄荷和椒样薄荷精油中的香芹酮含量很低;并且,L3OH 蛋白催化柠檬烯3-羟基化反应是薄荷和椒样薄荷的主要反应,导致薄荷醇和薄荷酮累积。
Wang[21]发现,薄荷精油主要在腺毛中合成和储存,而腺毛主要分布在叶表面,说明薄荷精油主要在叶中积累;Ahkami 等[11]发现,薄荷属植物精油合成途径的相关基因均可在腺毛中表达。 本研究结果表明:MhL6OH基因在薄荷的根、茎和叶中均可表达,且该基因在叶中的表达水平远高于茎和根,可见薄荷MhL6OH基因的组织表达模式与其精油分布一致。
