吸入糖皮质激素治疗对COPD患者的骨密度及骨折风险的影响
2019-06-11李玉刘坤靳双周
李玉 刘坤 靳双周
1.焦作市人民医院呼吸科,河南 焦作 454000 2.焦作市人民医院骨科,河南 焦作 454000
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是全世界发病率和死亡率较高的疾病之一,并且在未来20年内该疾病的负担将继续增加。慢性阻塞性肺疾病全球倡议(The Global Initiative for Chronic Obstructive Lung Disease,GOLD)已将COPD定义为可预防和可治疗的疾病,其主要特征是进行性气流受限。这种气流限制不是完全可逆的,并且与肺部对有害颗粒或气体的异常炎症反应相关,最常见的是香烟烟雾[1]。COPD通常与合并症和全身性状态密切相关,后者会增加死亡率,包括骨质疏松症。骨质疏松症是一种骨骼系统性疾病,其特征在于骨量低和骨组织中的微结构变化,导致骨脆性增加,从而增加骨折风险。COPD患者骨质疏松症的患病率从4%到59%不等,取决于所使用的诊断方法、研究人群以及潜在呼吸系统疾病的严重程度[2]。COPD是骨密度(bone mineral density,BMD)降低和骨折风险增加的独立预测因子[3]。COPD患者经常接受口服或吸入糖皮质激素来控制其疾病。口服糖皮质激素与低骨密度和骨质疏松症有关[4],但吸入糖皮质激素对骨骼的影响仍存在争议[5]。由骨质疏松症引起的骨折的发生可能导致COPD患者的残疾和死亡。在绝经后的女性和老年男性中,骨密度测定不是一个理想的预测指标,因为这些患者可能表现出脆性骨折,BMD降低最小[6]。对于接受服糖皮质激素治疗并且在BMD显著降低之前发生脆性骨折的患者也是如此[7]。最近,骨脆性通过综合风险评估工具FRAX(骨折风险评估工具)[8]进行了估算。在本研究中,旨在估计未接受药物治疗的COPD患者和接受吸入糖皮质激素治疗患者的骨质疏松症和骨折的患病率。还评估了这些发现与年龄、性别、低BMI、低肌肉质量指数(muscle mass index,MMI),通过GOLD评分来评估COPD的严重程度和FRAX的关联。
1 材料和方法
1.1 一般临床资料
本研究选取从2016年1月至2017年6月,50岁及以上绝经后女性和男性COPD患者作为研究对象。通过肺活量测定证实COPD的诊断,表明FEV/FVC小于70%。根据GOLD标准将患者分类为I~IV期[1]。所选患者接受吸入糖皮质激素至少3个月或未接受吸入糖皮质激素治疗的患者。排除标准:前一年因任何原因接受口服糖皮质激素的患者,绝经前妇女,表现出酒精滥用的个体(>400 g/周),非法药物使用者和其他已知会影响骨密度和质量的药物(如抗惊厥药和抗骨质疏松症药物),以及可能干扰评估参数的慢性疾病,如糖尿病和癌症。
每位患者都接受了病史的采集,使用结构化问卷来解决先前脆性骨折的历史,髋部骨折的父母病史,吸烟,用于治疗COPD的所有药物,包括吸入糖皮质激素的类型和剂量、药物开始时或停止、COPD的自然史和伴随的健康状况。同一天进行体格检查。通过测距仪测量高度,并通过平衡梁标度测量重量以计算体质量指数(body mass index,BMI)=体重(kg)/身高(m)2。国际体育活动问卷(IPAQ)简表用于评估身体活动。该仪器估计在前一周执行多个级别的身体活动所花费的时间。能量消耗通过确定每个活动每周花费的分钟数来计算出任务的代谢当量。IPAQ简表由4个域组成,每个域分为两个项。将所有项目的结果相加以提供总体力活动得分[9]。
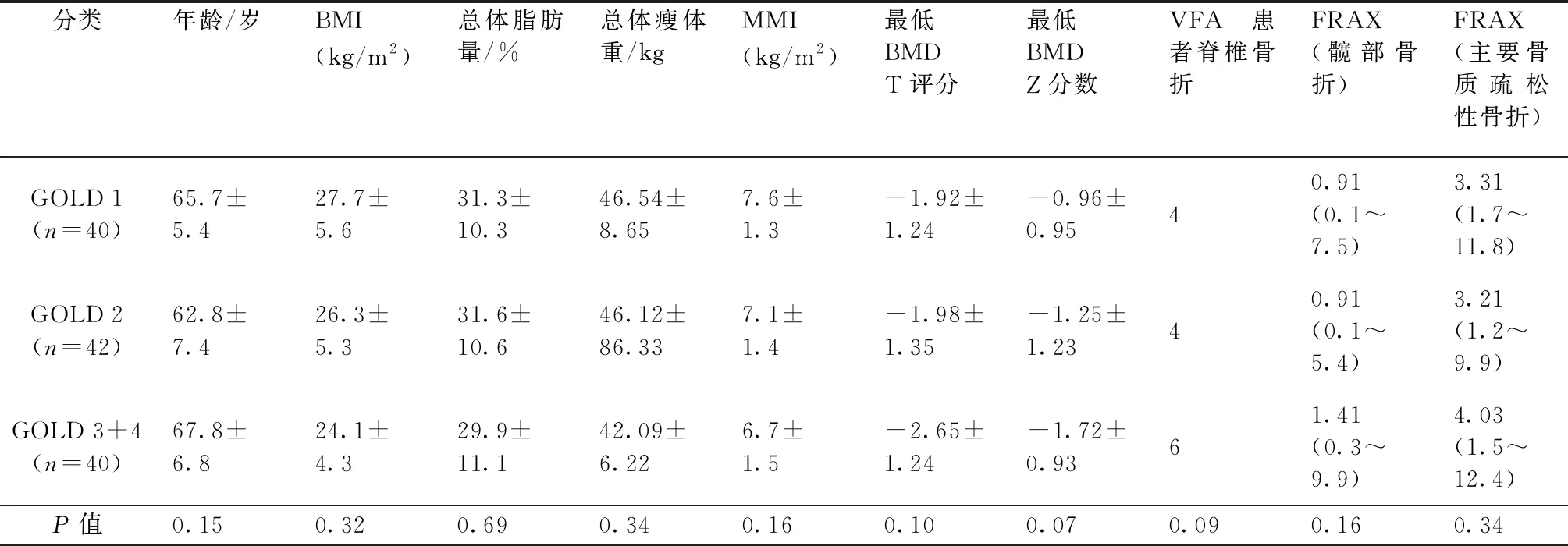
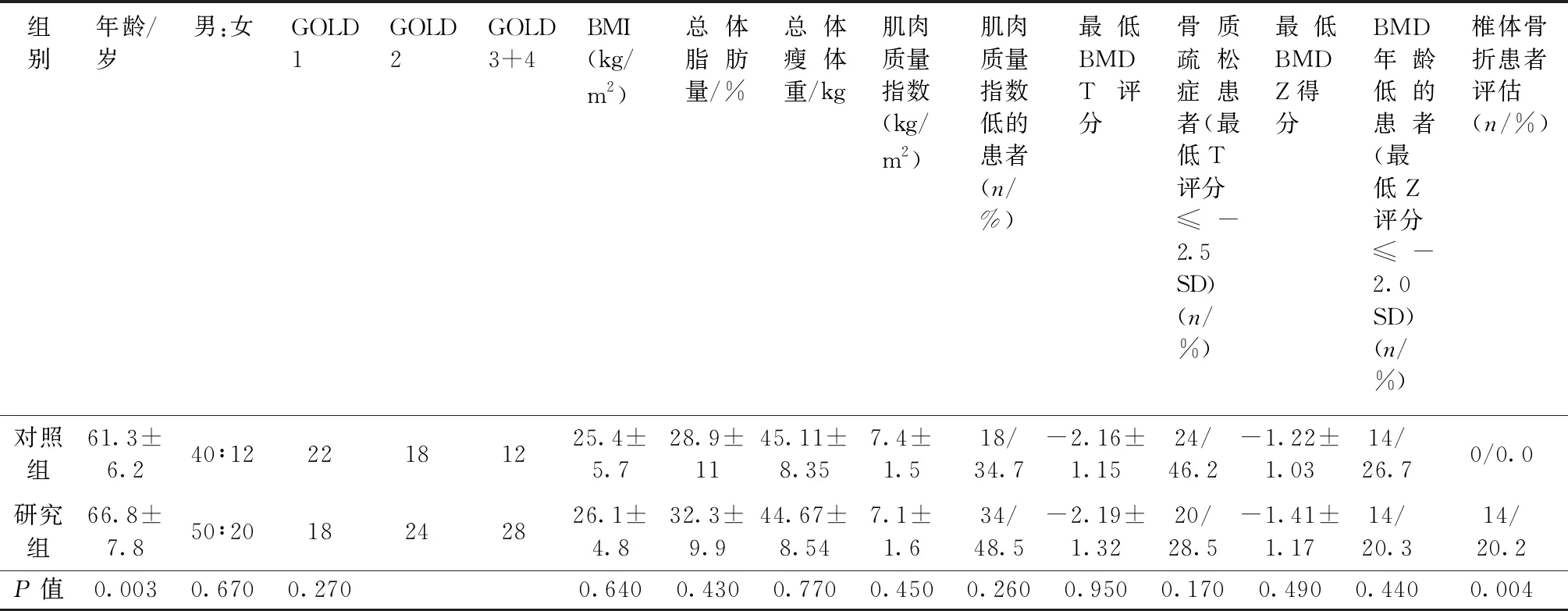
通过双能X射线吸收测定法(DXA)测量腰椎(LS)、股骨颈(FN)和股骨总体(TF)的BMD (Prodigy Advance; GE Healthcare, Madison, WI, USA)。根据骨质疏松症诊断标准[10],所有绝经后女性和50岁及以上的男性被确定为骨质减少或骨质疏松症,最低BMD T评分为在任何部位的BMD Z评分≤-2 SD的值也被认为低于预期的年龄BMD。BMD值的变异系数为: -2.5 SD 所有患者均进行脊椎摄片,按照结果椎体骨折(VFs)分为中度或2级(椎体高度损失25%~40%)和严重或3级(椎体高度损失超过40%)。本研究没有考虑轻度或1级(椎体高度损失20%~25%)。在BMD评估的同时进行测量,并分析从T7到L4的椎体骨折。FRAX计算工具用于评估主要骨质疏松性骨折和髋部骨折的骨折风险。 使用SPSS 20.0进行数据统计分析。除FRAX(髋部骨折)和FRAX(主要骨质疏松性骨折)外,大多数变量遵循使用Kolmogorov-Smirnov检验的正态分布。对于描述性分析,分类变量表示为百分比和频率,数值变量根据其分布模式表示为平均值±SD或中值(最小值-最大值)。进行Student’t检验或Mann-WhitneyU检验,根据它们的分布比较两组之间的数值变量。应用方差分析(ANOVA)或Kruskal-Wallis检验,根据它们的分布比较三组之间的数值变量,然后分别进行Tukey和Bonferroni事后分析。P<0.05表示差异具有统计学意义。 共纳入122例COPD门诊患者。参与者的治疗方案由GOLD指南制定。这些指南建议所有患有严重和非常严重气流受限的患者,频繁发作的患者以及未通过长效支气管扩张剂充分控制的患者使用吸入糖皮质激素。根据IPAQ简表,所有患者均被认为是久坐或不规律活动。人口的特征如表1所示。70例患者是吸入糖皮质激素治疗的现有使用者,48例患者未使用糖皮质激素。年龄为50~80岁,男性(65.2±6.34)岁与女性(65.3±5.43)岁之间无显著差异(P>0.05)。目前吸烟者中有18例男性和6例女性,其中72例男性和26例女性为前吸烟者。10例患者体重不足(8.2%,BMI<20 kg/m2),68例患者BMI正常(55.73%,20~27 kg/m2),44例患者(36.06%)超重/肥胖,没有性别差异。没有患者有低能量创伤导致的骨折病史。 吸入糖皮质激素治疗的患者在研究前至少使用这种药物3个月。最常用的吸入糖皮质激素是布地奈德400 μg,每日两次;严重患者联合福莫特罗12 μg或倍氯米松50~250 μg。使用吸入糖皮质激素治疗的患者与不使用糖皮质激素的患者之间的比较显示在表1中。只有4例患者被归类为GOLD IV;因此,COPD段III和IV患者被一起考虑用于统计分析。根据COPD严重程度的分布在各组之间没有差异。尽管糖皮质激素使用者年龄较大,但他们在性别分布、BMI、MMI或BMD T评分和BMD Z评分的最低值方面没有统计学意义(P>0.05)。然而,仅在使用糖皮质激素的患者中椎体骨折差异有统计学意义(P<0.05)。 表1 两组患者一般资料及相关参数比较Table 1 Comparison of general data and related parameters between the two groups 根据DXA扫描,44例患者(32例男性和12例女性)被诊断患有骨质疏松症,相当于14例患者中的6例(42.84%)患有椎骨骨折(12例男性和2例女性),38例患者(35.13%)患有骨折。DXA引起的骨质疏松症与性别(P=0.85)或年龄(P=0.72)无关。在52例患者中确定了低MMI值(26例患有骨质疏松症的患者通过DXA)。然而,70例MMI正常的患者中只有18例表现出骨质疏松症。MMI与骨质疏松症之间的关联几乎达到显著性(P=0.048)。即使考虑到FRAX值,VFA检测到的有或没有椎体骨折的患者之间没有发现显著差异(P>0.05),如表2所示。骨折与骨质疏松症相关(P=0.65)或低MMI(P=0.11)。根据通过GOLD评分评估的COPD严重性,存在最低BMD Z评分逐渐降低的趋势(P=0.07)。所有其他比较没有显著差异,包括每个组别中VFA检测到的椎体骨折患者数量(表3)。 本研究表明,在骨密度测定改变之前,吸入糖皮质激素与COPD患者的椎体骨折有关。肌肉质量下降和肺部疾病严重程度可能导致这些患者的骨病。口服糖皮质激素使椎体骨折的风险增加2倍,骨质疏松症的风险增加9倍[12]。然而,吸入糖皮质激素治疗在骨质疏松发生中的作用是有争议的。COPD患者经常接受吸入糖皮质激素数年;然而,缺乏常规高剂量吸入糖皮质激素治疗的长期前瞻性研究。有学者研究表明,当以常规剂量使用2或3年时,没有证据表明吸入糖皮质激素对轻度COPD或哮喘患者的BMD或椎体骨折有影响[13]。 表2 通过椎骨骨折评估比较检测到的有或没有椎骨骨折的患者Table 2 Comparison between patients with and without vertebral fractures detected by vertebral fracture assessment 表3 根据慢性阻塞性肺疾病全球倡议分类的患者比较Table 3 Comparison among patients according to the Global Initiative for Chronic Obstructive Lung Disease (GOLD) classification 在给予标准剂量的布地奈德(800 μg/d)的患者中,与EURO-SCOPS研究中的安慰剂治疗相比,没有加速的骨丢失[14]。在一项大型病例对照研究中,包括来自英国全科医学研究数据库的10万多例病例,De Vries等[15]确定在调整疾病严重程度后,每日剂量相当于吸入大于1600μg的倍氯米松与增加的骨折风险之间的关联消失。这些研究结果表明,在COPD中,疾病的严重程度而不是吸入糖皮质激素会增加骨折风险。最近,Mathioudakis等[16]证实了椎体骨折与肺功能恶化之间的关联。在一项针对251例COPD男性的4年研究中,Mathioudakis等[16]研究发现低剂量吸入糖皮质激素不会加重骨质流失;此外,它减缓了支气管炎患者的骨质疏松症。有研究[17]还报告吸入糖皮质激素的绝经后妇女与未吸入治疗对照组的BMD无差异;此外,吸入糖皮质激素治疗与BMD之间没有剂量反应关系。 本研究的大多数患者为轻度或中度COPD,之前没有患者接受过糖皮质激素治疗。然而,大约1/3的患者通过骨密度确定患者患有骨质疏松症,11%的患者通过VFA进行了非临床椎体骨折的评估。根据先前描述的研究,还确定糖皮质激素治疗患者和非糖皮质激素治疗患者之间在绝对BMD值、年龄、低骨量的普遍性和DXA评估的骨质疏松症方面没有差异。本研究没有评估身体活动、炎症标志物、维生素D或性类固醇血清水平,但是,本研究表明低骨量与年龄、性别或BMI无关。三组GOLD评分之间的差异无统计学意义,然而,随着COPD严重程度的加重,BMD Z评分有逐渐下降的趋势。此外,低肌肉量与骨质疏松症之间存在关联。因此,MMI和GOLD评分似乎都会导致骨病,吸入糖皮质激素患者中有20%患有脆性骨折。在16项随机对照试验的系统评价和荟萃分析中,Loke等[18]表明吸入糖皮质激素与骨折风险增加27%相关。通过DXA的BMD T评分和BMD Z评分值和骨质疏松症没有区分VFA证实的椎体骨折患者。BMD评估虽然具体,但对预测骨折风险可能不敏感。添加能够独立于BMD预测骨折的临床风险因素可以提高预测骨折风险的能力。FRAX是一种基于网络的算法,旨在根据容易获得的临床危险因素计算男性和女性主要骨质疏松相关骨折和髋部骨折的10年概率。吸入糖皮质激素患者在FRAX模型中不被视为糖皮质激素使用者,本研究采用了该标准。有和没有骨折的患者之间的FRAX值没有差异,这表明FRAX可能低估了吸入糖皮质激素使用者的骨折概率。 这项研究有一些局限性。首先,考虑到COPD的患病率,研究样本相对较小。其次,双盲对照试验可能更有助于发现吸入糖皮质激素对BMD的实际影响,然而,笔者认为该研究结果具有相似的可靠性,因为该研究中的患者组几乎在所有变量上没有差异。第三,本研究没有测量血液中的炎症因子,因此,纵向研究可以确定吸入糖皮质激素与COPD引起的全身性炎症之间的正相关关系,以及促进对全身性炎症与COPD肺外表现之间的关联的理解。 总之,本研究表明吸入糖皮质激素与COPD患者的骨脆性有关。低肌肉质量和COPD的严重程度可能导致骨病。DXA扫描和FRAX均不能预测COPD患者脆性骨折。1.2 统计学分析
2 结果
3 讨论