对叶榕花序不同发育时期气味成分的变化及其对传粉者的吸引作用
2019-06-11程玉芬张志伟贾永霞陈连福1于慧1
程玉芬, 张志伟, 贾永霞, 陈连福1,, 于慧1,*
对叶榕花序不同发育时期气味成分的变化及其对传粉者的吸引作用
程玉芬1,2,3, 张志伟4, 贾永霞3, 陈连福1,3, 于慧1,3*
(1. 中国科学院植物资源保护与可持续利用重点实验室,广州 510650; 2. 中国科学院大学, 北京 100049; 3. 中国科学院华南植物园,广州 510650; 4.曲阜师范大学生命科学学院, 山东 曲阜 273165)
为探讨榕果发育过程中气味挥发物的动态变化及其对传粉者行为的调节作用,比较对叶榕()不同发育时期花序挥发物的变化,并结合Y形嗅觉仪检测对叶榕传粉榕小蜂对不同花序的选择性。结果表明,在3个发育时期的花序中共检测到64种化合物,对叶榕采用“泛化”策略吸引传粉榕小蜂,十一烷、-榄香烯、-芹子烯、-依兰油烯可能是对传粉榕小蜂起吸引作用的物质。雌前期花序气味与雌花期相似,间花期与雌前期、雌花期的有显著差异,传粉榕小蜂对雌前期和雌花期花序具有明显的选择倾向,对间花期花序表现出驱避性,表明对叶榕与传粉者存在“推-拉”作用模式。雌前期花序释放的气味,有助于传粉者对寄主的定位。同一时期个体间的气味成分存在空间异质性,这种异质性在间花期更加显著,表明气味成分受环境影响。间花期花序气味由于不需要特异性地吸引传粉者,因而更容易发生变化。这有助于更好地理解榕树挥发性物质的组成特点,以及化学机制在维持榕树-榕小蜂共生体系中的关键作用。
对叶榕;隐头花序;挥发性化合物;化学信号
榕属()植物广泛分布于热带和亚热带地区,目前已知有750余种[1]。隐头花序是本属植物最典型的特征,俗称榕果(fig)或者隐头果(synco- nium), 小花着生在膨大中空的花序托内,仅通过小孔苞片(ostiolar bracts)构成的小孔与外界相连。榕树依赖传粉榕小蜂为其授粉,而传粉榕小蜂必须借助榕树隐头花序果作为孵育后代的场所,两者在形态构造、生活史上相互配合,共同演化,形成了高度特化的共生体系[2–3],是研究物种协同进化的经典范例[2,4]。在榕树-传粉榕小蜂专性共生关系中,复杂的生存环境,有限的花期资源以及传粉者出飞后短暂的存活时间,决定了传粉榕小蜂能够快速找到寄主,是榕树-传粉榕小蜂共生关系得以维持的关键[5]。在寄主远距离定位上,传粉榕小蜂视觉所起到的作用可以忽略[6]。目前,多数学者认为,雌花期榕果释放出特异性气味,传粉榕小蜂依靠触角上多种嗅觉感受器识别寄主花序气味,从而正确定位寄主的位置[7]。
花香挥发物属于植物的次生代谢产物,按生物合成途径可分为萜烯类、苯丙酸类和脂肪族等三大类, 在迄今调查的50%以上的科中都有分布[8],已鉴定的植物挥发性化合物超过1 700多种,约占已知植物次生代谢物的1%[9]。在植物与传粉昆虫互作体系中,植物花气味被认为是一种比视觉信号更古老的引诱剂[10]。缺少运动能力的植物主要通过花器官上的腺体释放具有一定香味的挥发性物质,而传粉昆虫则通过识别植物的气味来寻找“特异”的植株[11]。对于专性传粉体系而言,植物释放的特异性花气味是维持传粉者专一性的主要原因[12–13]。植物挥发物以两种方式吸引传粉者[5,14]:第一种是“泛化”(generalization)策略,特异性化学信号是由一系列常见化合物通过一定配比形成;第二种是“专化”(specialization)策略,即通过释放某一不常见的单一化合物来实现特异性。多数榕树通过“泛化”策略吸引传粉者,仅在鸡嗉子榕()中检测到单一成分对甲基苯甲醚起着特异性化学信号的作用[15]。
Galil等将榕属植物隐头花序的发育过程划分为5个时期[16]:雌前期(prefemale phase),榕果内花序发育至可被授粉或产卵前,又称为A期;雌花期(female phase),长短柱雌花成熟,苞片松动或者打开,小蜂可以进入果内产卵或者授粉,又称为B期或者接受期(receptive phase);间花期(interfloral phase),长柱花授粉至种子发育成熟前,短柱花经产卵至榕果小蜂羽化及雄花成熟前,又称为C期;以及雄花期(male phase)和花后期(postfloral phase)。传粉榕小蜂只能在雌花期进入花序果给里面的雌花授粉或在其内产卵,而榕果的雌花期通常只持续几天时间。榕树有两种繁殖体系,雌雄同株和雌雄异株,二种类型在数量上约各占一半。雌雄同株多为高大乔木, 分布于林冠上层,榕果内同时分布有雄花、长柱雌花(授粉后发育成种子)和短柱雌花(产卵后发育成虫瘿)[17–18]。雌雄异株是雌、雄株分离, 多为灌木, 雄株花序有雄花和短柱的雌花,雌株花序内只有长柱雌花。从居群的角度看,雌雄同株榕树在榕果物候上表现出居群内株间异步而株内同步的特性,即同一株榕树上榕果发育时期往往相同,而在雌雄异株榕树上,常表现出株内异步,即同一株上往往同时有多个发育时期的榕果,但是雄花期与雌花期较少出现重叠。
关于榕树花序气味的研究中,已有40多种榕树挥发性气味的组成成分被鉴别出来[7],组成成分都以萜类为主,但每种榕树所含化合物种类、主要成分、各成分所占比例及特异性化合物组成趋向于泛化或特化的程度都存在着较大差异[14],多数研究都集中于种间雌花期花序气味比较及传粉前和传粉后花序气味成分的变化上[5–6,19–20],研究结果显示雌花期花序对传粉者具有吸引力,不同种榕树的雌花期气味具有特异性[14],雌花期花序在进入间花期后,挥发性气味释放量降低,化合物种类减少[20]。但是,雌前期花序气味如何过渡到雌花期,两个发育时期发生了怎样的变化,雌花期在进入间花期后气味如何变化,以及不同发育时期花序对传粉小蜂的吸引力如何,相关研究还较为缺乏。
对叶榕()为桑科(Moraceace)榕属聚果榕亚属(subgen.)植物,灌木或小乔木, 广泛分布于广州地区,雌雄异株,全年结果,榕果物候具有明显的株内异步性,即在同一时间段,对叶榕植株上往往同时有雌前期、雌花期、间花期的榕果。其传粉者为s[21]。利用对叶榕不同花序期气味挥发物的分析,可以在同一时间段采集到不同发育时期的花序气味,避免了因采样时间不齐,而引入的新的干扰因素。本研究收集了对叶榕3个发育时期(雌前期、雌花期、间花期)榕果的气味挥发物,并对不同时期的花序进行传粉榕小蜂的Y形嗅觉仪实验,拟探讨对叶榕不同时期隐头花序气味化合物组成和变化;对叶榕传粉榕小蜂对不同时期的花序的选择倾向。本研究有助于更好地理解榕属植物特异性化学信号的构成特点,以及化学信号如何调控榕树-榕小蜂专性共生关系,以揭示化学信号在物种生殖隔离形成中扮演的重要角色。
1 材料和方法
1.1 材料
选取中国科学院华南植物园(113°21′ E, 23°11′ N)内的对叶榕雄株。该区年降雨量1 623.6~1 899.8 mm,年均温为21.8℃,最高温在7-8月,最低温在1月[22],10-翌年3月为干季,4-9月为湿季,降水主要发生在湿季。
植物气味的散发易受温度、光照等外界条件影响,同种植物不同植株的气味组合成分不同,因此,为确保数据的可靠性以及后期降维分析,采集单个雄株内同一发育时期花序的气味作为该花序时期的1个样本,每个样本的榕果用量(8~28个)取决于榕果大小,每个花序时期的样本量不少于5个。
1.2 挥发物采集方法
为避免天气等因素的干扰,气味采集都选在晴朗的天气进行。采用动态顶空吸附法[7]收集对叶榕雌前期、雌花期和间花期花序的挥发物。吸附剂包括Tenax TA (60/80目)和Carbotrap (20/40目), 购于北京飞美斯分析科技有限公司。采样前在采样小管内加入100 ngL–1的正壬烷和十二烷作为内标。采集的榕果装入一端扎紧的特氟龙膜袋内,另一端扎紧与采样管相连,采样管后接气流计。在气泵的带动下,气体以300 mL min–1的流速流经采样管,气味挥发物被管内的吸附剂吸附。同时相同实验条件下,收集实验环境的空气作为空白对照。采集到雌前期、雌花期和间花期花序气味样品分别为5、5和6个。采集到的样品及时送往园内公共实验室进行气相色谱-质谱联用仪(GC-MS)的分析。
1.3 挥发物分析方法
采集的对叶榕花序挥发物样品利用气相色谱-质谱联用仪(GCMS-QP2010Plus, SHIMADZU)进行分析。GC的分析条件为: HP-5MS石英毛细管柱(30.0 m×0.25 mm×0.25m); 进样口是PTV1进样口,进样采用分流模式,分流比是10.0。柱温40℃保持5 min, 程序升温以7.5 ℃min–1升温至280℃, 保持8 min;进样口温度程序40℃保持2.5 min。总流量25.0 mL min–1,柱流量为2.0 mL min–1,线速度51.0 cm s–1,吹扫流量3.0 mL min–1。柱前压112.0 kPa; 进样量2.0L。载气为氦气。MS条件: 电子电离方式, 扫描范围20~450 amu, 电子能量为70 eV;传输线温度250℃;离子源温度230℃。
花序挥发物成分鉴定采用目前普遍认可的保留指数(retention index)定性法[23]。利用物质出峰时间可以得到目标物质的保留指数,利用标准谱库(FFNSC1.3、NIST14S、NIST05s)检索化合物, 查阅检索出的化合物保留指数,并与目标物质的保留指数比较,最终确定化合物成分。各组分的相对含量用色谱峰面积归一化法计算。
1.4 传粉榕小蜂室内行为试验
参照Chen等[16]的方法, 空气先由活性炭净化后通过加湿瓶,湿润的空气经过气体流量计分别进入不同的味源瓶,流量计控制气体流速100 mL min–1。以某一时期的花序果作为实验组味源,以其他时期或者空气作为对照组味源,试验选在小蜂活力较强的上午8:00-12:00进行。每次试验前一天下午采集将要出蜂的榕果放入纱网袋中带回实验室,自然出蜂后用于试验。作为味源的新鲜榕果在实验开始前收集,带回实验室,立即用于试验。
共设置6组行为试验,分别在3个时期花序和空气对照以及3个时期花序两两之间设置Y形管进行双向选择试验。
1.5 数据分析
利用Excel 2010计算各化合物相对含量。采用past 3.0进行非度量多维尺度(non-metric multidi- mensional scaling, NMDS)分析,对3个时期气味样品数据进行以下3个尺度的差异分析:(1) 包含所有出现的化合物;(2) 在某一时期出现次数≥3次的化合物;(3) 单个样本中相对含量达到80%的化合物。NMDS分析基于Bray-Curtis距离,通过降维将样本的差异以距离的形式展现在二维平面上,距离远近对应样本间差异的大小。用应力值(stress)来表示NMDS距离与观察矩阵的拟合程度, 该值越小表明拟合越好。采用Past 3.0进行非参数多元方差分析(PERMANOVA),用以衡量NMDS分析的差异是否显著。利用SPSS 16.0进行方差分析(ANOVA)和卡方检验,方差分析不同花序时期气味组成成分的数量差异和同一花序时期不同个体气味的异质性; 卡方检验比较传粉榕小蜂对不同发育时期隐头花序选择的差异。
2 结果和分析
2.1 花序的挥发物成分
从对叶榕3个发育时期花序的气味中共鉴定出64种化合物(表1,化合物按照保留指数排列),其中雌前期、雌花期、间花期花序中的化合物分别有40、45、57种。在气味成分数量上,间花期多于雌前期(=7.167,=0.087)和雌花期(=9.333,=0.056), 雌前期和雌花期没有差异(=2.444,=0.819),这2个时期均出现的化合物达35种,且化合物的相对含量也有相同的变化趋势。将化合物按照不同的代谢途径分类,可分为脂肪酸衍生物、单萜和倍半萜3类, 未检测到莽草酸途径的衍生物。倍半萜类化合物在3个时期的花序中均占有最大比例,分别是67.07%、69.48%和91.36%,随榕果发育,倍半萜类化合物含量呈现上升趋势,间花期的倍半萜相对含量高于雌前期(=0.053)和雌花期(=0.078)。相反,脂肪酸衍生物随花序发育时期呈现下降趋势, 且雌前期(=0.045)和雌花期(=0.011)的相对含量明显高于间花期。
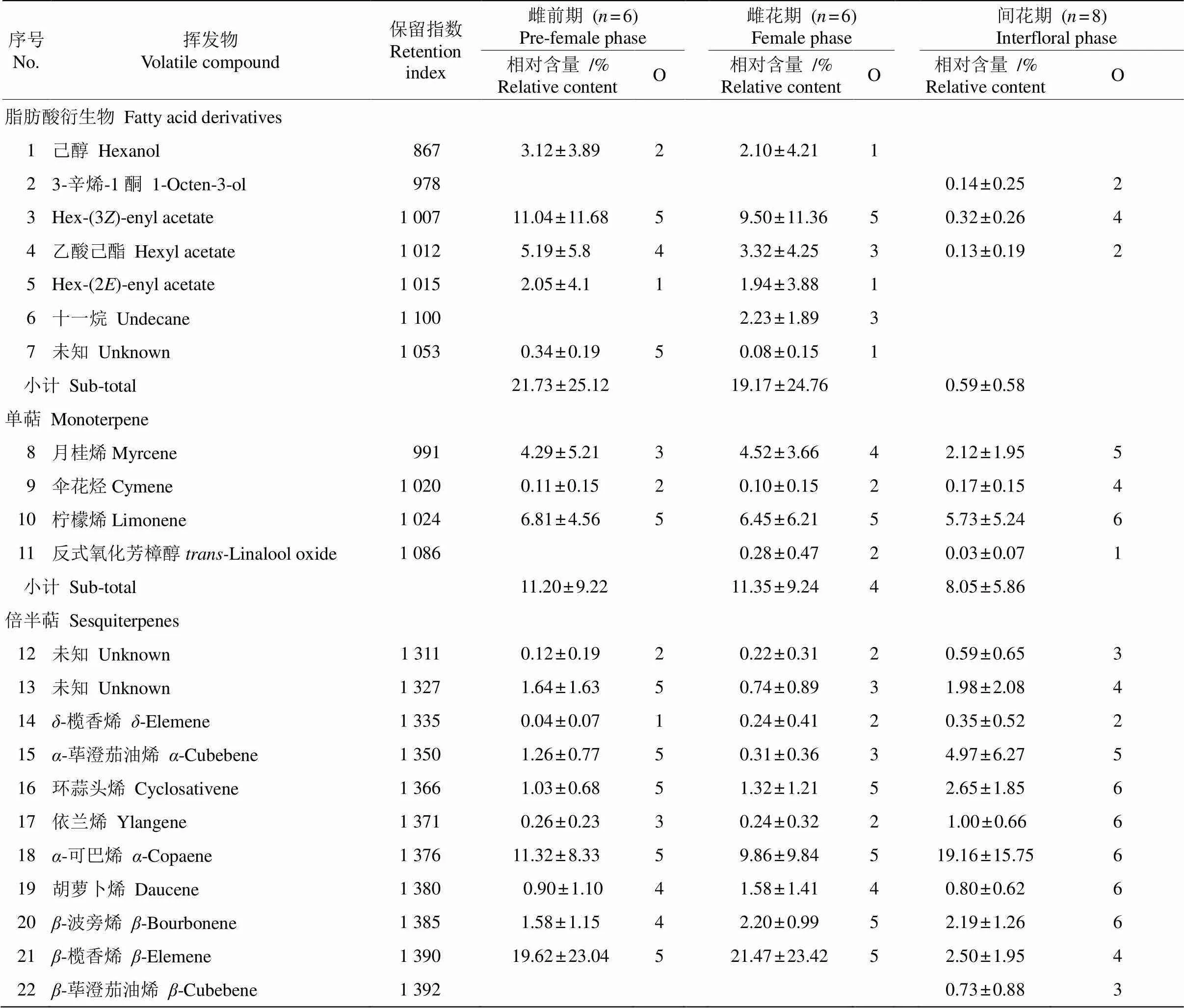
表1 不同发育期隐头花序挥发物的相对含量(%)和检测到的次数(O)
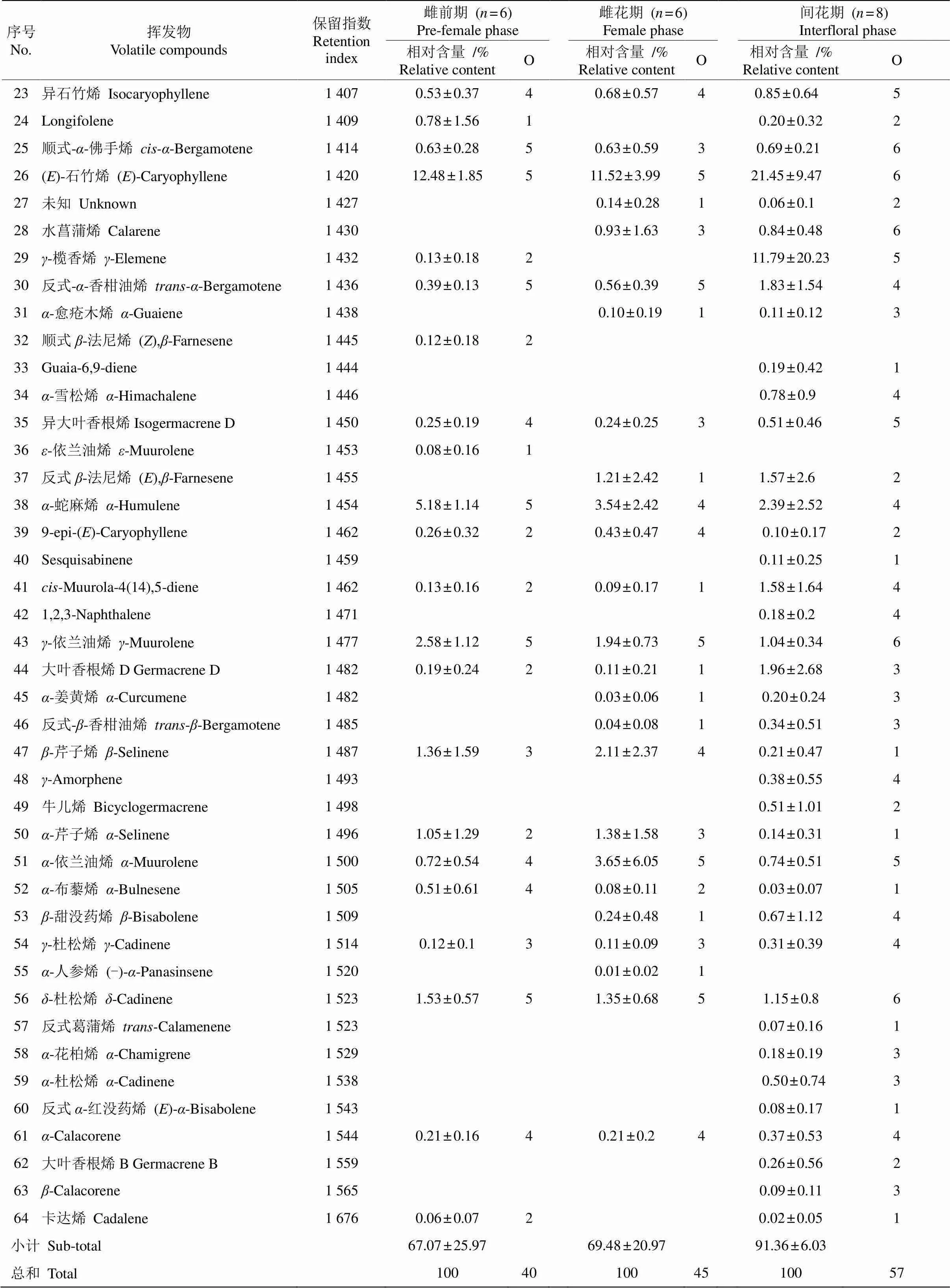
续表(Continued)
2.2 花序的挥发物成分差异
对3个时期花序的气味样品数据进行以下3个尺度的差异分析:
(1) 对3个花序时期的全部气味成分进行NMDS分析(stress=0.1772),结果表明,雌前期和雌花期的气味出现重叠,说明这2个时期花序的气味具有明显的相似性;而间花期与雌前期、雌花期可以很好的区分开。PERMANOVA比较结果表明,雌前期和雌花期的=0.8579,雌前期和间花期的=0.0039< 0.05, 雌花期和间花期的=0.0244<0.05,间花期与雌前期和雌花期在气味成分上的差异都达到显著水平(图1: A)。
(2) 选择在任一花序时期中出现次数≥3次的化合物进行NMDS分析(stress=0.1687),结果表明, 雌前期与雌花期花序的气味并无明显差异,而间花期与雌前期、雌花期均达到显著差异(图1: B)。
(3) 选出样品中相对含量≥80%的主要化合物进行降维分析(stress=0.1856),结果与上述两个尺度的相同,仅间花期与雌花期、雌前期气味存在显著差异,而雌前期和雌花期没有显著差异(图1: C)。
2.3 气味中主要化合物成分的变化
我们对样品中占总相对含量80%以上的20种化学成分进行分析,这些化合物不仅含量高,而且出现频率也很高,几乎在同一时期的所有样品,或者3个时期的所有样品中都能被检测到。己醇在雌前期出现,但在雌花期和间花期消失。月桂烯、顺式乙酸-3-己烯酯、乙酸己酯、-蛇麻烯、-依兰油烯在雌前期和雌花期的相对含量相近,但在间花期的相对含量明显降低。十一烷、-榄香烯、-芹子烯、-依兰油烯这4种化合物相对含量在雌花期达到最高,尤其是-榄香烯,在雌花期个别样品的相对含量超过50%,在雌前期-榄香烯和-芹子烯的相对含量略低于雌花期。-荜澄茄油烯、-可巴烯、反式石竹烯、-榄香烯、环蒜头烯、反式--香柑油烯和大叶香根烯D在间花期相对含量最高,尤其是前4种化合物的相对含量升高尤为明显(图2)。
2.4 同一发育时期不同个体间气味成分的差异
对同一花序时期的不同植株样品进行ANOVA检验,结果表明雌前期的=0.153,雌花期的= 0.076,间花期的=0.025,表明对叶榕同一发育期花序气味在不同植株间具有异质性,尤其是间花期,植株间的差异达显著水平。
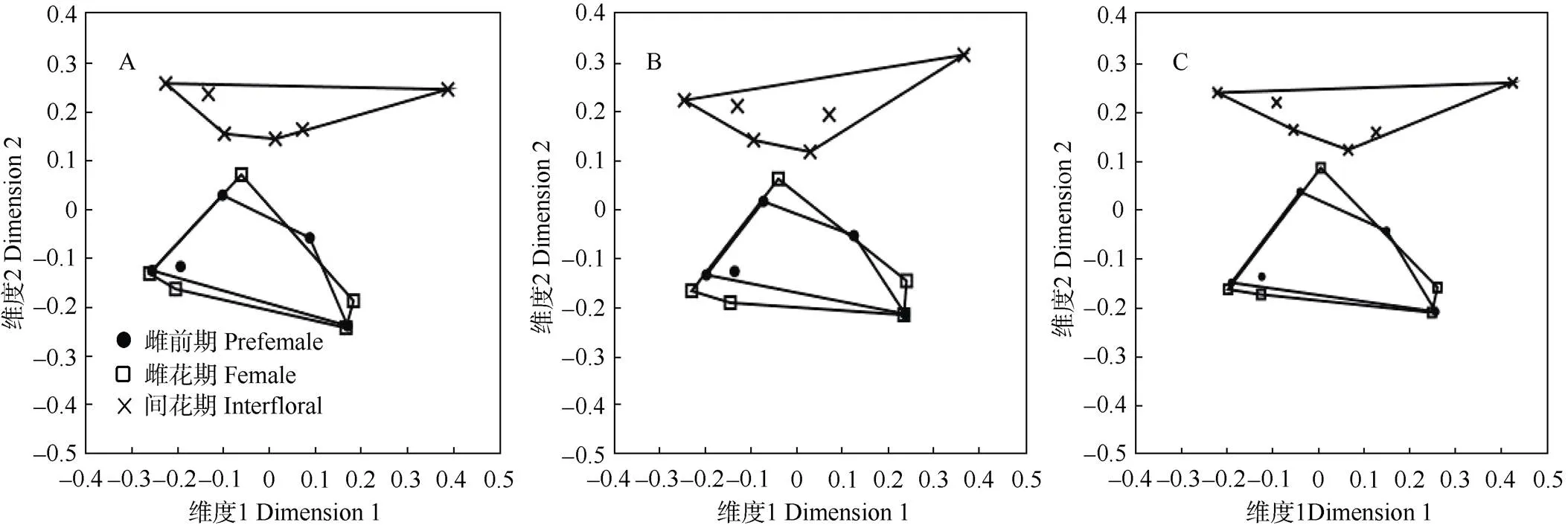
图1 对叶榕3个时期花序挥发物非度量性多维度分析(NMDS)。A: 所有化学成分; B: 任一时期出现≥3次的化合物; C: 相对含量≥80%的化合物。
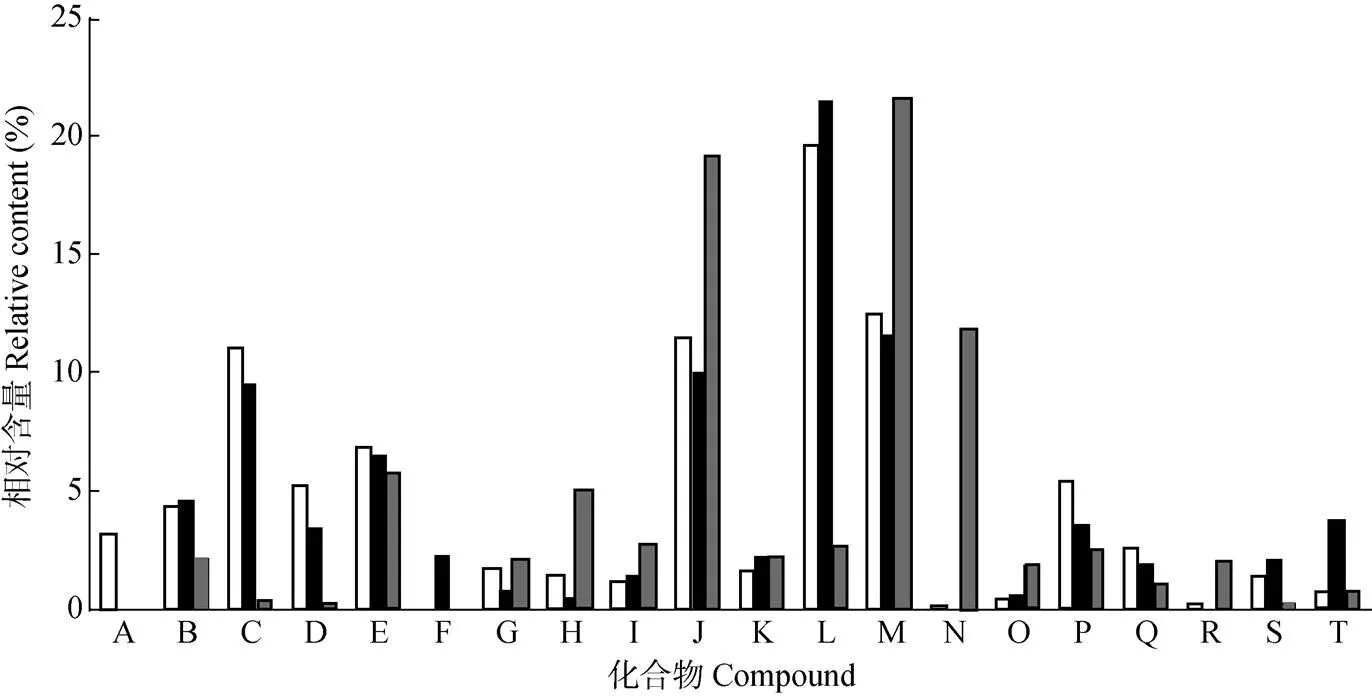
图2 对叶榕20种主要化合物的相对含量。A: 己醇; B: 月桂烯; C: 顺式乙酸-3-己烯酯; D:乙酸己酯; E: 柠檬烯; F: 十一烷; G: 未知化合物(c); H: β-荜澄茄油烯; I: 环蒜头烯; J: α-可巴烯; K: β-波旁烯; L: β-榄香烯; M: 反式石竹烯; N: γ-榄香烯; O: 反式-α-香柑油烯; P: α-蛇麻烯; Q: γ-依兰油烯; R: 大叶香根烯D; S: β-芹子烯; T: α-依兰油烯。
2.5 传粉榕小蜂对对叶榕3个时期花序的选择行为
当对叶榕传粉榕小蜂在雌前期、雌花期、间花期花序与空气对照之间做选择时,传粉榕小蜂倾向于选择雌前期(χ2=4.829,=35,=0.028<0.05)、雌花期(χ2=10.125,=32,=0.001)花序,而避开间花期(χ2=3.864,=26,=0.05)花序。当对雌前期和雌花期花序选择时,传粉榕小蜂的选择趋向相同,并未有明显倾向性(χ2=0.533,=30,=0.465)。对叶榕传粉榕小蜂在间花期和雌前期、间花期和雌花期之间选择时,明显避开了间花期花序,而倾向于选择雌前期(χ2=4.000,=36,=0.046<0.05)和雌花期(χ2=4.829,=35,=0.028<0.05)(图3)。
3 讨论
3.1 对叶榕3个时期花序挥发物的组成特征
对叶榕3个时期花序的挥发物均由多种化合物组成,这些化合物的相对含量在3个花序时期呈现动态变化。Song等[24]分析了对叶榕雌株和雄株花序在雌花期和间花期的化合物,由于采用溶剂提取法,提取的成分不仅包括榕果的挥发性成分,还包括在榕果组织内不具挥发性的代谢产物,所得到的物质种类与本研究结果相差较大。本研究利用动态顶空吸附法,直接采集对叶榕花序的挥发物,可以更好地反映对叶榕对传粉者起作用的化学信号。在对叶榕雌花期花序气味中,并未检测到在此期中占绝对优势,且在传粉后完全消失的某单一化合物, 这意味着对叶榕可能通过“泛化”策略吸引其传粉者,即对叶榕专性吸引传粉者的化学信号是由多种化学成分通过不同的比例实现的[13]。在雌花期相对含量较高且稳定存在,在产卵或者授粉后含量下降或者消失的化合物,可能是发挥特异性吸引作用的物质,如十一烷、-榄香烯、-芹子烯、-依兰油烯,可能是对叶榕雌花期花序专性吸引传粉者的目标化合物。Magali[20]对西双版纳对叶榕花气味的研究,雄株雌花期花序挥发物中相对含量较高的有芳樟醇、反式--石竹烯、吲哚和反式--罗勒烯。这与本研究结果有较大差异,这可能反映了不同地理分布的榕树,花序气味会受到所处环境的生物和非生物因素影响,而出现相应的变化。进一步利用气相色谱-昆虫触角电位联用仪,测试传粉榕小蜂触角对不同组成成分的电生理反应,可以真正定位于特异性的化合物,将有助于更好的理解对叶榕雌花期花序专一性吸引传粉者的化学机制。
在榕果的发育过程中,一般认为只有雌花期花序释放出特异性的成分,传粉者只能在雌花期进入果内产卵或者授粉,而产卵后或者授粉后,气味挥发物的释放量会显著降低,表现为挥发物的浓度会下降,一些组成成分会消失[14,20]。对叶榕花序气味的化合物种类在雌花期最多,而在雌株雌花期花完成授粉后的第2天和雄株雌前期花序产卵后12 d迅速降低,在小蜂产卵后16 d,雄花序检测到气味化合物仅32种[20]。Barker[25]对的研究表明,9 mm的榕果对应有更多的传粉小蜂进入果内,且9 mm的榕果也具有较多种类的挥发性化合物。而本研究结果表明,对叶榕间花期花序的挥发性化合物种类较雌前期和雌花期显著增加。值得注意的是,对传粉者起作用的专性化学信号,可能是由少数几种化学物质通过一定的配比决定的[26],因此,气味组成成分的数量多少并不对应气味对传粉者专性吸引能力的强弱[25]。对叶榕间花期挥发物的变化,可能是雌花期产生的物质在传粉后通过异构化(isomerization)而转化成其他种物质,或者暗示挥发物质在生物体内衰退的过程,也有可能是非传粉者寄主定位的化学信号[27]。
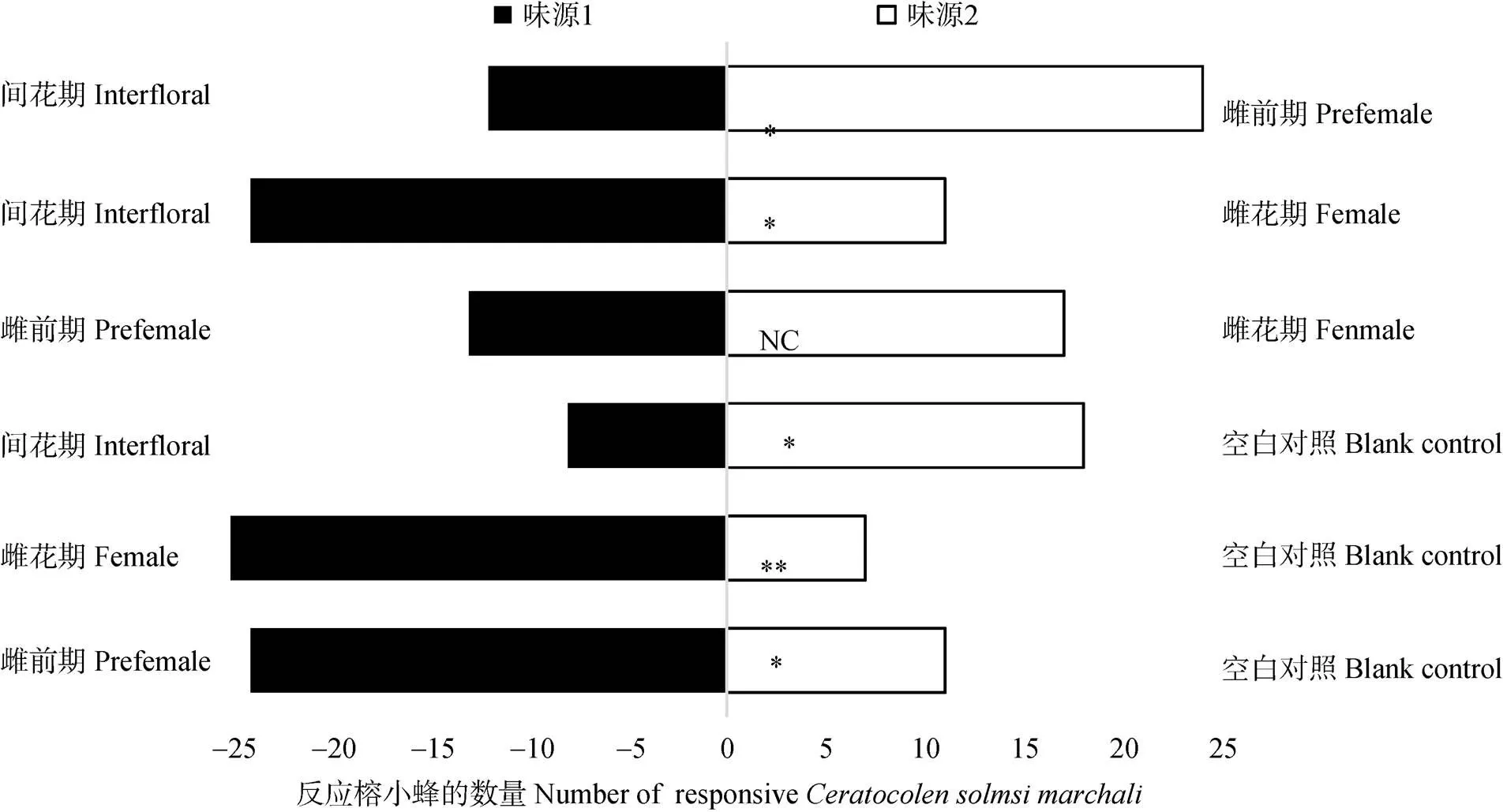
图3 对叶榕传粉榕小蜂对不同时期花序的Y形管试验。*: P<0.05; **: P<0.01; NC: 无明显选择倾向。
3.2 对叶榕吸引传粉榕小蜂特异性机制
从气味组成成分及其相对含量来看,对叶榕花序从雌前期到雌花期的发育过程中,气味并不具有太大差异。多个尺度的NMDS分析结果一致表明,雌前期花序气味与雌花期并不具有显著差异。对于榕果发育时期(雌前期和雌花期)的划分,并无绝对的界限,差别在于果内的小花是否发育到可以接受花粉或者被产卵的状态以及孔口处的苞片是否松动。因此,对叶榕花序从雌前期到雌花期的发育是一个连续的过程,气味释放也是一个连续的过程[19]。在榕果逐渐发育至雌花期的过程中,挥发性物质持续释放,有一定比例构成的特异性化合物也持续释放。行为试验的结果也表明,榕小蜂对雌前期花序和雌花期花序气味的选择倾向相同,雌前期花序气味对传粉榕小蜂具有明显的吸引作用。然而,在自然状态下,雌前期花序并不会有小蜂进入并成功产卵或者授粉。一些学者的观点是,雌前期释放的挥发物浓度较低,小蜂并不能感受到如此低浓度的化合物[19]。结合对叶榕的开花物候可知, 对叶榕常年结果,且同一批次的果量大,挥发物的浓度可能不是决定小蜂能否进入雌前期榕果的主导因素。另一种观点认为小蜂的形态与榕果孔口的形态并不匹配[28–29],传粉榕小蜂并不能顺利通过雌前期孔口处紧密层叠的苞片进入花序果。尽管如此,雌前期榕果挥发物与雌花期相似,可能具有生态适应性。雌前期释放的气味增强了气味的吸引能力,尤其是在仅有部分榕果进入雌花期的阶段,此时雌花期榕果释放的气味浓度低,由于雌前期榕果释放出与雌花期相似的气味信号,小蜂仍可以利用化学信号进行远距离定位,快速找到寄主榕树,为少量的雌花期花序授粉或者产卵。
传粉榕小蜂接收雌花期释放的特异性气味信号,进入隐头花序内产卵或者授粉,一旦小蜂成功产卵或者授粉,隐头花序即进入下一个发育时期, 挥发物的组成以及物质的释放量均发生改变[30]。传粉后花气味的变化可以阻止传粉者无效的拜访[23],提高传粉昆虫的传粉效率和对花的认知能力[31]。榕小蜂行为试验结果表明,间花期花序释放的挥发性物质对传粉榕小蜂有趋避作用,在给予传粉榕小蜂间花期花序和空气对照的选择下,榕小蜂明显倾向于选择空气对照,避开间花期气味。对叶榕雌花期释放出专性吸引传粉者的化学物质,而在花序产卵后气味物质发生改变,对传粉者起到趋避作用,对叶榕-传粉榕小蜂之间存在着“推拉”作用模式[32],这在其他榕树,如钝叶榕()[32]、细叶榕()[19]中均有报道。
对叶榕雌花期花序通过释放有一定配比的多种化学成分,吸引传粉者,即气味挥发物的“质”和“量”均对传粉者专性识别寄主起着重要作用。此外,其他两个时期(尤其是雌前期花序,与雌花期相似性很大),不管是气味物质的组成上,还是气味物质相对含量上,都有一定的相似性,但在自然状态下,雌前期和间花期花序果内都没有出现传粉榕小蜂,说明对叶榕-传粉榕小蜂之间专性关系的维持,应该还涉及孔口苞片、榕果大小等形态特征在近距离定位中的作用[33]。
同一花序时期内,不同个体的气味成分特征具有异质性,尤其是间花期的个体间差异显著。不同个体之间的气味差异来源反映了植株所处的微环境对植物气味的调节作用[34]。另一方面,不同时期榕果扮演不同的角色,对叶榕花序气味特征在间花期样本之间出现较大变异,由于间花期花序不需要吸引传粉者,一些特异性成分在间花期可能逐渐消失,反映了传粉者对间花期的气味选择弱于雌花期和雌花期。
本研究利用GC-MS联用仪分析了对叶榕3个花序时期气味的变化,结果表明,气味挥发物由多种成分组成,且十一烷、-榄香烯、-芹子烯、-依兰油烯这4种化合物可能是组成特异吸引信号的目标化合物。昆虫行为试验的结果支持了对叶榕雌花期花序气味可以极显著地吸引其传粉榕小蜂,且雌前期花序对榕小蜂也具有很强的吸引能力,相反,间花期的气味对传粉榕小蜂具有趋避作用。后期的研究工作,应进一步增加上述目标化合物不同配比下的Y形嗅觉仪试验、昆虫触角电位试验等, 可以更全面理解维持榕树-传粉榕小蜂体系专一性的化学机制。
[1] BERG C C. Classification and distribution of[J]. Experientia, 1989, 45(7): 605–611. doi:10.1007/BF01975677.
[2] JANZEN D H. How to be a fig [J]. Annu Rev Ecol Syst, 1979, 10: 13–51. doi: 10.1146/annurev.es.10.110179.000305.
[3] COOK J M, RASPLUS J Y. Mutualists with attitude: Coevolving fig wasps and figs [J]. Trends Ecol Evol, 2003, 18(5): 241–248. doi: 10. 1016/S0169-5347(03)00062-4.
[4] WEIBLEN G D. Phylogenetic relationships of functionally dioecious(Moraceae) based on ribosomal DNA sequences and morphology [J]. Amer J Bot, 2000, 87(9): 1342–1357. doi: 10.2307/2656726.
[5] PROFFIT M, JOHNSON S D. Specificity of the signal emitted by figs to attract their pollinating wasps: Comparison of volatile organic compounds emitted by receptive syconia ofand.in southern Africa [J]. S Afr J Bot, 2009, 75(4): 771–777. doi: 10.1016/j.sajb.2009.08.006.
[6] HOSSAERT-MCKEY M, GIBERNAU M, FREY J E. Chemosensory attraction of fig wasps to substances produced by receptive figs [J]. Entomol Exp Appl, 1994, 70(2): 185–191. doi: 10.1111/j.1570-7458. 1994.tb00746.x.
[7] HOSSAERT-MCKEY M, SOLER C, SCHATZ B, et al. Floral scents: Their roles in nursery pollination mutualisms [J]. Chemoecology, 2010, 20(2): 75–88. doi: 10.1007/s00049-010-0043-5.
[8] DUDAREVA N, NEGRE F. Practical applications of research into the regulation of plant volatile emission [J]. Curr Opin Plant Biol, 2005, 8(1): 113–118. doi:10.1016/j.pbi.2004.11.007.
[9] KNUDSEN J T, ERIKSSON R, GERSHENZON J, et al. Diversity and distribution of floral scent [J]. Bot Rev, 2006, 72(1): 1–120. doi:10. 1663/0006-8101(2006)72[1:DADOFS]2.0.CO;2.
[10] FÆGRI K, van DER P L. The Principles of Pollination Ecology [M]. 3rd ed. Oxford, New York: Pergamon Press, 1979: 1.
[11] PICHERSKY E, GERSHENZON J. The formation and function of plant volatiles: Perfumes for pollinator attraction and defense [J]. Curr Opin Plant Biol, 2002, 5(3): 237–243. doi:10.1016/S1369-5266(02)00251-0.
[12] WEIBLEN G D. How to be a fig waps [J]. Annu Rev Entomol, 2002, 47: 299–330.
[13] SAKAI S.spp. (Aristolochiaceae) pollinated by flies breeding on decomposing flowers in Panama [J]. Amer J Bot, 2002, 89 (3): 527–534. doi: 10.3732/ajb.89.3.527.
[14] GRISON-PIGÉ L, BESSIÈRE J M, HOSSAERT-MCKEY M. Specific attraction of fig-pollinating wasps: Role of volatile compounds released by tropical figs [J]. J Chem Ecol, 2002, 28(2): 283–295. doi:10.1023/ A:1017930023741.
[15] CHEN C, SONG Q S, PROFFIT M, et al. Private channel: A single unusual compound assures specific pollinator attraction in[J]. Funct Ecol, 2009, 23(5): 941–950. doi: 10.1111/j.1365- 2435.2009.01622.x.
[16] GALIL J, EISIKOWITCH D. On the pollination ecology ofin East Africa [J]. Ecology, 1968, 49(2): 259–269. doi: 10. 2307/1934454.
[17] CORNER E J H. Check-list ofin Asia and Australasia with keys to identification [J]. Gard Bull Singap, 1965, 21: 1–186.
[18] Soler C, Hossaert-McKey M, Buatois B, et al. Geographic variation of floral scent in a highly specialized pollination mutualism [J]. Phytochemistry, 2011, 72: 74–81.
[19] ZHANG T, WANG B, MIAO B G, et al. Chemical composition of volatiles from the syconia ofand host recognition behavior of pollinating fig wasps [J]. Chin J Plant Ecol, 2017,41(5): 549–558. doi: 10.17521/cjpe.2016.0250.张亭, 王波, 苗白鸽, 等. 榕树隐头花序挥发物组成及其传粉榕小蜂寄主识别行为[J]. 植物生态学报, 2017, 41(5): 549–558. doi: 10. 17521/cjpe.2016.0250.
[20] PROFFIT M, SCHATZ B, BESSIERE J M, et al. Signalling receptivity: Comparison of the emission of volatile compounds by figs ofbefore, during and after the phase of receptivity to pollinators [J]. Symbiosis, 2008, 45(1/2/3): 15–24.
[21] MAYR G L. Neue feigen-insekten [J]. Wien Entomol Ztg, 1906, 25: 153–187.
[22] YAN X, PENG Y Q, YANG D R. Spatial distribution patterns of three fig wasps on: How non-pollinators affect pollinator’s sex ratio [J]. Acta Ecol Sin, 2012, 32(2): 99–103. doi: 10.1016/j. chnaes.2012.02.003.
[23] BIANCHI F, CARERI M, MANGIA A, et al. Retention indices in the analysis of food aroma volatile compounds in temperature-programmed gas chromatography: Database creation and evaluation of precision and robustness [J]. J Sep Sci, 2007, 30(4): 563–572. doi: 10.1002/jssc.20 0600393.
[24] SONG Q S, YANG D R, ZHANG G M, et al. Volatiles fromand their attractiveness to fig wasps [J]. J Chem Ecol, 2001, 27(10): 1929–1942. doi: 10.1023/A:1012226400586.
[25] BARKER N P. Evidence of a volatile attractant in(Moraceae) [J]. Bothalia, 1985, 15(3/4): 607–611. doi: 10.4102/abc.v15i3/4.1854.
[26] SOLER C, HOSSAERT-MCKEY M, BUATOIS B, et al. Geographic variation of floral scent in a highly specialized pollination mutualism [J]. Phytochemistry,2011, 72(1): 74–81. doi: 10.1016/j.phytochem. 2010.10.012.
[27] PROFFIT M, SCHATZ B, BORGES R M, et al. Chemical mediation and niche partitioning in non-pollinating fig-wasp communities [J]. J Anim Ecol, 2007, 76(2): 296–303. doi:10.1111/j.1365-2656.2007.01213.x.
[28] WILLIAM R B. Coevolution ofand Agaonidae [J]. Ann Miss Bot Gard, 1974, 61(3): 770–780. doi: 10.2307/2395028.
[29] LIU C, YANG D R, COMPTON S G, et al. Larger fig wasps are more careful about which figs to enter-with good reason [J]. PLoS One, 2013, 8(9): e74117. doi:10.1371/journal.pone.0074117.
[30] SCHIESTL F P, AYASSE M. Post-pollination emission of a repellent compound in a sexually deceptive orchid: A new mechanism for maxi- mising reproductive success? [J]. Oecologia, 2001, 126(4): 531–534. doi: 10.1007/s004420000552.
[31] TOLLSTEN L. A multivariate approach to post-pollination changes in the floral scent of(Orchidaceae) [J]. Nord J Bot, 1993, 13(5): 495–499.
[32] GU D, COMPTON S G, PENG Y Q, et al. ‘Push’ and ‘pull’ responses by fig wasps to volatiles released by their host figs [J]. Chemoecology, 2012, 22(4): 217–227. doi: 10.1007/s00049-012-0108-8.
[33] WANG G, COMPTON S G, CHEN J. The mechanism of pollinator specificity between two sympatric fig varieties: A combination of olfactory signals and contact cues [J]. Ann Bot, 2013, 111(2): 173–181. doi: 10.1093/aob/mcs250.
[34] MAJETIC C J, RAGUSO R A, ASHMAN T L. Sources of floral scent variation [J]. Plant Sign Behav, 2009, 4(2): 129–131. doi:10.4161/psb. 4.2.7628.
Odour Composition Variation at Different Stages ofInflorescence and the Attraction to Pollinators
CHENG Yu-fen1,2,3, ZHANG Zhi-wei4, JIA Yong-xia3, CHEN Lian-fu1,3, YU Hui1,3*
(1. Key Laboratory of Plant Resources Conservation and Sustainable Utilization, Chinese Academy of Sciences, Guangzhou 510650, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. South China Botanical Garden, Chinese Academy of Sciences,Guangzhou 510650, China; 4. School of Life Sciences, Qufu Normal University, Qufu 273165, Shandong, China)
In order to understand the changes in volatile organic compounds (VOCs) of figs and its regulation to pollinators, the compositions of VOCs at three floral phases were determined in, and the behavioral responses of pollinatorsto different developmental syconia were observed by using Y-tube olfactometer. The results showed that there were 64 compounds were detected in syconia at three phases. Among them, four compounds, such as undecane,-elemene,-selinene, and-muurolene, might be the active substances attractive to pollinators. So the specific chemical signal ofto attract its pollinator was achieved by “generalization” strategy. The NMDS results showed that the VOCs of syconia at prefemale phase were similar to those at female phase, but those at interfloral phase were significantly different from those at the other two phases. There was a clear tendency for pollinators to select the syconia at prefemale and female phases, but avoid the ones at interfloral phase, indicating that there was a “push-pull” interaction mode between the figs and their pollinators. The VOCs released by syconia at pre-female phase could strengthen pollinator attraction. In addition, the VOCs vary among individuals at the same developmental phase showed VOCs emission was affected by the environment, especially at interfloral phase. These would help for understand the composition characteristics of VOCs inand the chemical signal function in maintaining fig-fig wasp mutualisms.
; Inflorescence; Volatile organic compound; Chemical signal
10.11926/jtsb.4016
2018–11–12
2019–01–07
国家自然科学基金面上项目(31670395); 广州市科技计划项目(201707010351);中国科学院植物资源保护与可持续利用重点实验室开放基金项目资助
This work was supported by the National Natural Science Foundation of China (Grant No. 31670395), and the Project for Science and Technology Planning in Guangzhou (Grant No. 201707010351), and the Open Fund of Key Laboratory of Plant Resources Conservation and Sustainable Utilization of China Academy of Science.
程玉芬(1991~ ), 女, 在读硕士生, 研究方向为进化生物学。E-mail: Chengyufen@scbg.ac.cn.
通信作者 Corresponding author.E-mail:yuhui@scib.ac.cn
