Aspergillus tubingensis 介导植酸盐水解促进U(VI)-PO43-生物矿化
2019-06-06王聂颖陈约余戴仲然丁德馨
王聂颖,张 辉,隋 阳,2,陈约余,胡 南,戴仲然,丁德馨*
介导植酸盐水解促进U(VI)-PO43-生物矿化
王聂颖1,张 辉1,隋 阳1,2,陈约余1,胡 南1,戴仲然1,丁德馨1*
(1.南华大学,铀矿冶生物技术国防重点学科实验室, 极贫铀资源绿色开发技术湖南省重点实验室,湖南 衡阳 421001;2.南华大学核科学技术学院,湖南 衡阳 421001)
从广东某铀尾矿库水下沉积物中分离筛选出了一株能水解植酸盐的真菌M5-1,对其菌落形态、ITS序列、最适生长pH值、对铀的耐受性及其水解植酸盐的效果进行了分析,随后对M5-1生物矿化铀过程中pH值、正磷酸盐浓度、铀浓度、铀去除率的变化进行了监测,对矿化产物的主要元素和矿物组成进行了分析.证实了真菌M5-1为(MH978623),其最适生长pH值范围为6~7,对铀(~0.84mmol/L)具有较强的耐受性;介导植酸盐水解促进U(VI)-PO43-矿化62d后,铀的去除率达95.2%;介导U(VI)-PO43-矿化过程中可能形成了难溶的氢铀云母和变钠铀云母矿物.结果表明,能有效水解植酸盐释放可溶性正磷酸盐,从而促进U(VI)-PO43-矿化.研究结果为采用介导植酸盐水解原位修复铀污染地表水提供了试验依据.
铀污染地表水;U(VI);;生物矿化;植酸盐水解
在核燃料循环过程中,都会有少量的铀释放到环境中,使部分水体受到一定程度的污染[1-2].进入水体的铀可通过食物链富集到人体内,以重金属毒性和内照射2种方式诱发慢性放射性疾病,对人体的健康造成威胁[3-4].因此,铀污染水体的修复方法已成为环境领域研究的重点.
原位生物修复技术与传统修复方法相比,具有设计简单、可行性高、对环境干扰小和经济性好等优点,是最具发展前景的铀污染水体修复技术之一,受到了广泛关注[5-6].近年来,国内外研究人员在铀的原位生物还原方面开展了大量研究.但是,研究发现生物还原过程形成的U(IV)矿物容易被O2、Fe3+、硝酸盐等氧化剂氧化,使铀再次释放迁移[7-9].而且,一些铀污染地区具有pH值低、硝酸盐浓度高、处于氧化状态等特点,从而限制了生物还原技术的应用[10].
于是,研究人员又开始研究铀的原位生物矿化,并发现与生物还原相比,它的适用范围更广、产物更稳定,被认为是一种最具发展潜力的铀污染水体修复方法[11].U(VI)的生物矿化通常是指U(VI)被微生物代谢过程中产生的PO43-等配位体矿化形成难溶的沉淀[11].近年来,研究人员发现,很多细菌和真菌在铀的胁迫下能产生磷酸酶,促进有机磷的水解以及释放正磷酸盐[12].Liang等[13]研究了黑曲霉和爪哇拟青霉以G2P为唯一磷源时固定溶液中铀的行为,发现在菌丝表面沉淀了大量的U-P矿物.植酸盐是一种经济高效的天然有机磷,可以被磷酸酶催化水解为低级肌醇衍生物(IP,=1~5)和正磷酸盐[14].以植酸盐为有机磷源,利用微生物介导植酸盐水解促进U-PO43-矿化,是一种实现铀污染水体修复的可行方法.
本研究采用平板分离法从广东韶关某铀尾矿库水下沉积物中分离筛选了能高效水解植酸盐的微生物,探索了该微生物以植酸盐为唯一磷源时对溶液中铀的矿化作用,监测了矿化过程中pH值、正磷酸盐和铀浓度的变化,并利用SEM-EDS和XRD分析了矿化产物的主要元素和矿物组成,以期为采用微生物介导植酸盐水解原位修复铀污染地表水提供试验依据.
1 材料与方法
1.1 材料
1.1.1 样品 试验所用的沉积物样品,于2017年12月25日采自广东某铀尾矿库2m深蓄水池底部的沉积物. 沉积物取样后立即装入无菌密封取样袋中,覆盖冰袋保存.运回实验室后放入-20℃冰箱保存.
1.1.2 试验用培养基 平板筛选培养基[15]:植酸钙0.3%, MgSO4·7H2O 0.05%, MnSO4·4H2O 0.05%, FeSO4·7H2O 0.003%, KCl 0.05%, NH4NO30.05%,葡萄糖 1.5%,琼脂粉1.8%.
改良马丁液体培养基[16]:蛋白胨0.5%,酵母浸膏0.2%,葡萄糖2%, KH2PO40.1%, MgSO4·7H2O 0.05%.
1.2 方法
1.2.1 菌种分离与筛选 取沉积物10g,放入盛有90mL无菌生理盐水和数粒玻璃珠的无菌锥形瓶中,放入摇床震荡30min,取出后分别制成10-3,10-4, 10-5,10-6,10-7,10-8,10-9稀释度的悬液.将不同稀释度的悬液分别涂布于pH值为4,5,6的平板筛选培养基上(此处将pH值设为4,5,6是由于铀尾矿库水中的pH值约为5),每个实验设3个平行样.将涂布好的平板放入恒温培养箱中30℃培养,每隔12h观察是否产生水解圈.
挑取水解圈与菌落直径之比较大的菌落多次接种,平板划线分离,获得一系列单菌落,再挑取单菌落重复以上操作,直至获得纯的培养菌株,同时将纯化后的目标菌株用甘油冷冻(-80℃)保存.
1.2.2 菌株M5-1菌落特征及其分子生物学鉴定 M5-1菌落特征:将1.2.1节分离到的一株可以高效水解植酸盐的真菌编号为M5-1.用无菌接种环将M5-1接种于改良马丁固体培养基上,30℃恒温培养5d,观察并描述菌落形状、质地和颜色等形态特征.
M5-1分子生物学鉴定:采用真菌核糖体内转录间隔区通用引物ITS1和ITS4进行PCR扩增.PCR采用50μL反应体系: PCRMix 25μL,ITS1(10μmol/L) 2.0μL,ITS4(10μmol/L)2.0μL,DNA template 1.0μL,加无菌ddH2O补足.PCR扩增条件: 98℃ 2min;98℃ 10s,54℃ 10s,72℃ 10s,35个循环;72℃ 5min.由上海美吉生物科技有限公司提供PCR扩增产物测序.所得ITS序列数据在NCBI在线数据库进行Blast序列相似性比对,使用MEGA4.1生成系统发育树.将测序数据提交至GenBank,申请序列号.
1.2.3 M5-1最适生长pH值和对铀的耐受性 250mL锥形瓶中加入100mL改良马丁液体培养基,将培养基的初始pH值分别调至3,4,5,6,7,8,9,高压蒸汽灭菌之后加入0.1mL OD600值为1.0的孢子悬液,每组实验设3个平行样.放入恒温摇床中,180r/min、30℃培养7d后用滤纸过滤收集菌丝体,60℃烘干至恒重,称量菌丝体干质量.
250mL锥形瓶中加入100mL改良马丁液体培养基,向锥形瓶中加入一定体积4.20mmol/L的铀母液,分别配制成铀浓度为0.084,0.21,0.42,0.63, 0.84mmol/L的液体培养基,以不添加铀母液的处理为对照组,将液体培养基的pH值调为5,过滤灭菌.向每个锥形瓶中加入0.1mL OD600值为1.0的孢子悬液,每组实验设3个平行样.放入恒温摇床中, 180r/min、30℃培养7d后用滤纸过滤收集菌丝体, 60℃烘干至恒重,称量菌丝体干质量.
1.2.4 M5-1水解植酸盐效果 向250mL锥形瓶中加入100mL不添加KH2PO4的改良马丁液体培养基,8.4mmol/L植酸钠,调节初始pH值为5(此处将pH值设为5是因为铀尾矿库水中的pH值约为5,且M5-1分离自pH值为5的固体培养基上),过滤灭菌后加入0.1mL OD600值为1.0的孢子悬液,以不接种M5-1的处理为对照组,每组实验设3个平行样.放入恒温摇床中,180r/min、30℃培养,每隔一段时间取上清液测pH值和正磷酸盐浓度.
1.2.5 铀和植酸盐的非生物沉淀 为了确保生物矿化实验中植酸盐不与铀以非生物方式形成沉淀,有必要研究铀和植酸盐之间的化学相互作用.250mL锥形瓶中加入100mL 168μmol/L的铀标准溶液,按 [Na12-IP6]:[U]的物质的量比为1:4,1:2, 1:1,5:1, 10:1,15:1,25:1,50:1添加植酸钠,调节溶液pH值为5,每组实验设3个平行样.室温下平衡7d后取上清液测铀浓度.
1.2.6 M5-1介导植酸盐水解促进U-PO43-矿化实验 实验分为A、B 2组,每组设3个平行样.250mL锥形瓶中加入100mL改良马丁液体培养基,实验条件如表1所示.A、B 2组放入恒温摇床中,180r/min、30℃培养.每隔一段时间取上清液测pH值、铀浓度和可溶性正磷酸盐浓度.最后的沉淀用超纯水洗涤8次后用于SEM-EDS和XRD分析.

表1 实验分组和条件
1.2.7 检测方法 溶液pH值采用pH计测量(HACH,HQ430D,USA);铀浓度采用5-Br-PADAP分光光度法测量(T6,新世纪,北京)[17];可溶性正磷酸盐浓度采用改进的钼酸铵分光光度法测量(T6,新世纪,北京)[18];沉淀的元素组成用扫描电镜能谱仪分析(FEI,Quanta 250,USA);沉淀的矿物类型用X射线全自动衍射仪分析(Bruer Axs,D8Advance,GER).
1.2.8 数据处理与分析 用Microsoft Excel 2016软件整理试验数据,计算平均值及标准差;用Origin 2016绘图;用Jade 6.0匹配XRD图谱;用SPSS 20.0进行方差分析,通过Tukey多重比较法检验处理间的差异显著性(<0.05),用不同小写字母表示差异显著性.
2 结果与讨论
2.1 菌株M5-1菌落形态
(a)在平板筛选培养基上形成的水解圈;(b)正面的形态;(c)反面的形态
2.2 M5-1鉴定结果及系统进化分析
采用平板筛选培养基分离、纯化植酸盐水解圈与菌落直径之比较大的菌株,得到M5-1(图1a). M5-1在改良马丁固体培养基上培养,第2d长出比较明显的菌落,质地丝绒状,初生时为白色,菌落背面为淡黄色,呈放射状.第3d少量菌丝顶端开始长出分生孢子,孢子最开始为黄褐色,随着培养时间增加,孢子颜色逐渐加深.第5d菌落直径达5~6cm,整个菌落呈现黑褐色,菌落背面呈黄褐色.初期菌落形态正面和反面如图1b、1c所示.
将M5-1的ITS序列在NCBI在线数据库进行Blast序列相似性比对,选择相关性较高的序列进行分析,建立了如图2所示的系统进化树.菌株M5-1与(MH185806.1)关系最紧密,位于同一分支中,相似度为99%.结合菌株M5-1的菌落特征,参考中国真菌志,可将菌株M5-1归为[19].其分类学地位是子囊菌门,散囊菌纲,散囊菌目,曲霉科,曲霉属,是一种好氧或兼性厌氧真菌,具有溶磷、释钾和固氮的功能[20]. GenBank序列号为MH978623.

图2 基于ITS序列的菌株M5-1系统发育树
2.3 Aspergillus tubingensis最适生长pH值和对铀的耐受性
环境pH值对微生物的增殖和活性会造成一定的影响.培养基初始pH值对菌丝干重的影响如图3a所示,当pH值为3~9时,均有不同程度的生长.当初始pH值为6~7时,其菌丝干重显著高于初始pH值为3,4,5,8,9的实验组(<0.05),说明的最适生长pH范围为6~7.
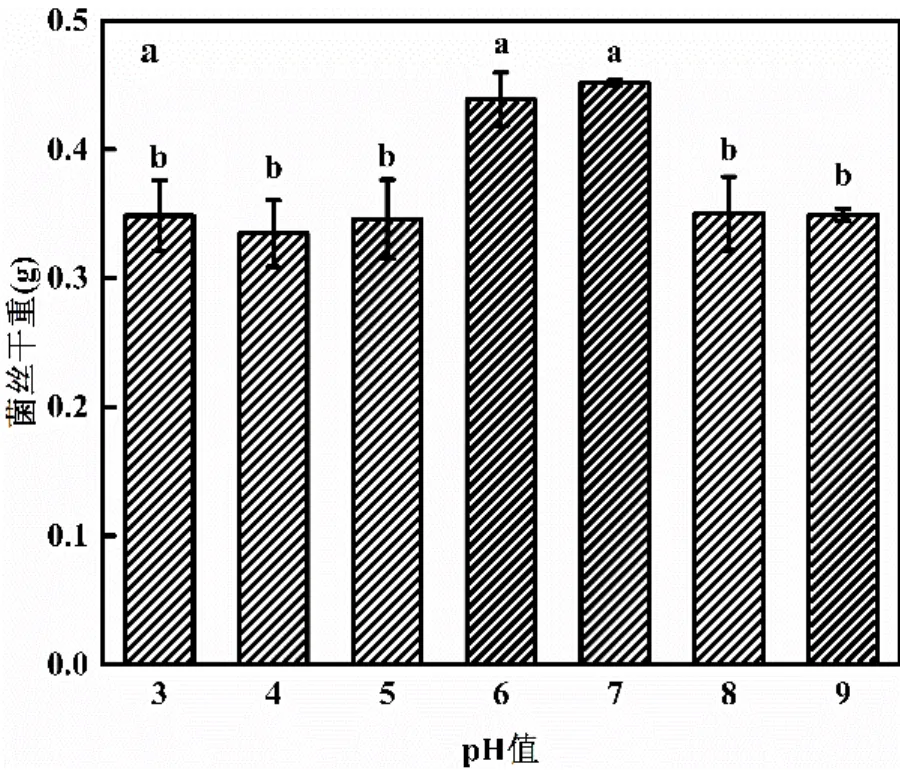
不同小写字母表示不同处理对菌丝干重影响差异显著(<0.05)
铀既是重金属元素又是放射性元素,具有毒性,对微生物的生长具有一定的影响,因此研究对铀的耐受性十分重要.如图3b所示,铀浓度为0~0.84mmol/L时,均能生长.铀浓度为0.21mmol/L时,的菌丝干重略高于对照组,其菌丝干重相比对照组只提高了5.41%;而其它铀浓度实验组的菌丝干重相比对照组虽有所降低,但均无显著差异.这些结果表明,对0~0.84mmol/L的铀具有耐受性.
2.4 Aspergillus tubingensis水解植酸盐效果

由图4a可知,对照组(未接种)溶液pH值基本保持不变,维持在5左右.然而实验组(接种了),在0~2d, pH值从5迅速降至3.33,第15d,pH值降至最低值2.73.造成培养液pH值降低的原因可能是: 1)在生长过程中分泌了有机酸[21-22]; 2)经呼吸作用产生了CO2, CO2溶于水形成碳酸[23-24],导致pH值降低.15~62d,pH值逐渐上升,最终升至5.79,pH值上升主要与植酸钠水解释放正磷酸盐有关.
水解植酸钠过程中正磷酸盐浓度的变化如图4b所示.第10d开始,实验组(接种了)开始产生正磷酸盐,且正磷酸盐浓度随着时间的增加持续上升,这表明能有效水解植酸盐释放正磷酸盐.
2.5 非生物沉淀
铀浓度恒定为168 μmol/L时,不同[Na12-IP6]:[U]物质的量比下,溶液中水溶态铀浓度及其所占比例如图5所示.[Na12-IP6]:[U]£5:1时,溶液中水溶态铀所占比例随着[Na12-IP6]:[U]物质的量比的增加而减少.然而[Na12-IP6]:[U]³5:1时,溶液中水溶态铀所占比例随着[Na12-IP6]:[U]物质的量比的增加而增加.在1:2£[Na12-IP6]:[U]£15:1时,溶液中的铀主要以U-IP6形式沉淀.然而,当[Na12-IP6]:[U]³25:1时,溶液中水溶态铀所占比例增加,80%以上的铀存在于溶液中.该现象与John等[25]的研究结果吻合.鉴于[Na12-IP6]: [U]³25:1时,80%以上的铀存在于溶液中,本研究采用[Na12-IP6]:[U]=50:1进行介导植酸盐水解促进U-PO43-矿化的实 验.

图5 溶液平衡7d后水溶态铀的浓度及其所占比例
由图4a可知,在水解植酸盐的过程中,溶液pH值变化较大.为确定不同pH值下植酸钠溶液中水溶态铀的浓度及其所占比例,本文研究了在初始铀浓度为168μmol/L,[Na12-IP6]: [U]= 50:1,溶液pH值分别为2,3,4,5,6,7的条件下,溶液平衡7d后,其中水溶态铀的浓度及其所占的比例.试验结果如图6所示.当pH值分别为2,3,4,5,6,7时,溶液中水溶态铀的浓度和其所占比例相差甚微,说明当[Na12-IP6]:[U]=50:1时,pH值对溶液中水溶态铀的浓度及其所占比例影响很小.
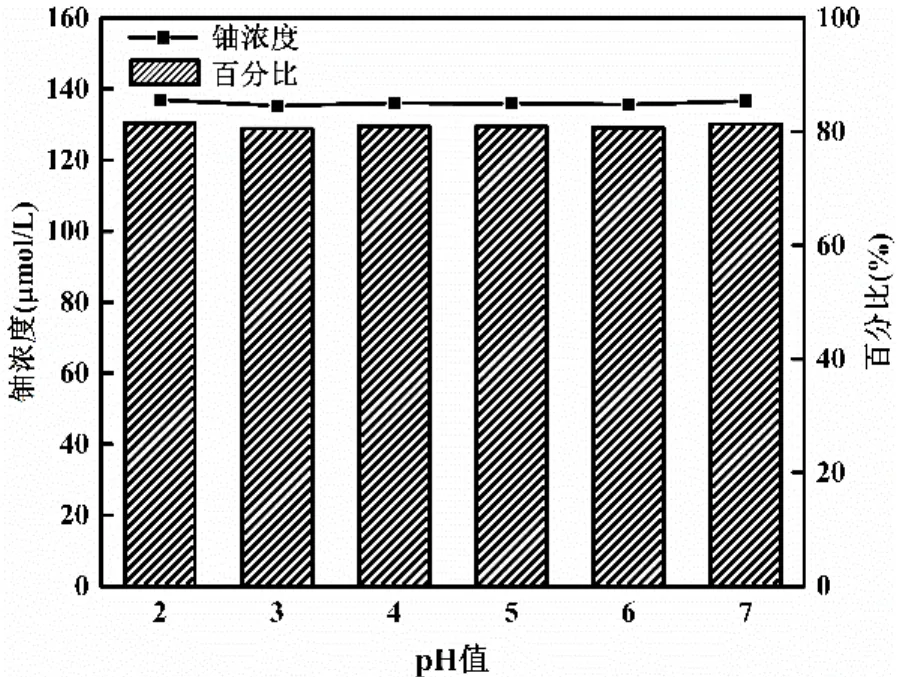
图6 不同pH值下溶液平衡7d后水溶态铀的浓度及其所占比例
2.6 Aspergillus tubingensis介导植酸盐水解促进U-PO43-矿化过程中溶液pH值、正磷酸盐浓度、铀浓度和铀去除率的变化
介导植酸盐水解促进U-PO43-矿化过程中溶液pH值随时间的变化如图7a所示.由图可知:0~5d,A组pH值几乎没有变化,B组pH值从5迅速降至2.84.A组溶液pH值没有变化的原因可能是在生长初期对含铀的培养基有一段调整期,生长比较缓慢,释放的有机酸较少[26].B组溶液中pH值降低的原因是,植酸钠的存在,缩短了对含铀培养基的调整期,并且促进了的生长,它在生长过程中分泌了有机酸,还有它的呼吸作用产生的CO2溶于水形成了碳酸[21-24]. 5~62d, A组pH值最终降至2.38,B组pH值持续上升至5.58.A组pH值快速降低的原因也是,经过了调整期后生长较快,分泌了大量的有机酸以及呼吸作用产生了较多的CO2[21-24].B组pH值上升可能与植酸钠水解释放正磷酸盐有关.
介导植酸盐水解促进U-PO43-矿化过程中正磷酸盐浓度随时间的变化如图7b所示.第5d开始,B组开始产生正磷酸盐,且随着时间的增加正磷酸盐浓度逐渐上升,最终达到19.80mmol/L.与水解植酸盐实验中正磷酸盐的变化情况相比,可发现铀的存在刺激了正磷酸盐的产生.
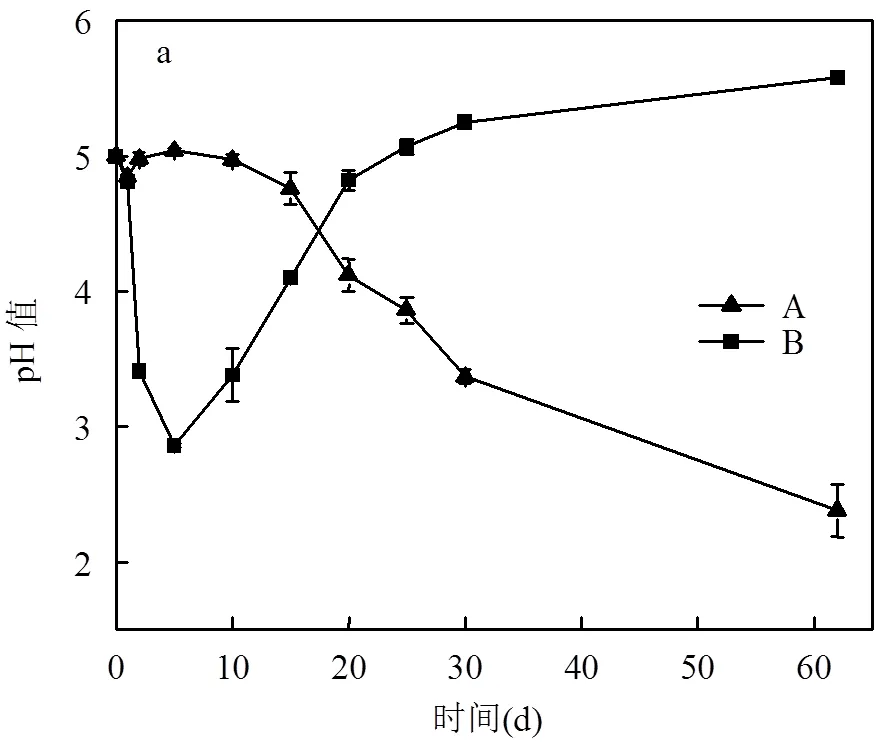
A:只添加铀;B:添加铀和植酸钠
介导植酸盐水解促进U-PO43-矿化过程中铀浓度和铀的去除率随时间的变化如图7c所示.0~20d,A组和B组铀浓度都出现波动.菌丝对铀的吸附与溶液pH值两者的耦合作用可能是导致A组铀浓度出现波动的主要原因;而B组铀浓度出现波动主要与溶液pH值、非生物沉淀和U-PO43-矿化三者的耦合作用有关[13,27-28].20~62d,A组铀浓度上升至初始值,B组铀浓度降至最低值,铀的去除率最终达95.2%.A组铀浓度回升至初始值的原因可能是溶液的pH值较低,吸附在表面的铀被解吸[29].B组铀浓度下降可能有如下两方面的原因:1)溶液中的铀可能被固定在了的菌丝上;2)溶液中释放的正磷酸盐与铀结合可能形成了难溶于水的U-PO43-沉淀[13].
2.7 扫描电镜/能谱分析
从图8a可以看出,沉淀中不存在晶体,且图8b中没有出现U的信号峰,说明A组实验没有生成含U的矿物.然而从图8c可以看出,沉淀中存在多面体晶体,且多面体晶体被包裹在菌丝体中间,表明铀的矿化产物可在菌丝体表面形成[30].从图8d可以看出,沉淀主要含U、P、Na、O等元素,且能谱中出现了较明显的U、P信号峰,说明介导U-PO43-矿化过程中可能形成了难溶的U-P矿物[31].
SEM图比例尺:10μm;A:只添加铀;B:添加铀和植酸钠
2.8 X射线衍射分析
介导植酸盐水解促进U- PO43-矿化过程中A、B 2组实验第62d沉淀的X射线衍射图谱如图9所示.A组的XRD图显示出较大的突起,说明该组实验形成的沉淀是非晶形结构[35].通过与XRD的PDF标准图谱进行比对发现,B组形成的沉淀中可能含有氢铀云母(H2(UO2)2(PO4)2·8H2O)和变钠铀云母(Na(UO2)(PO4)·3H2O)2种矿物.一些研究者也发现在微生物的作用下铀可与PO43-结合形成氢铀云母和变钠铀云母矿物[1,30-31,34].
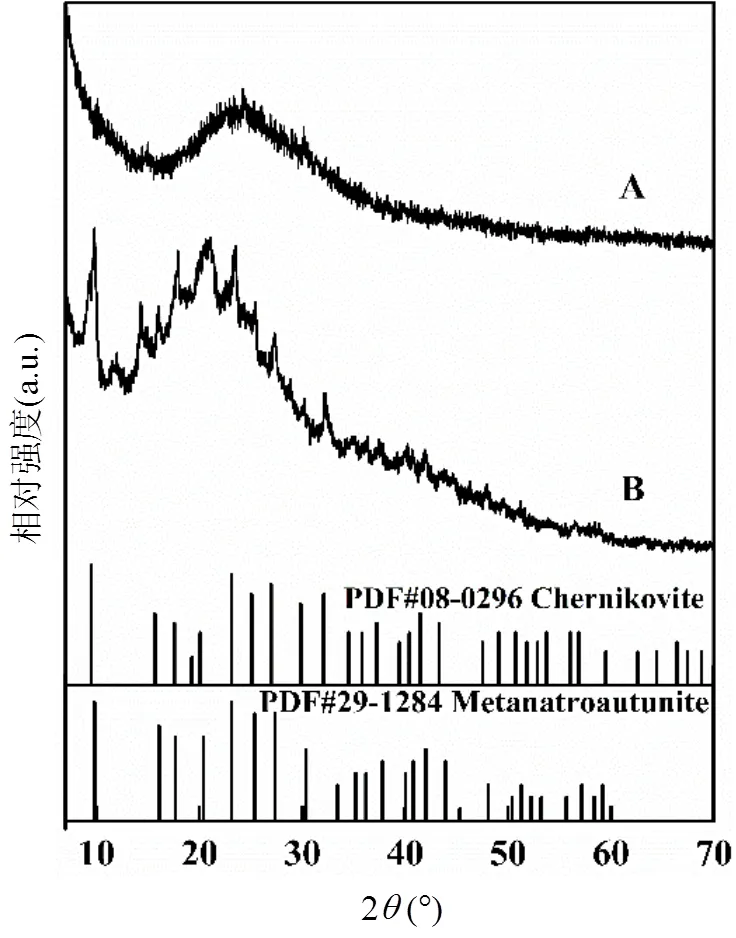
图9 Aspergillus tubingensis介导植酸盐水解促进U-PO43-矿化过程中A、B 2组第62d沉淀的XRD图谱
A:只添加铀;B:添加铀和植酸钠
3 结论
3.1 经形态观察和分子生物学鉴定,菌株M5-1为( MH978623).
3.2 菌株M5-1在pH值3~9范围内可以生长,其最适生长pH值范围为6~7.M5-1对铀具有较强的耐受性,可耐受的铀浓度高达0.84mmol/L.
3.3可以使植酸盐水解释放可溶性正磷酸盐,从而将铀原位固定,当初始铀浓度为168mmol/L时,溶液中铀的去除率达95.2%.
3.4 SEM-EDS和XRD分析表明,介导植酸盐水解促进U-PO43-矿化过程中可能形成了难溶的氢铀云母和变钠铀云母矿物.
[1] Zheng X Y, Wang X Y, Shen Y H,et al. Biosorption and biomineralization of uranium (VI) by— crystal formation of chernikovite [J]. Chemosphere, 2017,175:161- 169
[2] Yuan F, Wu C, Cai Y, et al. Synthesis of phytic acid-decorated titanate nanotubes for high efficient and high selective removal of U(VI) [J]. Chemical Engineering Journal, 2017,322:353-365
[3] Parrish R R, Horstwood M, Arnason J G,et al. Depleted uranium contamination by inhalation exposure and its detection after ∼20 years: implications for human health assessment [J]. Science of the Total Environment, 2008,390(1):58-68.
[4] Taylor D M, Taylor S K. Environmental uranium and human health [J]. Reviews on Environmental Health, 1997,12(3):147-158.
[5] Newsome L, Morris K, Lloyd J R. The biogeochemistry and bioremediation of uranium and other priority radionuclides [J]. Chemical Geology, 2014,363:164-184.
[6] Beazley M J, Martinez R J, Sobecky P A, et al. Uranium biomineralization as a result of bacterial phosphatase activity: insights from bacterial isolates from a contaminated subsurface [J]. Environmental Science & Technology, 2007,41(16):5701-5707.
[7] Wu W, Carley J, Luo J, et al. In situ bioreduction of uranium(VI) to submicromolar levels and reoxidation by dissolved oxygen [J]. Environmental Science & Technology, 2007,41(16):5716-5723.
[8] Moon H S, Komlos J, Jaffé P R. Biogenic U(IV) oxidation by dissolved oxygen and nitrate in sediment after prolonged U(VI)/ Fe(III)/SO42−reduction [J]. Journal of Contaminant Hydrology, 2009, 105(1):18-27.
[9] Wan J, Tokunaga T K, Brodie E, et al. Reoxidation of bioreduced uranium under reducing conditions [J]. Environmental Science & Technology, 2005,39(16):6162-6169.
[10] Wu W, Carley J, Fienen M, et al. Pilot-scale in situ bioremediation of uranium in a highly contaminated aquifer. 1. conditioning of a treatment zone [J]. Environmental Science & Technology, 2006, 40(12):3978-3985.
[11] Wufuer R, Wei Y, Lin Q, et al. Uranium bioreduction and biomineralization [J]. Advances in Applied Microbiology, 2017,101: 137-168.
[12] Knox A S, Brigmon R L, Kaplan D I, et al. Interactions among phosphate amendments, microbes and uranium mobility in contaminated sediments [J]. Science of the Total Environment, 2008,395(2):63-71.
[13] Liang X, Hillier S, Pendlowski H, et al. Uranium phosphate biomineralization by fungi [J]. Environmental Microbiology, 2015, 17(6):2064-2075.
[14] Salome K. Non-reductive biomineralization of U(VI)-phosphate minerals through the activities of microbial phytases [D]. Atlanta: Georgia Institute of Technology, 2013:48-52.
[15] 王晓东,胡海滨,麦康森,等.土壤中单宁和植酸降解菌的筛选、鉴定及液态发酵研究 [J]. 水产学报, 2016,40(10):1634-1642. Wang X D, Hu H B, Mai K S, et al. Screening and identification of tannic acid and phytic acid degradative microorganisms from soil and the submerged fermentation study [J]. Journal of Fisheries of China, 2016,40(10):1634-1642.
[16] 李振高,骆永明,腾 应.土壤与环境微生物研究法 [M].北京:科学出版社, 2008:52-61. Li Z G, Luo Y M, Teng Y. Soil and environmental microbiological research method [M]. Beijing: Science Press, 2008:52-61.
[17] GB 11220.1-1989 土壤中铀的测定 CL-5209萃淋树脂分离2-(5-溴-2-吡啶偶氮)-5-二乙氨基苯酚分光光度法[S]. GB 11220.1-1989 Determination of uranium in soil CL- 5209extractant-containing resin separation 2-(5-bromo-2- pyridulazo)-5-diethlaminopheol spectrophotometry [S].
[18] Heinonen J K, Lahti R J. A new and convenient colorimetric determination of inorganic orthophosphate and its application to the assay of inorganic pyrophosphatase [J]. Analytical biochemistry, 1981, 113(2):313-317.
[19] 齐祖同.中国真菌志(第5卷):曲霉属及其相关有性型 [M]. 北京:科学出版社, 1997:92-93. Qi Z T. Chinese Fungi (5):and related sexual type [M]. Beijing: Science Press, 1997:92-93.
[20] 吴 沣,郝瑞霞,鲁安怀,等.塔宾曲霉的生物学特征及其对环境中Pb2+的固定作用研究 [J]. 环境科学学报, 2015,35(1):144-151. Wu F, Hao R X, Lu A H, et al. Biological characteristics ofand its fixation to Pb2+[J]. Acta Scientiae Circumstantiae, 2015,35(1):144-151.
[21] 刘晓芳,黄晓东,张 芳.一株溶磷黑曲霉的溶磷特性及溶磷机制初探 [J]. 河南农业科学, 2005,34(6):60-62. Liu X F, Hang X D, Zhang F. Preliminary study on phosphate- solubilizing characteristic and mechanism of anstrain [J]. Journal of Henan Agricultural Sciences, 2005,34(6):60-62.
[22] Rodrı́guez H, Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion [J]. Biotechnology advances, 1999,17(4/5): 319-339.
[23] Illmer P, Schinner F. Solubilization of inorganic phosphates by microorganisms isolated from forest soils [J]. Soil Biology & Biochemistry, 1992,24(4):389-395.
[24] 杨 慧,范丙全,龚明波,等.一株新的溶磷草生欧文氏菌的分离、鉴定及其溶磷效果的初步研究 [J]. 微生物学报, 2008,48(1):51-56. Yang H, Fan B Q, Gong M B, et al. Isolation and identification of a novel phosphate-dissolving strain P21 [J]. Acta Microbiologica Sinica, 2008,48(1):51-56.
[25] Seaman J C, Hutchison J M, Jackson B P, et al. In situ treatment of metals in contaminated soils with phytate [J]. Journal of Environmental Quality, 2003,32(1):153-61.
[26] 司 慧,罗学刚,望子龙,等.枯草芽孢杆菌对铀的富集及机理研究 [J]. 中国农学通报, 2017,33(8):31-38. Si H, Luo X G, Wang Z L, et al. Biosorption of uranium byand its mechanism [J]. Chinese Agricultural Science Bulletin, 2017,33(8):31-38.
[27] Bachmaf S, Planer-Friedrich B, Merkel B J. Effect of sulfate, carbonate, and phosphate on the uranium(VI) sorption behavior onto bentonite [J]. Radiochimica Acta, 2008,96(6):359-366.
[28] Yuan F, Wu C, Cai Y, et al. Synthesis of phytic acid-decorated titanate nanotubes for high efficient and high selective removal of U(VI) [J]. Chemical Engineering Journal, 2017,322:353-365.
[29] Hu N, Li K, Sui Y,et al. Utilization of phosphate rock as a sole source of phosphorus for uranium biomineralization mediated by[J]. RSC Advances, 2018,8(24):13459-13465.
[30] Ding D X, Xin X, Li L, et al. Removal and recovery of U(VI) from low concentration radioactive wastewater by ethylenediamine- modified biomass of[J]. Water, Air, & Soil Pollution, 2014,225(12):1-16.
[31] Choudhary S, Sar P. Uranium biomineralization by a metal resistantstrain isolated from contaminated mine waste [J]. Journal of hazardous materials, 2011,186(1):336-343.
[32] Zhang J, Song H, Chen Z, et al. Biomineralization mechanism of U(VI) induced by12-2: The role of functional groups and enzymes [J]. Chemosphere, 2018,206:682-692.
[33] Zheng X Y, Shen Y H, Wang X Y, et al. Effect of pH on uranium (VI) biosorption and biomineralization by[J]. Chemosphere, 2018,203:109-116.
[34] Latta D E, Kemner K M, Mishra B,et al. Effects of calcium and phosphate on uranium(IV) oxidation: comparison between nanoparticulate uraninite and amorphous UIV–phosphate [J]. Geochimica Et Cosmochimica Acta, 2016,174:122-142.
Biomineralization of U(VI)-PO43-promoted bymediated phytate hydrolysis.
WANG Nie-ying1, ZHANG Hui1, SUI Yang1,2, CHEN Yue-yu1, HU Nan1, DAI Zhong-ran1, DING De-xin1*
(1.Key Discipline Laboratory for National Defense for Biotechnology in Uranium Mining and Hydrometallurgy, Hunan Province Key Laboratory of Green Development Technology for Extremely Low Grade Uranium Resources, University of South China, Hengyang 421001, China;2.School of Nuclear and Technology, University of South China, Hengyang 421001, China)., 2019,39(5):2161~2169
The fungus M5-1capable of hydrolyzing phytate was isolated from the sediments of a uranium tailings repository in Guangdong Province. Its colony morphology, ITS sequences, suitable growth pH value, tolerance against uranium and effect on hydrolysis of phytate were systematically studied. The variations of pH value, orthophosphate concentration, uranium concentration and removal efficiency of uranium were monitored. The main elements and mineral components of the biomineralization products were also analyzed. It was found that the strain M5-1was(MH978623) with optimal growth at pH 6~7, andwith high tolerance against uranium (~0.84mmol/L). After biomineralization of U(VI)-PO43-promoted bymediated phytate hydrolysis for62days, the removal efficiency of uranium reached 95.2%. SEM-EDS and XRD analyses indicated that the insoluble chernikovite and metanatroautunite were formed during the biomineralization of U(VI)-PO43-The results showed thatcould effectively hydrolyze phytate to release soluble orthophosphate, which promoted the mineralization of U(VI)-PO43-. These results provided an experimental basis for the in-situ bioremediation of uranium contaminated surface water by biomineralization of U(VI)-PO43-promoted bymediated phytate hydrolysis.
uranium contaminated surface water;U(VI);;biomineralization;phytate hydrolysis
X591
A
1000-6923(2019)05-2161-09
王聂颖(1993-),女,湖南常德人,南华大学硕士研究生,主要从事铀污染水体生物修复技术研究.
2018-10-24
国家自然科学基金资助项目(U1401231,11775106)
*责任作者, 教授, dingdxzzz@163.com
