浒苔生长-衰亡过程中氮形态的迁移转化过程
2019-06-06张鹏燕严振伟钟晓松金月梅晏茂军于继凯
张鹏燕,严振伟,钟晓松,金月梅,晏茂军,于继凯,辛 宇*,刘 涛**
浒苔生长-衰亡过程中氮形态的迁移转化过程
张鹏燕1,2,严振伟1,钟晓松1,金月梅2,晏茂军1,于继凯1,辛 宇1*,刘 涛2**
(1.中国海洋大学化学化工学院,山东 青岛 266100;2.中国海洋大学海洋生命学院,山东 青岛 266003)
针对浒苔氮吸收代谢机制,通过连续培养实验研究浒苔生长-衰亡过程中不同形态氮在藻体和培养液中的分布和迁移.结果表明,浒苔在生长期吸收NO3--N(17.37μmol/(g·d))而衰亡期向胞外释放NH4+-N(0.84μmol/(g·d));在生长期胞内NO3--N占无机氮(DIN)73.75%~92.15%,在衰亡期NH4+-N占无机氮60.87%~92.13%;培养液中溶解有机氮(DON)浓度持续增加,其中<1kDa组分占64%~98%,> 1kDa组分占2%~36%.在培养期藻体细胞吸收DIN速率平均为8.96μmol/(g·d),释放DON的平均迁移速率约为59.57μmol/(g·d).通过收支模型计算,浒苔将近60%DIN转化为以<1kDa 组分占优的DON并分泌到胞外.由此可以推测,近海浒苔爆发可以在月际尺度上对水体生源要素结构产生显著影响.
浒苔;氮形态;切向超滤
我国自2007年初次爆发浒苔绿潮以来,2008~ 2018年已连续10a发生了覆盖面积超过267km2的大规模绿潮,而2009年的绿潮灾害最为严重,实际覆盖面积高达2100km2[1-2].浒苔在近海生长率可高达每天21.9%,5000t藻体在6周内可生长为100万t[3].由于浒苔生物量指数级快速增加,并且大量积聚、于海面形成斑块,浒苔绿潮具有持续时间长、规模大的特点[4-7].氮是海洋中最重要的生源要素之一.已有研究表明,浒苔绿潮规模和持续时间与海水中氮的含量、形态构成有着密切的关系[8-15].当水体中无机氮源被耗尽时,浒苔可以吸收利用有机态氮源[16-17].浒苔还具有营养盐吸收速度快的特点,在生长期快速吸收海水中N、P等营养盐并转化为自身所需的营养成分;在消亡期浒苔在水体中下沉、分解,并将所含营养物质释放到海水中[11-14].由此可以推测,浒苔绿潮的大规模爆发和消亡,将会在一定时空尺度上对海水氮磷等营养要素的化学形态、分布和结构产生重要影响.因此,研究浒苔生长-消亡全周期中氮在藻体胞内/外的形态转化和迁移过程,对于深入认知浒苔对氮的吸收代谢机制,预测浒苔爆发-消亡后对近海生态环境的影响,具有非常重要的科学意义和参考价值.
本文针对浒苔生长和消亡过程中,胞内外不同形态氮的分布和迁移转化这一科学问题,通过实验室连续培养,研究浒苔在生长-衰亡周期对氮素的吸收和释放过程;通过分析培养液和藻体胞内不同形态氮(NO3--N、NO2--N、NH4+-N和DON)的含量,探讨浒苔生长-衰亡过程培养液中和藻体胞内的不同形态氮之间的转化、迁移;通过切向超滤分析不同分子量范围DON浓度,探讨浒苔生长-衰亡过程中胞内外DON组分的相对变化规律;最终通过建立简单收支模型,量化浒苔爆发-衰亡对于水体氮库结构的影响.本文可为浒苔生长-衰亡过程与水体营养要素之间相互作用提供详实的数据支撑,并为浒苔爆发生态效应评估提供可靠的依据.
1 材料与方法
1.1 藻体的选取和预处理
浒苔()实验组样品取自于2018年7月绿潮发生时漂浮于青岛近岸的浒苔,选择藻体无“白化”,颜色为翠绿色的藻体,用海水冲洗,去除杂物,饥饿培养3d.预处理:实验前将洗净的藻体放入0.2% KI-I 溶液中浸泡1min,再用过滤灭菌的人工海水漂洗3~4次,以去除原生动物和附生生物[18].
1.2 培养实验设计
实验采用一次性培养.实验藻种于室内光照培养箱中用10L 的玻璃瓶培养,称取浒苔20g,分别放入玻璃瓶中进行培养,同时设置 3组平行样;温度:20℃;光照:6000lx;光照周期:12h:12h[19].培养所用海水为人工海水,用MilliQ水配置f/2培养基[20].人工海水中添NO3--N为30.00μmol/L,PO43--P为1.00μmol/L,不添加其他氮源.
1.3 参数测定
根据研究目标,需对培养液、藻体细胞内不同形态氮、以及培养液溶解有机氮不同分子量组分进行测定.在每次取样时,取出1g浒苔用滤纸吸干表面水分后,用电子天平称取藻体的湿重;同时取1L培养液,培养液用0.2μm的GTTP滤膜(Merck Millipore)过滤后用于营养盐浓度测定和切向超滤分析.用QuAAtro营养盐自动分析仪(Seal Analytical, Germany)测定水体中的NO2--N、NO3--N和NH4+-N,检出限分别是0.01,0.06,0.09mmol,精密度£3%[21].溶解无机氮(DIN)为NO2--N、NO3--N和NH4+-N浓度之和;总溶解氮(TN)采用碱性过硫酸钾消化之后用化学发光法测定,该方法的检测限为<0.01mmol/L[22]; DON由TN和DIN差减得到.浒苔体内的NO2--N、NO3--N和NH4+-N的测定,取0.1g经65℃烘干至恒重的浒苔粉末,加入50mL MilliQ水溶解[23],振荡10min后用0.2μm的GTTP滤膜过滤后,将滤液用营养盐自动分析仪测定其NO2--N、NO3--N和NH4+-N浓度;胞内TN的测定方法同培养液中TN的测定方法.
1.4 DON不同分子量组分测定
本文采用切向超滤来对培养液中DON不同分子量组分进行准确测定.自然海水中溶解有机物分子量£1000的组分主要包括小肽、寡肽、寡糖、寡核苷酸和维生素等;分子量³10000的组分,主要包括腐殖质、多肽、结合态氨基酸和蛋白质等[24].实验中采用的是Pall Filtron Corporation的Ultralab TM切向超滤系统,Ultralab TM超滤膜的标准截留分子大小分别为1kDa(分子量约为1000)和10kDa(分子量约为10000).在切向超滤过程中,预滤液平行流过膜表面,比滤膜孔径小的物质不断透过滤膜成为超滤液,粒径大的物质则随着切向流重新回到样品池中,如图1所示.随着超滤过程的进行,截留物质不断被浓缩,最后溶液被分离为两部分:一部分为超滤液(又称渗透液);另一部分为浓缩液(亦称截留液).例如:用1kDa的超滤膜包,则浓缩液含有> 1kDa溶解有机氮,而超滤液含有<1kDa溶解有机氮.
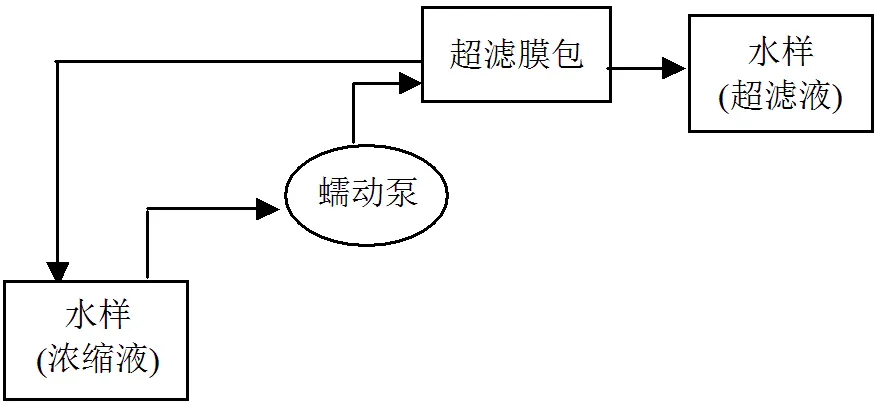
图1 切向超滤装置的工作流程
在样品处理前,切向超滤系统先用0.1mol/L NaOH清洗30min,然后用Milli-Q水清洗,之后再用0.1mol/L HCl清洗20min,此清洗步骤重复3次.在两个样品中间,依次用Milli-Q水,0.1mol/L NaOH溶液,Milli-Q水,0.1mol/L HCl溶液,Milli-Q水各冲洗30min,最后用少量下一个样品润洗切向超滤系统,然后开始切向超滤.超滤后所得超滤液和浓缩液,置于洁净的125mL高密度聚乙烯瓶(Thermo Co., USA)中用于测定无机态和有机态氮.
为了检验切向超滤系统效率和样品污染可能性,利用如下公式计算有机氮的质量平衡[25]:
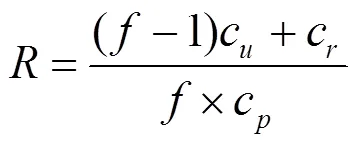
式中:为回收率,%;为浓缩因子(体积比);c、c和c分别为超滤液、预滤液和浓缩液中DON和DIN浓度.当<100%时,表明有机氮或无机氮营养盐在切向超滤过程中有损失,如果>100%,则表明切向超滤过程中有可能有潜在的污染.
经计算样品的切向超滤结果(表1): DIN的回收率为83.05%~101.00%,平均值为92.99%;DON的回收率为88.06%~106.37%,平均值为96.40%.以上结果表明在切向超滤过程中没有明显的DIN和DON的污染或损失,可以通过切向超滤对不同分子量DON组分实现较为准确的定量回收.

表1 切向超滤质量平衡检测
2 实验结果
2.1 浒苔相对增长速率
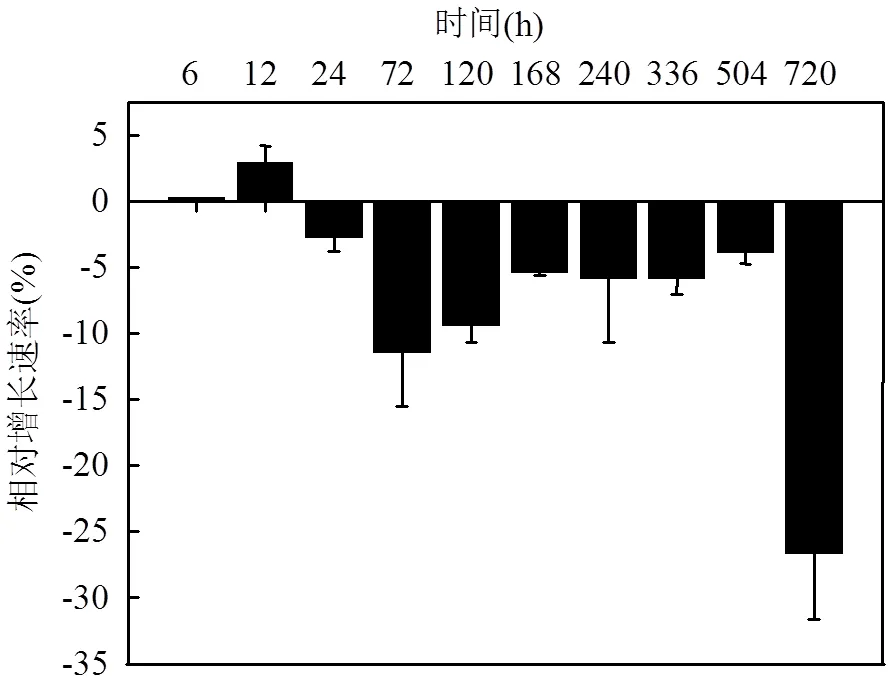
图2 浒苔藻体的相对增长速率
由图2可见,浒苔在整个实验过程中,藻体的相对增长速率在第6h、12h之内呈现增加的趋势,第12h时浒苔的相对增长速率高达2.87%/d.从第24h开始,藻体重量开始下降,相对增长速率降低了2.76%.第72h后浒苔重量迅速下降,之后浒苔重量降低的速率趋于平稳.根据浒苔的相对增长速率界定浒苔的生长-衰亡期,相对生长速率为正值,则浒苔处于生长期;相对增长速率为负值,则浒苔处于衰亡期.
2.2 培养液中氮形态和浓度变化
浒苔培养液中的NO3--N浓度在培养初期迅速下降,之后维持在较低的水平(图3).在第72h时,水体中NO3--N浓度降到2.88μmol/L,之后水体中的NO3--N浓度变化趋于平稳的趋势,NO3--N浓度维持在<1μmol/L.NH4+-N浓度变化呈现初始时降低随后略有上升的趋势,最终藻液中NH4+-N浓度达到21.87μmol/L.在培养全过程中培养液中NO2--N浓度在0.20μmol/L附近波动,没有显著变化.
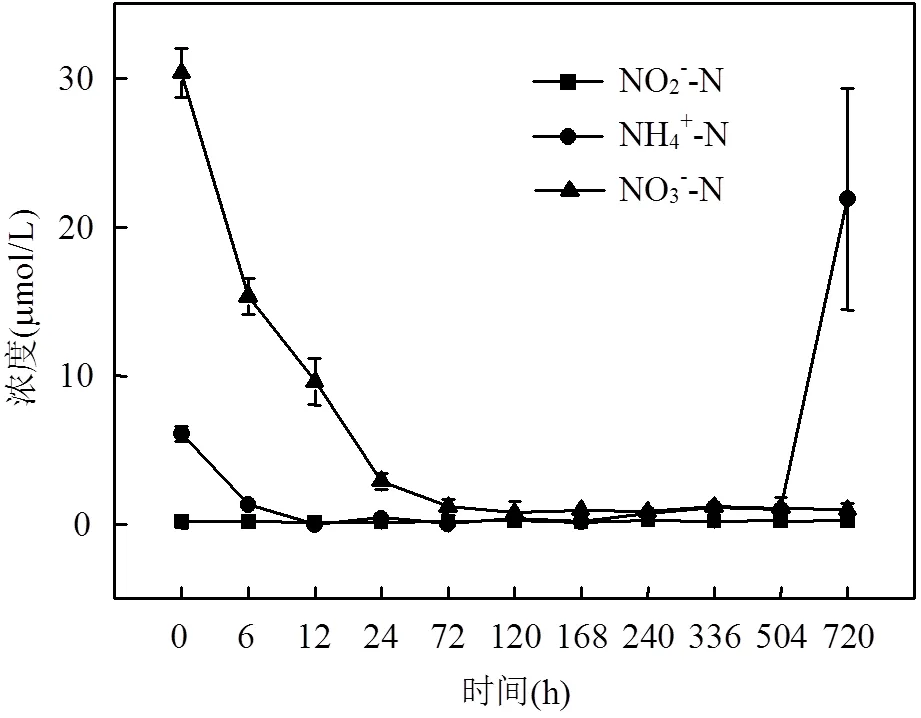
图3 培养液中NO3--N、NO2--N和NH4+-N的浓度变化
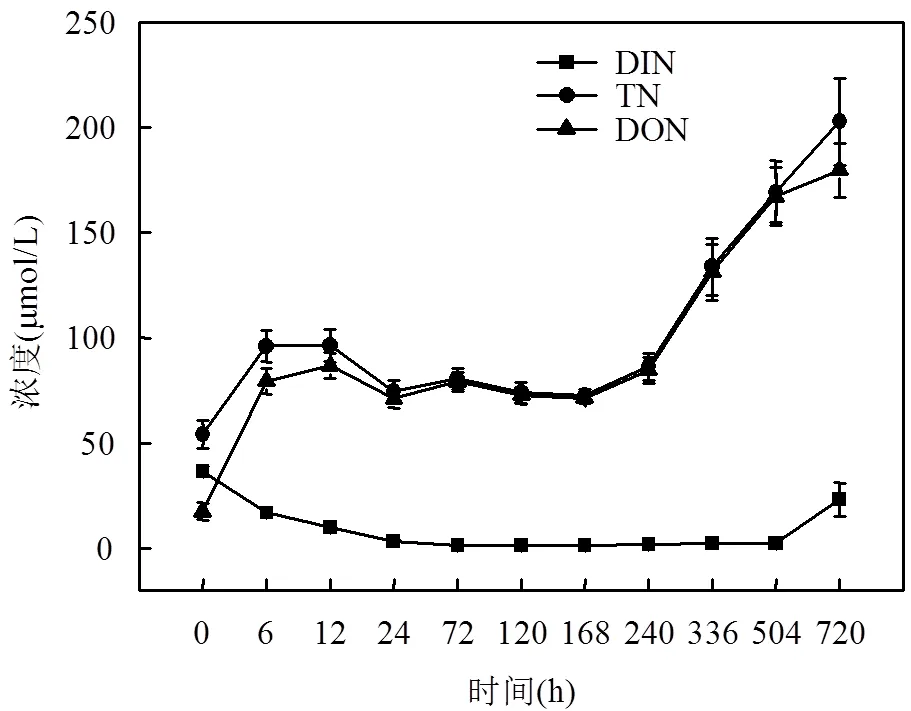
图4 培养液中DIN、DON和TN的浓度变化
浒苔培养液中DON和DIN的变化趋势呈现相反的态势(图4).TN和DON呈现出升高-降低-升高的趋势.在生长期浒苔培养液中DON的浓度达到86.67μmol/L.衰亡初期培养液中DON含量呈现增加的趋势;衰亡后期浒苔培养液中DON的浓度达到179.66μmol/L.
2.3 浒苔藻体细胞胞内氮形态和浓度变化

图5 藻细胞内NO3--N、NO2--N和NH4+-N的浓度变化

图6 藻细胞内DIN、DON和TN的浓度变化
浒苔藻体细胞胞内NO3--N、NO2--N和NH4+-N的浓度变化如图5所示.在培养24h之内浒苔藻细胞内NO3--N呈现增加的趋势,最高达到7.36μmol/g湿重,到第72h时,浒苔藻细胞内的NO3--N浓度迅速下降,降低到0.25μmol/g.培养后期,藻细胞内的NO3--N浓度略有升高,但一直维持在 1.00μmol/g以下.在生长期胞内NO3--N占DIN的73.75%~92.15%在整个培养阶段,浒苔藻细胞内的NO2--N浓度变化不大,维持在0.45umol/g左右.NH4+-N与NO3--N的变化趋势相反,在培养前期(0~72h),浒苔藻细胞内NH4+-N的浓度一直维持在较低的水平(1.00umol/g以下),随着浒苔的衰亡降解,浒苔藻细胞内NH4+-N浓度迅速上升,到培养结束时,浒苔藻细胞内的NH4+-N浓度最高时达到3.65μmol/g.在衰亡期NH4+-N占DIN的60.87%~92.13%.图6为浒苔藻体内DIN、TN和DON的浓度变化情况.在培养前期(0~72h),藻体内DON浓度降低,DIN浓度呈现增加的趋势.培养后期(72~720h),随着浒苔的衰亡,浒苔藻体内的DON含量先上升后降低,最终至65.47μmol/g.
2.4 培养液和藻体内N/P变化情况
在浒苔的生长-衰亡过程中,培养液中N/P的变化范围为23.03~1358.61,而浒苔胞内N/P的变化范围为0.66~22.79,如图7所示.培养液和藻细胞内N/P的变化趋势大体一致,在生长初期培养液和胞内的N/P升高,在72h时呈现降低的趋势,在衰亡后期时,培养液和藻细胞内的N/P一直呈现增高的趋势.
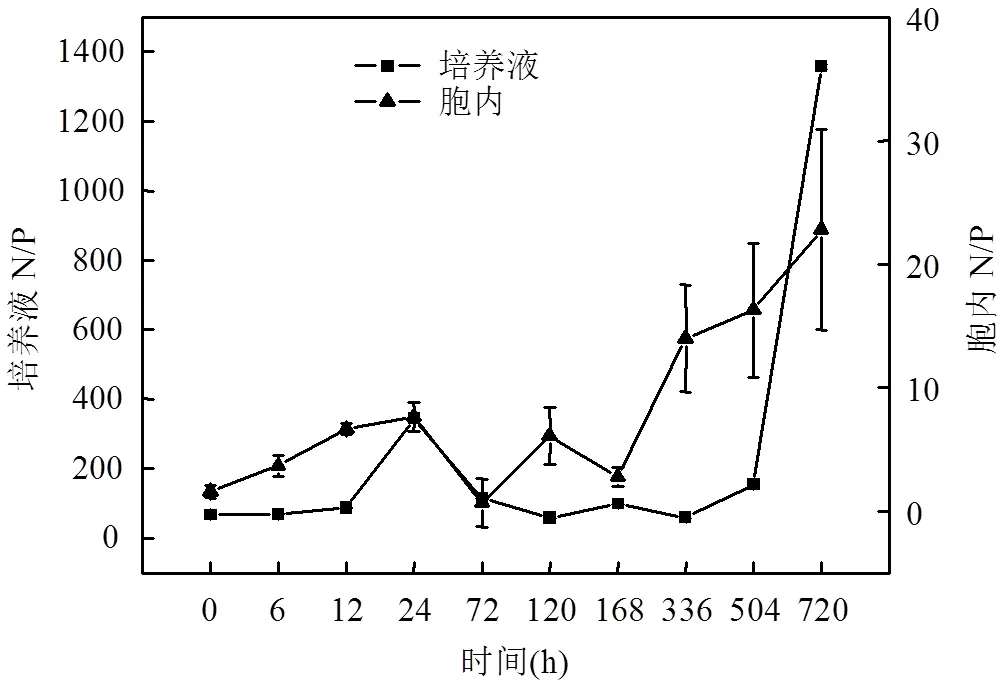
图7 培养液和藻细胞内N/P的变化
2.5 培养液中DON不同分子量组分分析
本文采用切向超滤对藻液中不同分子量范围的DON进行分离,研究培养过程中藻液DON不同组分的相对比例变化.在整个培养阶段选取5个时间点(第72,168,336,504,720h),对藻液DON进行切向超滤分离,分为3个组分:0.2μm~10kDa(标注为>10kDa),1~10kDa和<1kDa.综合5个时间点的数据可知<1kDa组分占DON比重最大,在60%以上.0.2μm~10kDa和1~10kDa组分DON含量相对较小,在40%以下(图8、9).
浒苔随着藻体的生长衰亡,<1kDa的组分所占比例呈现先升高后降低的趋势,其所占比例最大高达98%,后期降低至64%左右(图9).而>10kDa和1~10kDa的DON所占比例呈现先降低后升高的趋势.在培养阶段初期,>10kDa组分所占比例为5.0%,在培养终止时升高到14.1%;而1~10kDa的组分所占比例从开始的4.0%升高到培养结束时的22.2%.
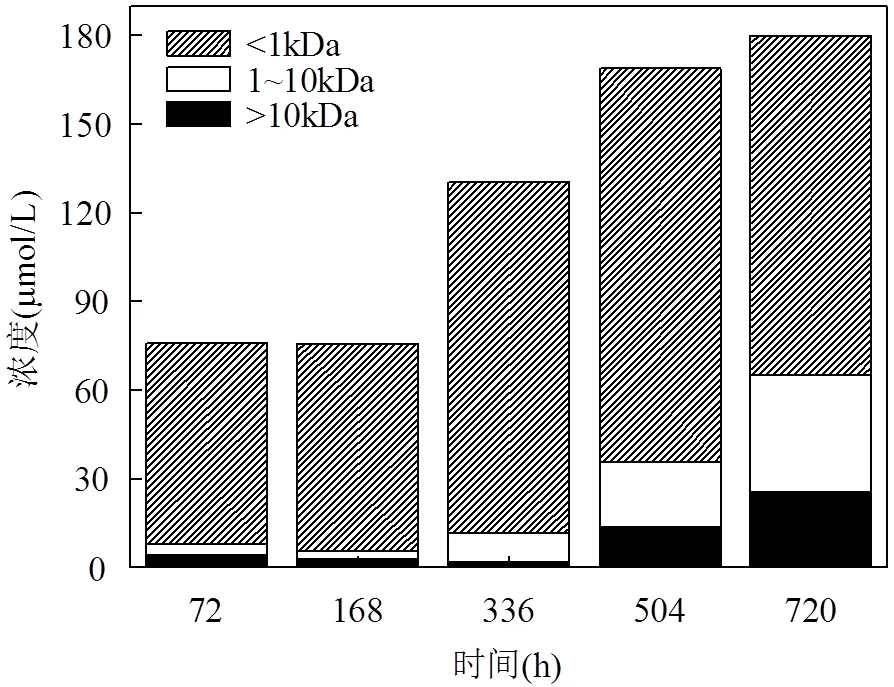
图8 各组分中DON的浓度变化

图9 各组分占DON百分比的变化
3 讨论
浒苔作为一种大型藻类,能够从海水中吸收大量氮磷营养盐,利用这些无机形态的生源要素转化为自身需要的有机/无机物质,最终随着其死亡分解再将这些有机/无机物质释放到水体中[26-27].一次浒苔爆发-消减历时1~2个月[28-29].可以推测,一次短暂的浒苔爆发很有可能在月的时间尺度上对当地水体生源要素结构产生较大影响.因此,本文针对浒苔生长和消亡过程中胞内外不同形态氮的分布和迁移转化这一科学问题,结合连续培养实验数据,分为以下3个部分进行探讨:1)浒苔胞内、外之间无机氮的迁移转化过程;2)浒苔胞内、外之间有机氮的迁移转化过程;3)通过浒苔细胞氮收支模型,量化浒苔爆发-衰亡对于水体氮库结构的影响.
3.1 浒苔胞内、外之间无机氮的迁移转化过程
本文采用米氏(Mihcaelsi-Menton)方程来描述稳态培养状态下藻类对营养盐的吸收速率与环境中营养盐浓度的关系.方程的形式为:

式中:是营养盐的吸收速率,μmol/(g·d);max是营养盐的最大吸收速率;是介质中限制性营养盐的浓度;K为半饱和常数.
营养盐吸收速率计算采用的公式为:

式中:是营养盐的吸收速率,μmol/(g×d);C为取样时培养液中营养盐的浓度,μmol/L;0为培养实验开始时培养液中营养盐的浓度,μmol/L;为浒苔湿重,g;为培养时间,d.
培养介质中NO3--N的浓度、浒苔对NO3--N的吸收速率与培养时间之间的变化均呈现出非线性关系,如图10所示.
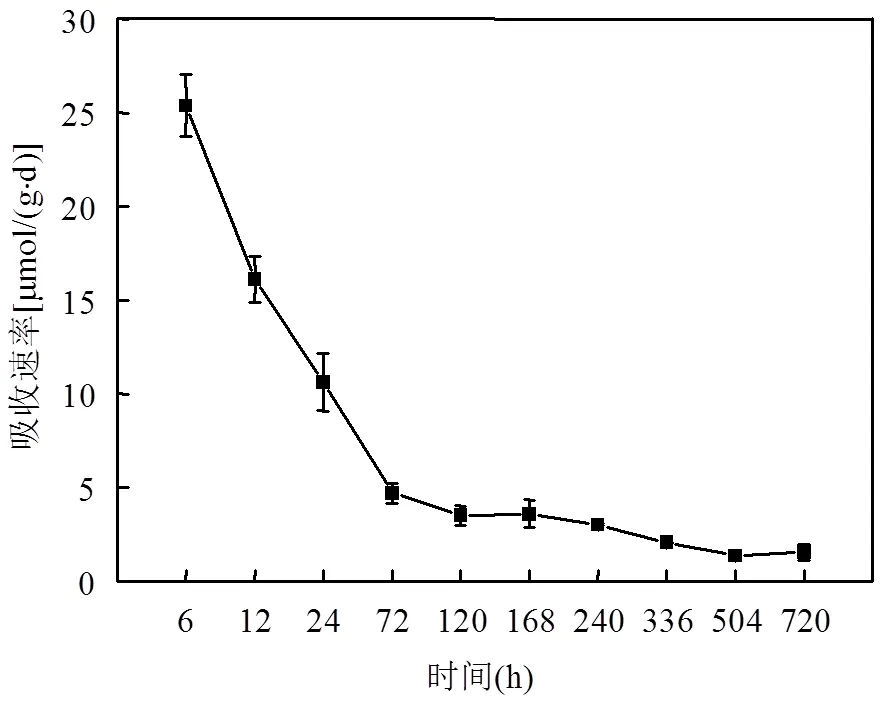
图10 浒苔对NO3--N的吸收速率随时间变化情况
由于培养后期培养液中NO3--N已被消耗低于2μmol/L,远低于半饱和常数,因此选取前5个取样时间分析得出,浒苔吸收NO3--N的动力学过程可以用Michaelis-Menten方程(米氏方程)来描述,回归方程为:

相关系数2=0.99(=5),浒苔的最大吸收速率为31.85μmol/(g·d),半饱和系数为6.46μmol/L.Li等[8]用40μmol/L的NO3--N培养的浒苔,其最大吸收速率为11.20μmol/(g(dw)·h),半饱和系数为5.00μmol/L,与本文的实验结果大体一致.吴晓文等[9]和史华明[11]研究浒苔对硝酸氮的吸收速率均高于200μmol/(g·d),因为他们培养浒苔的水体均是提高了水体的氮磷营养水平,其NO3--N浓度分别为160.0,111.1μmol/L,是本研究中添加NO3--N浓度的3~5倍.营养盐越高越促进浒苔生长.相对于其它种类营养盐,充足的N源是满足浒苔生长的重要基础.本研究中营养盐浓度设定是参考我国黄海春夏季真光层硝酸盐浓度(NO3--N最高浓度为15.00μmol/L, N/P=30:1)[30],为了培养实验易于进行和便于观察,适当增高NO3-N浓度为30μmol/L,这样的培养结果更贴近实际近海海水中浒苔的生长状况.
对于植物胞内对氮素的同化途径[31-32],一般认为是:

Heimer和Filner最早提出硝酸根存在的两个库,即代谢库与储藏库,代谢库位于细胞质内,储藏库位于液泡内.只有代谢库内的硝酸根离子才可诱导产生NR并参与还原.因为糖酵解是在细胞质中进行,它的产物就是氨反应的底物,亚硝酸根离子生成的停止是由于代谢库内的硝酸根离子耗尽所致.代谢库中的NO3--N只占细胞内含量的一小部分,而大部分则存在于液泡,因为成熟植物细胞中的液泡体积占总体积的90%.
在本研究中发现,浒苔在培养初期迅速吸收NO3--N(17.37mmol/(g×d)),胞内NO3--N的含量迅速上升,最大浓度达到7.36μmol/g(图5),培养后期胞内NO3--N浓度迅速降低,一直维持在较低的水平,其平均浓度为0.56μmol/g.
积累在液泡中的NO3--N有其重要的生理意义,在营养充足的情况下,细胞过量(超过还原能力)吸收NO3--N是为了保证介质在NO3--N供应下降时,液泡中的NO3--N进入细胞中,维持细胞的生长需要. NO3--N除了作为合成蛋白质的氮源外,在液胞内还是重要的渗透物质,尤其在弱光条件下,细胞内碳水化合物合成减少,液胞内有机物含量下降,NO3--N可以替代其渗透调节作用,而且需要的能量也低[33].这就决定了植物在生长过程中势必要积累一定的NO3--N.
NO3--N的还原作用是在细胞质中进行的,形成的HNO2以分子态透过质膜.NO2--N在叶绿体或前质体内被还原,并形成NH4+-N.由于这2种酶的连续作用,所以植物体内没有明显的NO2--N积累[15].在本研究中同样发现浒苔藻体细胞内NO2--N的浓度一直维持在较低水平(0.45μmol/g).
浒苔吸收水体中NO3--N后,一部分进入液泡,另一部分在NR/NiR的催化下生成NH4+-N,之后NH4+-N进行同化作用,转化为DON,用于藻体的生长(图11).水生植物的分解过程中,会有大量的营养物质释放到水体中[34-36].结合培养液和胞内无机氮的变化(图3、图5)发现,浒苔在营养充足的条件下,迅速吸收NO3--N储存在细胞内,并将一部分转化为NH4+-N,使胞内DIN浓度升高;随后藻体衰亡过程中,浒苔藻体又向水体中释放NH4+-N,导致培养液中的DIN浓度上升(21.87μmol/L).刘湘庆等[13]也发现培养浒苔向水体中大量释放NH4+-N (27.24μmol/L),使得总无机氮浓度迅速升高.

图11 细胞内外氮素的迁移转化
NR:硝酸还原酶;NiR:亚硝酸还原酶
整体来看,浒苔在营养充足的情况下会迅速吸收水体中的NO3--N,待水体处于营养不充足的条件下,浒苔开始逐渐进入衰亡期,衰亡的浒苔会向培养液中释放NH4+-N.浒苔在生长阶段,吸收大量的NO3--N,最大吸收速率为25.39μmol/g/d,同时吸收NH4+-N,最大吸收速率为8.07μmol/g/d,衰亡期向培养液中释放大量的NH4+-N(图3),释放速率0.84μmol/(g·d).在整个培养阶段浒苔对培养液中NO3--N和NH4+-N的平均吸收速率为7.19μmol/(g·d)和1.76μmol/(g·d).浒苔胞内NO3--N和NH4+-N的平均生成速率分别为6.84,2.16μmol/(g·d).根据胞内NH4+-N的生长速率和培养液中NH4+-N的消耗速率估算浒苔藻细胞将NO3--N转化为NH4+-N的速率为0.40μmol/(g·d).
3.2 浒苔胞内、外之间有机氮的迁移、转化过程
大型藻类在水体的氮循环过程中起着重要的作用,之前的研究都表明大型藻类在吸收DIN后,经过同化作用转化为NH4+-N和DON,释放到水体中[37].Fong等[26]发现在吸收DIN的同时也向水体中释放DON,而且DON的释放受到吸收的DIN的影响.Tyler等[37]发现在在生长旺盛时期是水中DON的一个来源.大型海藻吸收DIN并转化为DON有助于水体中氮的循环,此外还可以为水体中的浮游生物提供营养物质.
浮游植物释放到水体中的有机物是细胞膜渗漏和主动渗出相互平衡的结果[38].正常生长的藻细胞也会向水体中释放有机物[39-40].Veldhuis等[41]发现藻细胞的自催化死亡也是水体中有机物的一个重要来源,许多研究表明营养盐限制会对细胞的质膜受损和自催化死亡产生影响[42-44],从而引起水体中有机物的变化.生长期营养物质充足,藻细胞繁殖,储存的能量物质较少,而在衰亡的过程中会向水体释放大量的有机氮,但其体内的大部分氮仍然保存在组织中,表现为有机氮组分的增加,而衰亡后期营养物质严重缺乏,胞内能源物质被藻细胞消耗,DON浓度下降.
分析本研究胞内、胞外(即培养液)DON含量变化可知,浒苔在整个培养过程中,向培养液中释放大量的DON(图4),最大释放速率分别为104.39μmol/(g·d).在整个培养阶段浒苔向培养液中释放DON的平均速率分别为59.57μmol/(g·d).浒苔胞内DON的生成速率为74.86μmol/(g·d).在浒苔的生长阶段,培养液中DON的浓度呈现上升的趋势,这主要是由于其自身代谢产生的一部分DON被释放到水体中[39-40];在受到无机氮限制的条件下, DON的浓度上升速度依然缓慢,这可能是由于营养盐限制造成藻细胞的自催化死亡,造成培养液中DON浓度的升高[42-44];进入衰亡后期 DON 浓度上升速度明显加快.Zhang等[27]也发现在培养的过程中浒苔会释放出大量的有机物,这个快速释放有机物的过程主要是由浒苔藻细胞的水解和分解过程产生的.
在整个培养过程中DON各组分所占百分比会有所变化,小分子有机物所占的比重在减小,大分子的物质所占的比重增加.之前许多研究表明盐沼植物有机物的浸出和分解分为3个过程[45-48]:第一个过程是可溶性有机物的浸出;第二个过程是微生物降解过程释放出的生物高分子和可溶性有机物;第三个过程通常耗费很长的时间(年),纤维素、木质素和其他难降解的有机物的储存过程.由于浒苔是一种大型海藻,不含木质素,因此实验过程中DON的释放主要是由前两个过程引起的[27],第一个过程释放小分子物质,第二个过程释放高分子物质,因而造成在浒苔衰亡后期大分子物质所占比例升高.Lee等[49]发现藻的死细胞会释放更多的高分子量有机物(>1kDa),而活细胞释放较多的低分子量有机物(<1kDa).
在本研究整个培养周期中,<1kDa组分由开始所占DON比例的86%先升高至93%后降低至培养结束时的80%,>1kDa组分由开始所占DON比例的14%先降低至2%后降低至培养结束时的20%.衰亡期的浒苔培养液中小分子有机物所占的比重在减小,大分子的物质所占的比重增加.本研究切向超滤结果证实了浒苔在生长周期的不同阶段分泌的DON不同分子量组分比重显著不同,在培养初期(活细胞)浸出小分子可溶有机物多(<1kDa),而衰亡期细胞释放出更多的高分子(>1kDa)有机物.
3.3 浒苔细胞氮收支模型
我国黄海海域发生绿潮时,浒苔的规模达到百万t以上[50-52].本研究在室内实验中,模拟了浒苔在爆发衰亡过程中,对海水中氮素的吸收、转化和释放的过程,最后对氮素的吸收总量、转化量以及释放量进行估算.根据浒苔生长期水体中的DIN消耗量和DON的生成量估算浒苔对无机氮的转化效率,浒苔在生长期总消耗DIN量为342.12μmol,DON的生成量为322.70μmol,估算浒苔将无机态氮转化为有机态氮的转化效率为94.32%.
根据培养结束时水体中DIN和DON分别占初始添加NO3--N的7.29%(NH4+-N占DIN的94.71%)和59.96%,其中DON中各分子量范围<1kDa、10kDa~1kD和>10kDa的组分所占比例为38.22%、13.28%和8.46%,剩余32.75%的氮留存在藻体细胞内,如图12所示.浒苔衰亡到第30d时水体中DIN和DON的含量为36.5,285.21μmol/kg,其中<1kDa、10kDa~1kD和>10kDa的组分含量分别为181.98, 63.23,40.31μmol/kg.若一次浒苔绿潮按100万t湿重藻体计算,在浒苔衰亡过程中,在第30d时就会向水体中释放DIN和DON含量分别为511t,3993t,其中向水体中释放的<1kDa、10kDa~1kD和>10kDa的组分含量2547.77t,885.18t,564.28t.刘湘庆等[13]估算在第12d时,浒苔向水体中释放DIN的量为387.18t,其结果与本文中的数值相差不大.丁月旻[50]根据浒苔体内的氮素百分含量2.9%(干重),估算浒苔体内固定的氮素含量结果显示:绿潮爆发过程中每100万t的浒苔就会吸收约5625t的氮,与本研究数值上的差异可能是由于浒苔并未完全降解并且藻体中的氮含量没有计算在内.随着绿潮的消亡和浒苔的分解,浒苔自身的有机形态的生源物质在海水中被转化为无机形态再次被吸收利用.
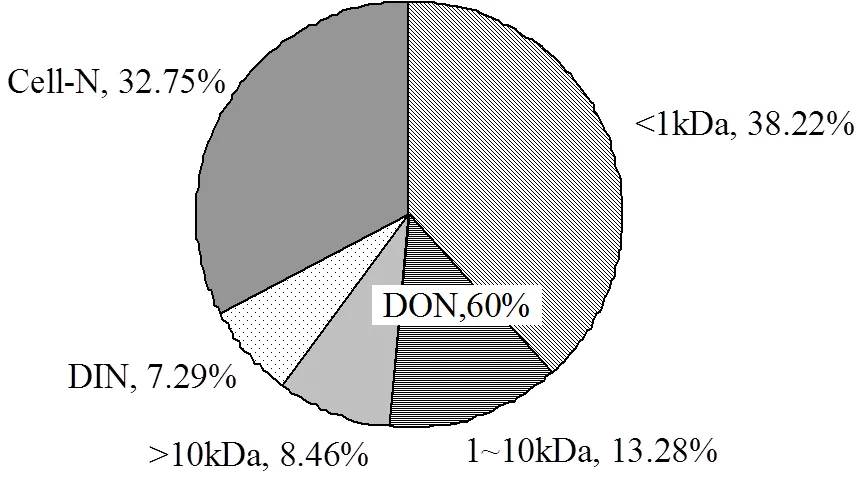
图12 培养结束时培养液中各形态氮占总添加NO3--N百分比
整个饼型框架为总添加的NO3--N
4 结论
4.1 浒苔生长-衰亡过程中,胞内无机氮在生长期以NO3--N为主(73.75%~92.15%),衰亡期由NH4+-N主导(60.87%~92.13%);无机氮在培养期向胞内迁移速率为8.96μmol/(g·d),衰亡期时向培养液释放NH4+-N速率为0.84μmol/(g·d).
4.2 在整个生长周期中,培养液中溶解有机氮(DON)呈上升趋势,其中<1kDa组分占64%~98%, >1kDa组分占2%~36%.胞内向胞外DON平均迁移速率约为23.21μmol/(g·d).
4.3 近海浒苔爆发-衰亡可以在月际尺度上以较高效率将近海DIN转化为以<1kDa组分占优的DON并向水体中释放,转化比例达60%,其中可以将吸收无机氮的38%转化为<1kDa组分,可对近海生源要素结构产生显著影响.
[1] 林雨霏,杨 阳,王国善,等.浒苔绿潮灾害损失调查与评估方法构建[J]. 海洋环境科学, 2018,37(3):452-456 Lin Y F, Yang Y, Wang G S, et al. Establishment of the losses investigation and assessment method of green tide () disaster [J]. Marine Environmental Science, 2018,37(3):452-456.
[2] 国家海洋局.《2009年中国海洋灾害公报》[J]. 海洋开发与管理, 2010,27(2):70. State Oceanic Administration. 2009 China marine disaster bulletin [J]. Ocean Development and Management, 2010,27(2):70.
[3] Liu D, Keesing J K, He P, et al. The world's largest macroalgal bloom in the Yellow Sea, China: formation and implications [J]. Estuarine, Coastal and Shelf Science, 2013,129:2-10.
[4] Wang C, Yu R C, Zhou M J. Effects of the decomposing green macroalga Ulva (Enteromorpha) prolifera on the growth of four red-tide species [J]. Harmful Algae, 2012,16:12-19.
[5] 王 婷,石晓勇,张传松,等.2008年黄海浒苔绿潮爆发区营养盐浓度变化及分布特征[J]. 海洋通报(中文版), 2011,30(5):578-582. Wang T, Shi X Y, Zhang C S, et al.Variations in nutrient concentration and distribution for green tide ofoccurrence areas of the Yellow Sea in 2008 [J].Marine Science Bulletin (Chinese version), 2011,30(5):578-582.
[6] 高 嵩,范士亮,韩秀荣,等.浒苔绿潮与南黄海近岸海域水质的关系[J]. 中国环境科学, 2014,34(1):213-218. Gao S, Fan S L, Han X R, et al.Relations ofblooms with temperature, salinity, dissolved oxygen and pH in the Southern Yellow Sea [J]. China Environmental Science, 2014,34(1): 213-218.
[7] 李瑞香,吴晓文,韦钦胜,等.不同营养盐条件下浒苔的生长[J]. 海洋科学进展, 2009,27(2):211-216. Li R X, Wu X W, Wei Q S, et al.Growth ofunder different uutrient conditions [J]. Advances in Marine Science, 2009,27(2):211-216.
[8] Li H, Zhang Y, Han X, et al. Growth responses of Ulva prolifera to inorganic and organic nutrients: Implications for macroalgal blooms in the southern Yellow Sea, China [J]. Scientific reports, 2016,6:26498.
[9] 吴晓文,李瑞香,徐宗军,等.营养盐对浒苔生长影响的围隔生态实验[J]. 海洋科学进展, 2010,28(4):538-544. Wu X W, Li R X, Xu Z J, et al. Mesocosm experiments of nutrient effects on enteromorpha prolifera growth [J]. Advances in Marine Science, 2010,28(4):538-544.
[10] 吴 婷,赵乐毅,刘浩涤,等.浒苔对营养盐影响的初步研究[J]. 海洋环境科学, 2013,32(3):347-352. Wu T, Zhao LY, Liu H D, et al. Preliminary study on the influence ofon nutrients [J]. Marine Environmental Science, 2013,32(3):347-352.
[11] 史华明.浒苔对氮磷吸收和释放及与中肋骨条藻竞争关系的初步研究[D]. 青岛:中国海洋大学, 2009. Shi H M. The preliminary study ofabsorption and release properties of nitrogen and phosphorus and the competition with Skeletonema costatum [D]. Qing Dao: Ocean University of China, 2009.
[12] Guidone M, Thornber C S. Examination of Ulva bloom species richness and relative abundance reveals two cryptically co-occurring bloom species in Narragansett Bay, Rhode Island [J]. Harmful Algae, 2013,24:1-9.
[13] 刘湘庆,王宗灵,辛 明,等.浒苔衰亡过程中营养盐的释放过程及规律[J]. 海洋环境科学, 2016,35(6):801-805+813. Liu X Q, Wang Z L, Xin M, et al. Study on process of nutrient release during the decay of[J]. Marine Environmental Science, 2016,35(6):801-805+813.
[14] 李鸿妹.营养盐与黄海浒苔绿潮暴发关系的探究[D]. 青岛:中国海洋大学, 2015. Li H M.Study on the relationship between nutrient salt and yellow sea margin green tide [D]. Qingdao: Ocean University of China,2015.
[15] 李俭平.浒苔对氮营养盐的响应及其氮营养盐吸收动力学和生理生态研究[D]. 青岛:中国科学院研究生院(海洋研究所), 2011. Li J P. The response to nitrogen nutrient, and the uptake kinetics mechanism of nitrogen and ecophysiological analysis of[D]. Qingdao:Graduate school of Chinese academy of sciences (institute of oceanography), 2011.
[16] 高 嵩,石晓勇,王 婷.浒苔绿潮与苏北近岸海域营养盐浓度的关系研究[J]. 环境科学, 2012,33(7):2204-2209. Gao S, Shi X Y, Wang T. Variation of nutrient concentrations at the inshore coastal area of northern Jiangsu Province and the occurrence of Green Tide caused by[J]. Environmental Science, 2012,33(7):2204-2209.
[17] Shi X, Qi M, Tang H, et al. Spatial and temporal nutrient variations in the Yellow Sea and their effects on Ulva prolifera blooms [J]. Estuarine, Coastal and Shelf Science, 2015,163:36-43.
[18] 叶 静,张 喆,李富超,等.大型绿藻浒苔转化表达系统选择标记的筛选[J]. 生物技术通报, 2006,3:63-67. Ye J, Zhang J, Li F C, et al. Screening of selectable marker for transformation and expression system of green seaweed[J]. Biotechnology Bulletin, 2006,3:63-67.
[19] Zhu M, Liu Z, Shao H, et al. Effects of nitrogen and phosphate enrichment on the activity of nitrate reductase of Ulva prolifera in coastal zone [J]. Acta Physiologiae Plantarum, 2016,38(7):169.
[20] Guillard R R L, Ryther J H. Studies of marine planktonic diatoms: I. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) Gran [J]. Canadian journal of microbiology, 1962,8(2):229-239.
[21] Liu S M, Zhang J, Chen H T, et al. Factors influencing nutrient dynamics in the eutrophic Jiaozhou Bay, North China [J]. Progress in Oceanography, 2005,66(1):66-85.
[22] Xu Z, Liu S, Xiang R, et al. Live benthic foraminifera in the Yellow Sea and the East China Sea: vertical distribution, nitrate storage, and potential denitrification [J]. Marine Ecology Progress Series, 2017, 571:65-81.
[23] Corzo A, Niell F X. Inorganic nitrogen metabolism inUlva rigida illuminated with blue light [J]. Marine Biology, 1992,112(2):223-228.
[24] Benner R, Pakulski J D, McCarthy M, et al. Bulk chemical characteristics of dissolved organic matter in the ocean [J]. Science, 1992,255(5051):1561-1564.
[25] Martin J M, Dai M H, Cauwet G. Significance of colloids in the biogeochemical cycling of organic carbon and trace metals in the Venice Lagoon (Italy) [J]. Limnology and Oceanography, 1995,40(1): 119-131.
[26] Fong P, Fong J J, Fong C R. Growth, nutrient storage, and release of dissolved organic nitrogen by Enteromorpha intestinalis in response to pulses of nitrogen and phosphorus [J]. Aquatic Botany, 2004,78(1): 83-95.
[27] Zhang T, Wang X. Release and microbial degradation of dissolved organic matter (DOM) from the macroalgae Ulva prolifera [J]. Marine pollution bulletin, 2017,125(1/2):192-198.
[28] Lin H, Jiang P, Zhang J, et al. Genetic and marine cyclonic eddy analyses on the largest macroalgal bloom in the world [J]. Environmental science & technology, 2011,45(14):5996-6002.
[29] Wang Z, Xiao J, Fan S, et al. Who made the world's largest green tide in China?—an integrated study on the initiation and early development of the green tide in Yellow Sea [J]. Limnology and Oceanography, 2015,60(4):1105-1117.
[30] Li H, Zhang Y, Tang H, et al. Spatiotemporal variations of inorganic nutrients along the Jiangsu coast, China, and the occurrence of macroalgal blooms (green tides) in the southern Yellow Sea [J]. Harmful algae, 2017,63:164-172.
[31] Solomonson L P, Barber M J. Assimilatory nitrate reductase: functional properties and regulation [J]. Annual review of plant biology, 1990,41(1):225-253.
[32] Suzuki A, Gadal P. Glutamate synthase from rice leaves [J]. Plant Physiology, 1982,69(4):848-852.
[33] Koch G W, Schulze E D, Percival F, et al. The nitrogen balance of Raphanus sativus x raphanistrum plants. II. Growth, nitrogen redistribution and photosynthesis under NO3−deprivation [J]. Plant, Cell & Environment, 1988,11(8):755-767.
[34] Chimney M J, Pietro K C. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA) [J]. ecological engineering, 2006,27(4):301-321.
[35] Vaquer-Sunyer R, Conley D J, Muthusamy S, et al. Dissolved organic nitrogen inputs from wastewater treatment plant effluents increase responses of planktonic metabolic rates to warming [J]. Environmental science & technology, 2015,49(19):11411-11420.
[36] 李文朝,陈开宁,吴庆龙,等.东太湖水生植物生物质腐烂分解实验[J]. 湖泊科学, 2001,(4):331-336. Li W C, Chen K N, Wu Q L, et al. Expeimental studies on decomposition process of aquatic plant material from East Taihu Lake [J]. Journal of Lake Scicences, 2001,(4):331-336.
[37] Tyler A C, McGlathery K J, Anderson I C. Macroalgae mediation of dissolved organic nitrogen fluxes in a temperate coastal lagoon [J]. Estuarine, Coastal and Shelf Science, 2001,53(2):155-168.
[38] Thornton D C O. Dissolved organic matter (DOM) release by phytoplankton in the contemporary and future ocean [J]. European Journal of Phycology, 2014,49(1):20-46.
[39] Sharp J H. Excretion of organic matter by marine phytoplankton: Do healthy cells do it? [J]. Limnology and Oceanography, 1977,22(3): 381-399.
[40] Nagata T. Production mechanisms of dissolved organic matter [M]. New York, Microbial ecology of the oceans, 2000:121-152.
[41] Veldhuis M J W, Kraay G W, Timmermans K R. Cell death in phytoplankton: correlation between changes in membrane permeability, photosynthetic activity, pigmentation and growth [J]. European Journal of Phycology, 2001,36(2):167-177.
[42] BermanF I, Rosenberg G, Levitan O, et al. Coupling between autocatalytic cell death and transparent exopolymeric particle production in the marine cyanobacterium Trichodesmium [J]. Environmental microbiology, 2007,9(6):1415-1422.
[43] Timmermans K R, Veldhuis M J W, Brussaard C P D. Cell death in three marine diatom species in response to different irradiance levels, silicate, or iron concentrations [J]. Aquatic microbial ecology, 2007, 46(3):253-261.
[44] Franklin D J, Airs R L, Fernandes M, et al. Identification of senescence and death in Emiliania huxleyi and Thalassiosira pseudonana: Cell staining, chlorophyll alterations, and dimethylsulfoniopropionate (DMSP) metabolism [J]. Limnology and Oceanography, 2012,57(1):305-317.
[45] Lee C, Howarth R W, Howes B L. Sterols in decomposing Spartina alterniflora and the use of ergosterol in estimating the contribution of fungi to detrital nitrogen 1 [J]. Limnology and Oceanography, 1980, 25(2):290-303.
[46] Valiela I, Teal J M, Allen S D, et al. Decomposition in salt marsh ecosystems: the phases and major factors affecting disappearance of above-ground organic matter [J]. Journal of Experimental Marine Biology and Ecology, 1985,89(1):29-54.
[47] Hicks R E, Lee C, Marinucci A C. Loss and recycling of amino acids and protein from smooth cordgrass (Spartina alterniflora) litter [J]. Estuaries, 1991,14(4):430-439.
[48] White D S, Howes B L. Long-term15N-nitrogen retention in the vegetated sediments of a New England salt marsh [J]. Limnology and Oceanography, 1994,39(8):1878-1892.
[49] Lee D Y, Rhee G Y. Kinetics of cell death in the cyanobacterium anabaena flos-aquae and the production of dissolved organic carbon [J]. Journal of Phycology, 1997,33(6):991-998.
[50] 丁月旻.黄海浒苔绿潮中生源要素的迁移转化及对生态环境的影响[D]. 青岛:中国科学院研究生院(海洋研究所), 2014. Ding Y M. Impacts of()in the green tide on the Yellow Sea ecological environmen-implications from migration and tranformation of biogenic elements [D]. Qingdao:Graduate school of Chinese Academy of Sciences (Institute of Oceanography), 2015.
[51] Zhou Y, Tan L, Pang Q, et al. Influence of nutrients pollution on the growth and organic matter output of Ulva prolifera in the southern Yellow Sea, China [J]. Marine Pollution bulletin, 2015,95(1):107-114.
[52] Liu X, Li Y, Wang Z, et al. Cruise observation of Ulva prolifera bloom in the southern Yellow Sea, China [J]. Estuarine, Coastal and Shelf Science, 2015,163:17-22.
Transformation and migration of nitrogen forms during the growth-decay of.
ZHAGN Peng-yan1,2, YAN Zhen-wei1, ZHONG Xiao-song1, JIN Yue-mei2, YAN Mao-jun1, YU Ji-kai1, XIN Yu1*, LIU Tao2**
(1.College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China;2.College of Marine Life Sciences, Ocean University of China,Qingdao 266005, China)., 2019,39(5):1967~1976
To investigate the mechanism of nitrogen uptake and metabolism in, the distribution and migration of different forms of nitrogen in culture media and algea cells during the growth-decay process was studied with continuous culture experiments.absorbed NO3--N (17.37μmol/(g·d)) into the cell during the growth phase while released NH4+-N (0.84μmol/(g·d)) to the extracellular during the decay phase. In algae cell, up to 73.75%~92.15% of dissolved inorganic nitrogen (DIN) was NO3--N during the growth phase, while 60.87%~92.13% was NH4+-N during the decay period. The concentration of dissolved organic nitrogen (DON) in the culture media increased continually during the culture period, with < 1kDa component accounting for 64%~98% and > 1kDa component accounting for 2%~36%. The average migration rate of DIN was about 8.96μmol/(g·d), and the average release rate of DON was about 59.57μmol/(g·d). Nearly 60% DIN was converted into DON and secreted extracellularly, most of which was < 1kDa component. It can be speculated that the outburst ofimpacts the structure of biological elements significantly on the monthly scale.
;nitrogen forms;tangential flow ultrafiltration
X142
A
1000-6923(2019)05-1967-10
张鹏燕(1989-),女,山东青岛人,中国海洋大学海洋生命学院博士,主要从事浮游植物氮循环的研究.发表论文2篇.
2018-10-08
国家自然科学基金资助面上项目(41576082);青岛海洋科学与技术国家实验室“鳌山人才”计划项目(2015ASTP-OS08);国家重点研发计划项目(2016YFC1402101);中央高校基本科研业务费专项(201762032)
*责任作者, 讲师, xinyu312@ouc.edu.cn;**教授, liutao@ouc.edu.cn
