伊维菌素吡喹酮咀嚼片含量测定方法的建立
2019-06-06韩宁宁赵富华戴青赵晖杨秀玉于晓辉
韩宁宁,赵富华,戴青,赵晖,杨秀玉,于晓辉
(中国兽医药品监察所,北京 100081)
伊维菌素吡喹酮咀嚼片是“十二五”国家科技支撑计划项目研制的新制剂,由伊维菌素、吡喹酮和赋形剂制成的咀嚼片,用于宠物犬体内外寄生虫的治疗。伊维菌素是大环内酯类体内外驱虫药[1],对丝虫、钩虫、圆虫、鞭虫、蛔虫等均有效果;吡喹酮[2]对动物体内线虫、吸虫、绦虫有效。通过两种药物组合,扩大驱虫谱,可提高一次性驱虫效果。为保证该制剂的质量可控,安全有效,需建立相应含量测定方法。本文创建了同时测定伊维菌素与吡喹酮的高效液相含量测定方法,并根据《兽药质量标准分析方法验证指导原则》[3]的要求,对上述方法进行了验证。
1 仪器与试剂
1.1 仪器与设备 高效液相色谱仪(HPLC)(Waters e2695色谱系统,Empower 3色谱工作站);二极管阵列检测器(PDA)(Waters 2998);XS205分析天平(Mettler Toledo)。
1.2 药品与试剂 对照品名称/来源/批号/含量:伊维菌素/中国兽医药品监察所/K0191406/91.0%;吡喹酮/中国食品药品检定研究院/100046-201205/99.7%。3批伊维菌素吡喹酮咀嚼片规格/生产企业/批号:伊维菌素2 mg与吡喹酮50 mg/东方澳龙制药有限公司/20170501、20170502、20170503。乙腈(MERCK公司色谱纯试剂)。其余试剂均为分析纯。
2 方 法
2.1 方法的建立过程
2.1.1 液相色谱条件的建立 采用《中国兽药典》吡喹酮含量测定液相色谱条件(乙腈∶水60∶40),采集吡喹酮与伊维菌素混合对照品色谱图,发现该条件下吡喹酮出峰时间为6 min,伊维菌素出峰时间为120 min。如采用该色谱条件仅进行吡喹酮含量测定,伊维菌素会对多批次测定的后续样品的吡喹酮含量测定产生干扰。
为排除伊维菌素对吡喹酮测定的干扰,保证测定结果的准确性,需将伊维菌素与吡喹酮的液相色谱条件合并。合并后的色谱条件需使伊维菌素与吡喹酮在20 min内均出峰,溶剂及辅料对主成分测定需均无干扰,且相应分离度及塔板数均应符合药典要求。
2.1.2 提取溶剂的选择 分别用甲醇及60%乙腈溶液配制0.2 mg/mL的伊维菌素对照品溶液和5.0 mg/mL的吡喹酮对照品溶液(上述浓度与供试品拟采用的配制浓度一致)。考察对照品是否能完全溶解,根据测定结果选择合适的溶剂。
2.1.3 提取时间的选择 取片剂适量,研磨后精密称定,置锥形瓶中,精密加入10 mL甲醇,平行制备4份。各自分别超声0、2、5、10 min,配制相当于伊维菌素0.2 mg/mL的供试品溶液,测定含量,考察提取时间。根据测定结果选择合适的提取时间。
2.1.4 溶液浓度的选择 《中国兽药典》中伊维菌素进样浓度为0.2 mg/mL,吡喹酮为0.05 mg/mL。照上述方法配制相当于伊维菌素0.2 mg/mL的溶液及相当于吡喹酮0.05 mg/mL的溶液,考察测定含量与标示含量的差异。通过测定回收率,进一步确定配制方法准确度是否符合要求。
2.1.5 检测波长的选择 《中国兽药典》中伊维菌素检测波长为254 nm,USP中伊维菌素检测波长为245 nm。《中国兽药典》及USP中吡喹酮检测波长均为210 nm。通过PDA检测器采集伊维菌素及吡喹酮光谱图,考察伊维菌素与吡喹酮最大吸收波长,并结合各药典方法,确定合适的检测波长。
2.2 最终建立的含量测定方法 色谱条件与系统适用性试验。用十八烷基硅烷键合硅胶为填充剂;以水为流动相A,以乙腈为流动相B,照表1进行梯度洗脱,伊维菌素检测波长为245 nm,吡喹酮检测波长为210 nm。理论塔板数按吡喹酮峰和伊维菌素H2B1a峰计算,均应不低于3000,伊维菌素H2B1a与H2B1b峰的分离度应不小于3.0,吡喹酮峰与相邻峰的分离度应不小于1.5。
测定法。取本品20片,精密称定,计算平均片重。研细,取约0.8 g,精密称定,置锥形瓶中,精密加入甲醇10 mL,超声5 min,静置至室温,取上清液过滤,作为伊维菌素供试品溶液;精密量取上述溶液1 mL,置100 mL量瓶中,用甲醇稀释至刻度,摇匀,作为吡喹酮供试品溶液。取伊维菌素和吡喹酮对照品适量,用甲醇分别配制为每1 mL中约含0.2 mg和0.05 mg的溶液,作为对照品溶液,同法测定。精密量取上述对照品溶液和供试品溶液各20 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积计算,即得。

表1 含量测定梯度洗脱条件Tab 1 Gradient elution condition for content determination
2.3 方法学验证
2.3.1 专属性 采集提取溶剂、辅料、对照品及供试品溶液色谱图,考察提取溶剂及辅料在伊维菌素及吡喹酮出峰时间有无干扰。
2.3.2 检测限与定量限 配制不同浓度伊维菌素及吡喹酮对照品溶液测定相应信噪比,以信噪比约为3∶1时的浓度为检测限,信噪比约为10∶1时的浓度为定量限。
2.3.3 线性和范围 分别配制浓度为2、4、10、20、40、80、200、400 μg/mL的伊维菌素对照品溶液,及浓度为1、2、5、10、20、50、100 μg/mL的吡喹酮对照品溶液,采集色谱图,以峰面积与对照品浓度作图,用最小二乘法进行线性回归。考察在上述两个浓度范围内,伊维菌素及吡喹酮峰面积与浓度是否线性关系良好。
2.3.4 准确度 取空白辅料0.75 g,精密加入伊维菌素对照品2 mg及吡喹酮对照品50 mg,置锥形瓶中,精密加入甲醇10 mL,超声5 min,静置至室温,取上清液滤过,精密量取滤液20 μL注入液相色谱仪,采集245 nm色谱图。精密量取续滤液1 mL,置100 mL量瓶中,用甲醇稀释至刻度,摇匀,精密量取上述溶液20 μL注入液相色谱仪,采集210 nm色谱图。平行配制6份上述100%浓度水平的供试品溶液,分别测定伊维菌素及吡喹酮回收率。
2.3.5 精密度(中间精密度) 两位检验员各测定该批片剂的3份平行样品,伊维菌素相对平均偏差应小于6%,吡喹酮相对平均偏差应小于4%。
2.3.6 溶液稳定性 考察伊维菌素及吡喹酮对照品溶液室温放置24 h内不同时间点伊维菌素及吡喹酮主峰面积的变化以评价溶液稳定性。
2.3.7 耐用性 考察不同柱温(25、30、35 ℃)、流速(0.8、1.0、1.2 mL/min)、不同品牌色谱柱对耐用性的影响。
3 结果与分析
3.1 方法的建立过程
3.1.1 液相色谱条件的建立 采用整合后的色谱系统(表1),使吡喹酮在乙腈∶水(60∶40)的梯度范围(0~6 min)内出峰,伊维菌素在乙腈∶水(100∶0)的梯度范围(6.01~17 min)内出峰,溶剂及辅料对主成分测定均无干扰,且相应分离度及塔板数均符合药典要求(图3~图10)。
3.1.2 提取溶剂的选择 甲醇或60%乙腈两种溶剂均可使两种对照品完全溶解。考虑到甲醇作为溶剂无需配制,更为简单方便,选取甲醇作为提取溶剂。
3.1.3 提取时间的选择 根据表2结果,超声5 min后,测定结果不再升高,提示主成分已全部溶解。因此,确定提取方式为:以甲醇作为溶剂,超声5 min。

表2 提取时间的选择Tab 2 Selection of extraction time
3.1.4 溶液浓度的选择 照2.1.4所示浓度配制供试品溶液,三批供试品测定含量均在标示含量的100%左右,结果见表3。回收率结果见3.2.4项,伊维菌素与吡喹酮回收率均符合要求。提示伊维菌素进样浓度为0.2 mg/mL,吡喹酮进样浓度为0.05 mg/mL为合理的溶液浓度。
3.1.5 检测波长的选择 通过PDA检测器采集伊维菌素及吡喹酮光谱图,发现伊维菌素最大吸收波长为244.2 nm,吡喹酮在200~230 nm之间无明显波峰,但吸收由高至低下降(图1~图2)。故采用245 nm作为伊维菌素的检测波长,210 nm作为吡喹酮的检测波长。
表3 三批供试品含量测定结果Tab 3 Determination results of three batches of samples

图1 伊维菌素H2B1a PDA光谱图Fig 1 PDA spectrum of Ivermectin H2B1a
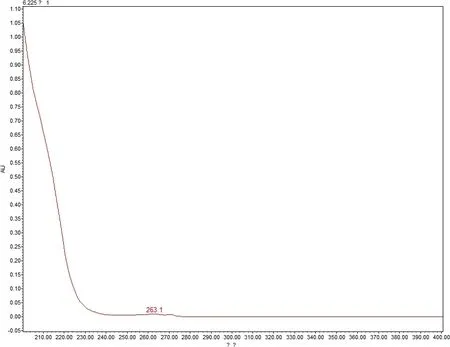
图2 吡喹酮PDA光谱图Fig 2 PDA spectrum of praziquantel
3.2 方法学验证
3.2.1 专属性 提取溶剂及辅料在伊维菌素及吡喹酮出峰时间均无干扰(图3~图10)。
3.2.2 检测限与定量限 该方法伊维菌素H2B1a检测限为0.4 μg/mL,定量限为1.2 μg/mL。吡喹酮检测限为0.5 μg/mL,定量限为1.0 μg/mL。

图3 甲醇在210nm下色谱图Fig 3 Chromatogram of methanol at 210 nm
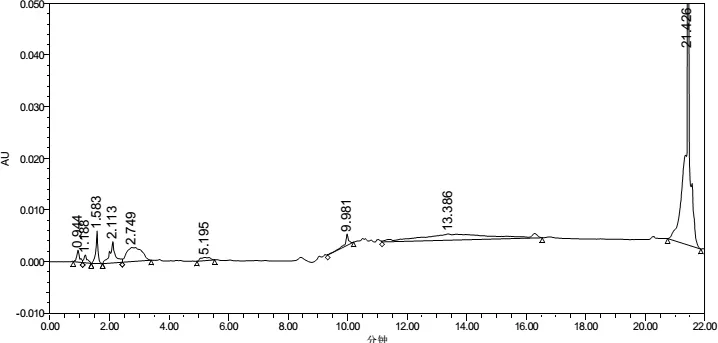
图4 辅料在210nm下色谱图Fig 4 Chromatogram of excipients at 210 nm

图5 吡喹酮对照品在210nm下色谱图Fig 5 Chromatogram of praziquantel reference at 210 nm

图6 供试品在210nm下色谱图Fig 6 Chromatogram of the sample at 210 nm
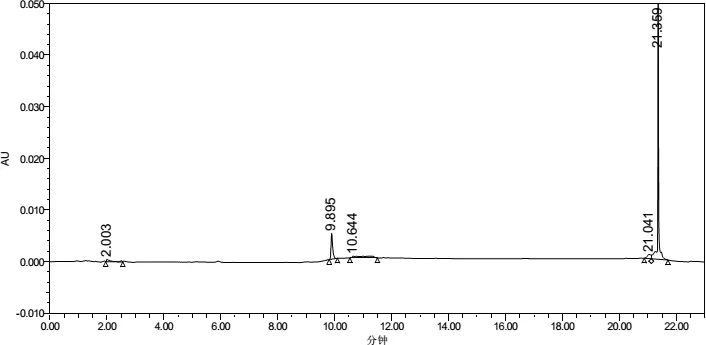
图7 甲醇在245nm下色谱图Fig 7 Chromatogram of methanol at 245 nm

图8 辅料在245nm 下色谱图Fig 8 Chromatogram of excipients at 245 nm
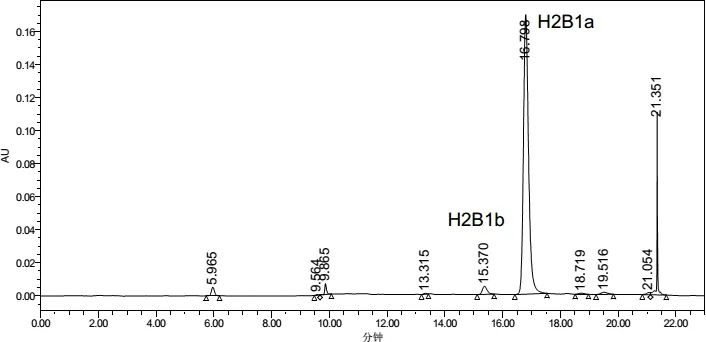
图9 伊维菌素对照品在245nm下色谱图Fig 9 Chromatographic Chart of Ivermectin Reference at 245 nm

图10 供试品在245nm下色谱图Fig 10 Chromatogram of the sample at 245 nm
3.2.3 线性和范围 伊维菌素峰面积与浓度线性方程为:y=41323x-95474,r=0.9999;吡喹酮峰面积与浓度线性方程为:y=95361x-27338,r=0.9999。表明伊维菌在2~400 μg/mL的浓度范围内,吡喹酮在1~100 μg/mL的浓度范围内,峰面积与浓度线性关系良好。
3.2.4 准确度 处方回收率结果如表4所示。结果符合要求。
3.2.5 中间精密度 结果如表5~表6所示。结果符合要求。

表4 伊维菌素及吡喹酮回收率结果Tab 4 Result of recovery of ivermectin and praziquantel

表5 伊维菌素精密度测定结果Tab 5 Precision determination results of ivermectin

表6 吡喹酮精密度测定结果Tab 6 Precision determination results of praziquantel
3.2.6 溶液稳定性 结果如表7所示。伊维菌素对照品溶液在室温放置2 h内稳定,之后峰面积逐渐降低,但24 h内RSD仍仅为0.9%,基本稳定;吡喹酮对照品溶液在室温放置24 h稳定。
3.2.7 耐用性 结果如表8所示。在该表所述各个条件下,理论塔板数按H2B1a峰计算均不低于3000,伊维菌素H2B1a与H2B1b峰的分离度均不小于3.0,理论板数按吡喹酮峰计算均不低于3000。
4 讨论与结论
由于处方中伊维菌素与吡喹酮两种主药规格差异较大(2 mg与50 mg),如果为简化试验操作,采用相同的进样浓度,在伊维菌素与吡喹酮各自的最大吸收波长(245 nm与210 nm)附近提取色谱图,会导致伊维菌素峰面积过小,或者吡喹酮峰面积过载,二者均影响测定的准确性,因而本方法伊维菌素和吡喹酮采用了两种不同的供试品浓度进样。
但如果伊维菌素和吡喹酮均采用245 nm作为提取波长,采用未经第二步稀释的伊维菌素供试品溶液进样,同时测定伊维菌素和吡喹酮,二者峰面积均处于合适的范围(图11),且无需进一步稀释配制吡喹酮供试品溶液,简化了试验操作。采用该简化方法测定批号为20170502的供试品,结果与最终采用的方法相比,无显著差异(表9)。但考虑到245 nm恰好处于吡喹酮紫外光谱图的波谷位置,仪器对于浓度变化的灵敏度较低,易产生试验误差,因此,最终未采用该简化方法。
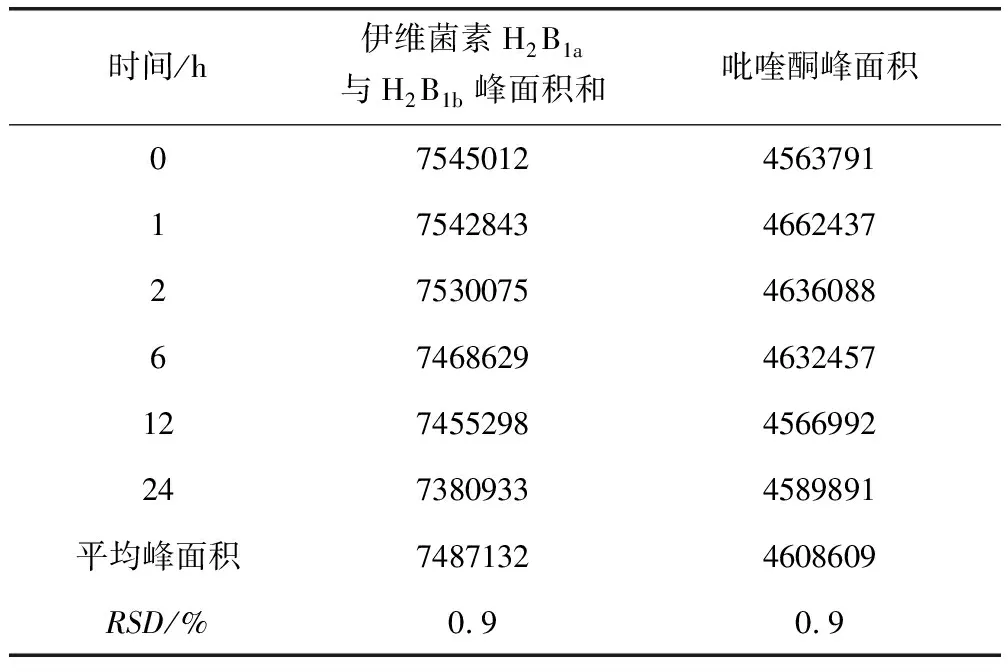
表7 伊维菌素及吡喹酮稳定性结果Tab 7 Stability results of ivermectin and praziquantel
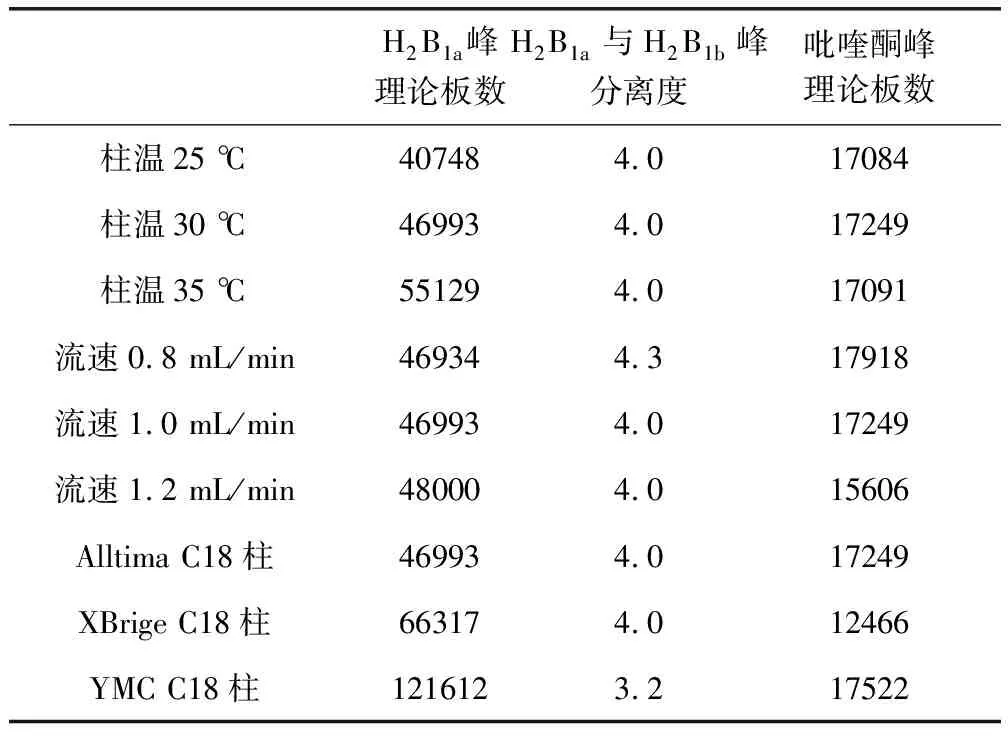
表8 耐用性结果Tab 8 Durability results

图11 245 nm下伊维菌素与吡喹酮色谱图Fig 11 Chromatogram of ivermectin and praziquantel at 245 nm

供试品含量1/%供试品含量2/%平均值/%简化方法98.7799.0298.9最终采用的方法98.2199.5698.9
