牛磺酸对脂多糖诱导小鼠急性肾损伤的保护作用及机制*
2019-06-04许明贤曹舒晴董伟任卉芳许厉风秦理璐钟祎
许明贤, 曹舒晴, 董伟, 任卉芳, 许厉风, 秦理璐, 钟祎
广州医科大学基础学院生理教研室(广东广州 511436)
革兰阴性细菌产生的脂多糖(lipopolysaccharides, LPS)是一种重要的致炎因子,可导致脓毒症甚至多器官功能障碍综合征[1],肾脏是首要的靶器官。急性肾损伤(acute kidney injury,AKI)是临床上的常见危重疾病,由LPS所导致的脓毒症是引起AKI的重要常见病因[2],脓毒症并发AKI时病情凶险,病死率高[3]。牛磺酸(Taurine, Tau)是一种β-氨基乙磺酸,在体内以游离状态存在,具有抗氧化、抗炎等多种生物学效应。国内外的大量研究显示牛磺酸对肝、脑、肾等器官损害具有保护作用[4-11]。2017年3月至2018年7月我们开展实验,研究牛磺酸对LPS诱导的小鼠AKI的保护作用,并从氧化应激、炎症反应两方面探讨其机制。
1 材料与方法
1.1 动物及试剂 SPF级KM雄性小鼠[体重(36±3)g,购于中山大学实验动物中心]。谷胱甘肽过氧化物酶(GSH-Px)测试盒,超氧化物歧化酶(SOD)试剂盒,丙二醛 (MDA)测试盒,肌酐(Cr)测试盒,血尿素氮(BUN)测试盒,尿蛋白定量测试盒均购于南京建成生物工程研究所。小鼠肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β) ELISA试剂盒购于武汉博士德生物工程有限公司。LPS(sigma)购于合肥博美生物科技有限责任公司。牛磺酸(纯度99%,食品级)购于湖北省潜江永安药业股份有限公司。
1.2 动物模型制备 30只KM小鼠随机分为3组(n=10):假手术组、模型组(LPS组)和治疗组(牛磺酸+LPS组);腹腔注射LPS(10 mg/kg)方法复制小鼠AKI模型[12-13],假手术组注射同样剂量生理盐水,治疗组于术前7 d开始用牛磺酸溶液(0.2 g/0.2 mL)灌胃, 1次/d, 持续8 d, 正常饲食。
1.3 血尿生化指标的检测 眼球取血,分离血清测定BUN、血肌酐(Scr)、MDA含量、SOD活性和GSH-Px。留取造模后24 h尿液,按照试剂盒说明书检测BUN、尿蛋白和尿肌酐(Ucr)的含量。
1.4 肾组织HE染色和细胞因子检测 取小鼠双侧肾脏,冰生理盐水洗去血液,用滤纸吸去表面水分,称重并计算小鼠肾脏系数(肾脏质量/小鼠体重)。随后取部分肾脏,加入冰生理盐水,冰上匀浆,低温离心并取上清液检测TNF-α和IL-1β的浓度,余下部分置于Bouin液防腐,用苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色切片,显微镜下观察肾组织损伤情况。
1.5 统计学方法 采用SPSS 17.0统计软件统计分析,不同实验组小鼠的肾功能生化指标、氧化应激指标和炎性因子表达的组间差异用单因素方差分析(one-way ANOVA),并用 Duncan 氏法进行多重比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 牛磺酸改善肾功能和肾组织受损 与假手术组比,模型组小鼠尿液和血清中BUN和Cr水平明显增加,尿蛋白含量增加,差异有统计学意义(P<0.05),出现肾功能下降。肾组织切片显示,模型组肾小管上皮细胞变性坏死,肾间质充血水肿并有炎细胞浸润,肾小球可见中性粒细胞浸润及纤维素渗出(图1-A、B),肾系数增加,肾组织出现实质性损伤。与模型组相比,牛磺酸治疗组能明显改善肾功能下降和肾组织受损情况(图1-C)。见表1。


组别BUN(mmol/L)Ucr(μmol/L)尿蛋白(mmol/L)血清BUN(mmol/L)Scr(μmol/L)肾系数(%)假手术组 309.96±9.541.76±0.491.14±0.315.38±1.6315.12±3.251.04±0.14模型组537.72±15.68∗5.83±0.57∗2.76±0.41∗43.75±5.26∗56.49±6.57∗1.58±0.21∗治疗组272.93±17.46#2.04±0.68#1.42±0.18#7.75±2.39#27.41±4.28#1.23±0.12#
*与假手术组比较P<0.05; #与模型组比较P<0.05

A:假手术组;B:模型组;C:治疗组
2.2 牛磺酸降低模型组小鼠血清中MDA含量,并增加SOD、GSH活力 与假手术组比,模型组小鼠血清中MDA含量增加,SOD和GSH活力下降,差异有统计学意义(P<0.05)。见表2。


组别血清MDA(nmol/L)血清SOD活力(U/mL)血清GSH(U/mL)假手术组5.21±0.8715.55±2.1258.65±3.65模型组10.97±1.67∗9.45±1.02∗34.19±4.21∗治疗组6.25±1.48#13.21±1.34#70.68±3.84#
*与假手术组比较P<0.05; #与模型组比较P<0.05
2.3 牛磺酸降低模型组小鼠肾组织TNF-α和IL-1β含量 与假手术组比,模型组小鼠肾组织TNF-α和IL-1β含量明显增加,差异有统计学意义(P<0.05)。见表3。

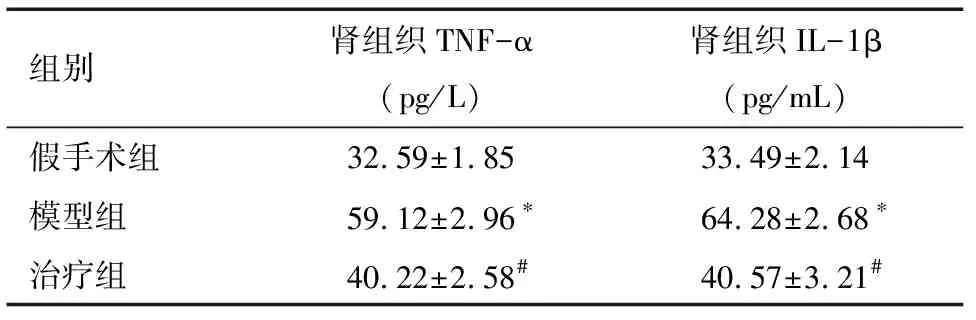
组别肾组织TNF-α(pg/L)肾组织IL-1β(pg/mL)假手术组32.59±1.8533.49±2.14模型组59.12±2.96∗64.28±2.68∗治疗组40.22±2.58#40.57±3.21#
*与假手术组比较P<0.05; #与模型组比较P<0.05
3 讨论
由LPS引起的全身炎症所造成的AKI是临床上常见的危重疾病,病情凶险,病死率高。然而AKI产生的机制并不十分明确,临床上也缺乏有效的治疗手段。牛磺酸是一种β-氨基乙磺酸,在体内以游离状态存在,具有抗氧化、抗炎等多种生物学效应[12]。大量研究显示,牛磺酸不仅对肝、脑等器官损伤有保护作用[4-6],而且对多种原因如百草枯[7]、糖尿病[8]、缺血再灌注[9]、体外冲击波碎石[10]、药物中毒[11]等造成的AKI有保护作用,然而在LPS引起的AKI中,牛磺酸是否也有保护作用,其机制如何,还没有文献报道。
本研究发现腹腔注射LPS可导致小鼠肾功能下降、肾系数增加、肾组织损伤;连续牛磺酸灌胃给药明显改善肾功能,表现为血清中BUN和Scr含量下降,尿液中BUN、Cr和尿蛋白含量下降,这些结果提示口服牛磺酸可明显改善LPS引起的肾功能损伤。
大量文献表明,LPS引起AKI的机制与自由基的产生、脂质过氧化和炎症反应有重要关系[13-14]。活性氧(reactive oxygen species, ROS)是机体氧化反应中产生的有害化合物,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病及衰老效应。自由基可使细胞膜被破坏、血清抗蛋白酶失去活性、损伤基因导致细胞变异的出现和蓄积。过多的活性氧可通过生物膜中多不饱和脂肪酸过氧化产生脂质过氧化物,引起细胞的膜性损伤以及线粒体损伤,从而产生更多的活性氧,造成恶性循环[15-16]。MDA 是体内脂质过氧化的重要产物,可间接反映脂质过氧化程度,是评价氧化应激水平的重要指标[17]。正常生理情况下,机体存在一些抗氧化物维持机体氧化/还原平衡,主要包括SOD、 GSH、 GSH-Px、过氧化氢酶(CAT)和维生素E/C等[18]。SOD 能清除氧自由基,是最重要的超氧自由基清除因子,它通过使氧自由基发生歧化反应,把超氧自由基转化为过氧化氢,并进一步转化为水,其活力的高低反映了抗氧化和防御自由基损伤的能力[17-18]。牛磺酸通过降低肝组织MDA含量、提高GSH活力改善缺血再灌注造成的肝损伤[19], 牛磺酸通过降低心肌组织MDA含量、增加SOD活力改善心肌缺血引起的损伤[20]。本研究显示连续牛磺酸给药可明显降低血清中MDA的含量,并提高血清中SOD和GSH活力,表明牛磺酸可能通过对抗或者清除自由基减轻LPS引起的肾损伤。
LPS通常与机体内的细胞膜上Toll样受体结合,通过激活细胞内NF-κB信号通路,诱导细胞过量表达和分泌TNF-α、IL-1β等致炎细胞因子,从而引起局部组织细胞变性、坏死[21-22]。本研究结果显示,LPS处理的小鼠肾组织炎症细胞因子IL-1β及TNF-α明显升高;肾组织HE染色结果表明肾组织出现明显病理损伤,且有较多炎症细胞浸润。牛磺酸预处理可降低肾组织IL-1β和TNF-α的含量,改善组织损伤。以上结果提示牛磺酸可能通过抑制炎性反应减轻LPS引起的肾损伤。
综上所述,进行牛磺酸预处理对LPS诱导的脓毒症小鼠AKI有一定保护作用,其机制与牛磺酸对抗氧化应激和抑制肾脏炎性反应有关。
