日本结缕草ZjERF2基因的克隆、转录激活活性、亚细胞定位和表达分析
2019-06-04姜红岩檀鹏辉刘凌云常智慧
张 蕊,姜红岩,滕 珂,檀鹏辉,汪 呈,刘凌云,常智慧
(1. 北京林业大学草坪研究所,北京 100083;2. 北京草业与环境研究发展中心,北京 100097)
为了适应不良的生长环境,植物进化出了复杂的分子调控网络,涉及许多功能基因,如ERF转录因子(TFS)等[1-2]。最初分离的乙烯应答元件结合蛋白(EREBPs),可结合启动子GCC box模体,都有一个由59个氨基酸组成的保守结构域[3]。根据AP2结构域的数量和特征,AP2/ERF转录因子超家族可分为3个亚家族,乙烯应答因子 (ethylene responsive factor, ERF)属于超家族中的ERF亚家族,参与植物生长发育过程以及应激反应响应[4]。目前,AP2/ERF已在不同物种中被认证。拟南芥AtERF108、AtERF111过表达株系在非生物胁迫条件下的过氧化氢和活性氧含量明显比抑制表达株系和野生型拟南芥低,逆能力明显提高[5];小麦(Triticum aestivum)TaERF1/ERF2能够明显增强转基因烟草(Nicotiana tabacum)的耐盐性、抗旱性及抗病性[6];GmERF8在大豆(Glycine max)根和叶中表达较高,响应ABA、高盐和低温处理,其表达量呈降低趋势,乙烯处理和干旱胁迫下则先下降后升高,所以认为GmERF8参与大豆对环境胁迫应答的调控网络[7]。
AP2/ERF TFs作为植物中一种非常重要的转录因子,可以通过结合启动子的顺式作用元件来调控下游基因的表达[8]。拟南芥AtERF1基因响应生物胁迫,结合到下游基因启动子GCC元件调控特定抗性基因表达,增强对病原菌的抵抗能力[9]。菜心(Brassica campestris)BrERF72可通过结合衰老相关基因启动子上的顺式元件(GCC和DRE/CRT)来参与JA介导的叶片衰老过程[10];水稻OsERF1基因调节干旱胁迫下ABA响应和脯氨酸合成基因表达来增强植物抗旱性[11];柑橘(Citrus reticulata Blanco)CitERF13转录因子是PPH基因的激活子,加速果皮叶绿素降解,有助于柑橘果实品质的形成[12],且CitERF13可能通过多种途径参与光合作用的调节[13]。
日本结缕草(Zoysia japonica)作为一种牧草和草坪草在我国被广泛使用,因其优良的特性成为研究植物抗性分子机制最有价值的材料[14]。尽管关于ERF在不同物种中已有大量研究,但是在多年生草本植物中的研究甚少。本研究旨在对克隆得到的一个ZjERF2基因,进行亚细胞定位、转录激活特性验证以及不同处理下的表达情况分析,为深入研究该基因在植物中的转录调控机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料及处理
日本结缕草种子由江苏省中国科学院植物研究所刘建秀研究员提供,所选品种为“Meyer”。栽培于 12 cm × 12 cm 的花盆,营养基质为蛭石、草炭、珍珠岩1∶1∶1体积的混合基质,生长于人工气候培养箱;本生烟草种子由北京林业大学实验室保存,培养条件与日本结缕草相同。选取健康生长的日本结缕草剪取根、茎、叶,同时剪取幼嫩、成熟和衰老时期叶片;选取5盆长势相同的日本结缕草分别喷施 10 μmol·L-1脱落酸、10 μmol·L-1茉莉酸甲酯、200 μmol·L-1乙烯,浇灌 300 mmol·L-1NaCl和20% PEG6000溶液。分别在处理后的0、1、3、6、12 和24 h取叶片样品并迅速置于液氮中,保存于-80 ℃冰箱备用。每种处理取3个生物学重复。
1.1.2 主要试剂及仪器
农杆菌EHA105、亚细胞定位载体3302Y3、酵母pGBKT7载体、Y2H Gold酵母菌株均由北京林业大学实验室保存;RACE试剂盒、反转录试剂盒、限制性内切酶BglⅡ、BamHⅠ、克隆载体pMD-19T、Prime STAR HS DNA Polymerase、无缝连接酶、-Trp和-Trp-His-Ade培养基等购于宝生物公司;RNA提取试剂盒、PCR产物纯化试剂盒购自OMEGA公司。大肠杆菌感受态DH5α购于天根生化科技公司;PCR Mix、SYBR Mix购自康为世纪公司;氯化钠(NaCL),聚乙二醇(PEG6000)、乙烯利(ET)、脱落酸(ABA)和茉莉酸甲脂(MeJA)购于SIGMA-ALDRICH。本研究所用的荧光定量仪为BIO-RADCFX Connect,激光共聚焦显微镜为LEICA SP-5。
1.2 试验方法
1.2.1 引物设计
根据之前的日本结缕草转录组数据设计5’/3’RACE的引物,根据DNAMAN 8.0拼接测序结果,设计引物ZjERF2-F/R扩增ORF。根据ZjERF2基因gDNA序列的5’端设计染色体步移3条特异性引物SP1、SP2、SP3。根据染色体步移测序结果设计引物ZjERF2-Pro-F/R扩增启动子序列。亚细胞定位载体构建引物3302Y3-ERF2-F/R,pGBKT7载体构建所需引物BD-ERF2-F/R。设计荧光定量引物qPCR-F/R及荧光定量内参引物ACT-F/R(表1)。
1.2.2 基因克隆与生物信息学分析
用试剂盒提取健康生长的日本结缕草总RNA,反转录为cDNA,以5’/3’RACE为引物,按照RACE试剂盒说明书进行5’/3’RACE,以cDNA为模板、ZjERF2-F/R为引物进行PCR扩增,将PCR产物纯化后连接克隆载体pMD-19T,转化大肠杆菌,挑取大小均一的菌落进行PCR反应,凝胶电泳出现单一条带的菌液送往公司进行测序,从测序正确的菌液中提取质粒用于后续试验。

表1 本研究所用到的引物Table 1 Primers used in this study
通过DNA MAN7.0软件将ZjERF2基因的核酸序列翻译为氨基酸序列。通过NCBI网站Blast功能进行蛋白保守结构域分析和不同物种同源比对;利用 http://web.expasy.org/protparam/及 http://bioinf.cs.ucl.ac.uk/psipred/对ZjERF2编码蛋白的一、二级结构进行预测;通过SignalP4.1 Server网站(http://www.cbs.dtu.dk/services/SignalP)预测该蛋白是否带有信号肽。通过MEGA5.0软件中Neigh-bor-Joining法构建系统进化树。在 Cell-PLoc 2.0 package 网站 (http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)对亚细胞定位情况进行预测。
1.2.3 启动子克隆与作用元件预测
CTAB法提取日本结缕草叶片DNA,以日本结缕草gDNA为模板,以SP1、SP2、SP3为引物进行PCR反应,第1(2)步PCR反应产物稀释10倍作为第2(3)步PCR模板,将1、2、3轮PCR产物分别取5 μL进行电泳,第3步PCR产物进行DNA测序。以日本结缕草gDNA为模板、ZjERF2-Pro-F/R为引物扩增启动子序列,将PCR产物纯化后连接克隆载体pMD-19T,转化大肠杆菌,经涂板、挑菌、菌液PCR,检测为阳性的菌液送公司测序。将启动子序列导入PLACE网站(https://sogo.dna.affrc.go.jp),分析该启动子上存在的作用元件。
1.2.4 构建载体
以构建的pMD-ZjERF2质粒为模板,3302YERF2-F/R为引物进行PCR扩增,PCR纯化产物与BglⅡ单酶切过的3302Y3载体连接后转化大肠杆菌,检测为阳性的菌液送公司测序,测序正确的菌液即为所构建的 35S:ZjERF2:YFP 载体;pMDZjERF2质粒为模板、BD-ERF2-F/R为引物进行PCR扩增,然后利用BamHⅠ单酶切pGBKT7载体,将PCR产物及载体单酶切产物进行纯化,之后在无缝连接酶的作用下进行连接,连接产物转化DH5α,挑取单克隆送公司测序,测序正确的菌液提取质粒,保菌备用。
1.2.5 转录激活活性验证
利用LiAC方法[15]将pGBKT7-ZjERF2转化酵母感受态细胞,100~200 μL转化产物涂布于SD/-Trp培养基上,同时转化pGBKT7空载体为对照。挑取成功转化目的质粒的酵母单克隆,30 ℃摇培48 h后稀释10倍、100倍,取10 μL原液及稀释后的菌液分别点样于SD/-Trp和SD/-Trp-His-Ade培养基,倒置,30 ℃培养3 d左右直至出现菌落,利用 Cannon EOS 60D 拍照。
1.2.6 亚细胞定位
采用冻融法将构建好的 35S:ZjERF2:YFP 载体转化农杆菌EHA105,转化产物涂布于含50 mg·L-1Kana 和 50 mg·L-1Rif的 LB 培养基上,28 ℃ 培养 2 d,挑取大小均一、白色透明的菌落进行菌液PCR,有条带的菌液进行DNA测序,比对正确即表明载体成功转化农杆菌。使用注射器将成功转化目的基因的农杆菌菌液打入本生烟草叶片,同时注射转化3302Y3空载体的菌液作为对照,黑暗培养48 h后在激光共聚焦显微镜(Leica SP-5)下观察叶片细胞中荧光的分布。
1.2.7 表达分析
采用Trizol法提取植株总RNA,取6 μL反转录为cDNA,以cDNA为模板,qPCR-F/R为引物、Actin基因(GenBank登录号:GU290546)为内参qRTPCR检测ZjERF2基因在不同条件下的表达量。每个样品包括3个生物学重复及4个技术重复。用2-ΔΔCt法计算基因的相对表达量[16],利用Excel 2010作图,SPSS18.0进行单因素方差分析和LSD法多重比较。
2 结果与分析
2.1 ZjERF2基因的克隆和生物信息学分析
从日本结缕草中克隆得到ZjERF2基因,开放阅读框为825 bp,编码274个氨基酸(图1)。在NCBI网站进行Blast分析,发现ZjERF2编码蛋白含有1个AP2保守结构域,具有ERF转录因子亚家族成员的特性;CLUSTALW的多序列比对结果显示,ZjERF2与黍 (Panicum hallii)、谷子 (Setaria italica)同源蛋白的相似性达到80%(图2A)。在线预测的该蛋白一级结构有以下特征,分子量为26.05 kDa、理论等电点为6.23,其中阴性氨基酸(Asp+Glu)31个、阳性氨基酸(Arg+Lys)29个,总平均亲水性-0.46,属于亲水蛋白。信号肽预测结果表明,ZjERF2不含信号肽。构建好的系统进化树中ZjERF2与谷子(GenBank登录号为XP_004954129)的亲缘关系最近(图2B)。亚细胞定位预测结果显示,ZjERF2定位于细胞核。

图1 ZjERF2基因及启动子的克隆Figure 1 Cloning of ZjERF2 gene and its promoter
2.2 ZjERF2启动子的克隆和作用元件分析
通过染色体步移获得ZjERF2基因ATG上游1 549 bp的启动子序列(图1)。启动子在线预测发现,ZjERF2启动子包含常见的顺式作用元件CAAT-box、TATA-box和大量光感应元件,此外还有赤霉素响应元件GARE-motif、热胁迫相应元件HSE、低温响应元件LTR、与MYB结合的干旱响应元件以及与分生组织发育相关元件(图3)。
2.3 ZjERF2转录激活活性分析
10 μL原液及稀释10倍、100倍后的稀释菌液点样在-Trp和-Trp-His-Ade培养基上,培养3 d后酵母生长情况如图4所示,在-Trp-His-Ade培养基上,空载pGBKT7在3种浓度梯度下,都没有有生长迹象,而重组载体pGBKT7-ZjERF2都可以正常生长。本研究表明:ZjERF2能够激活组氨酸合成基因的表达,具有较强的自激活活性。
2.4 ZjERF2编码蛋白亚细胞定位
将成功转化 35S:ZjERF2:YFP 和 35S:YFP 的农杆菌菌液分别转入本生烟草,在黑暗条件下培养48 h后,置于激光共聚焦显微镜下观察。发现在激发场和融合场下,转35S:YFP的荧光信号分布于整个细胞中,而 35S:ZjERF2:YFP 定位于叶细胞核(图5)。亚细胞定位结果表明,ZjERF2定位于细胞核。
2.5 ZjERF2表达模式分析
2.5.1ZjERF2在不同组织中的表达
剪取正常生长的日本结缕草成熟植株的根、茎、叶样品,分别提取RNA,反转录成cDNA后进行荧光定量分析,结果显示,ZjERF2在不同组织中的表达有显著差异,叶中的表达量要显著高于根和茎中(P< 0.05),分别是根中的2.61倍,茎中的1.57 倍 (图6A)。
2.5.2ZjERF2在不同发育时期的表达
分别剪取幼嫩叶片、成熟叶片、衰老叶片做荧光定量分析,结果表明,ZjERF2在叶片不同发育时期存在差异,成熟叶片中的表达量显著高于衰老期和幼苗期(P< 0.05),表达量最高达到4.21,衰老期的表达量相对于幼苗期也差异显著(P< 0.05)(图6B)。
2.5.3ZjERF2在不同激素和胁迫处理下的表达
ET、MeJA两种激素处理后,对日本结缕草中ZjERF2基因的mRNA转录水平进行检测,发现ET处理诱导ZjERF2基因的表达,处理前3 h表达量下降,在6 h又迅速升高,达到最高水平6.70,显著高于其他时间(P< 0.05),为初始水平的1.30倍,12 h 和 24 h 的表达量呈下降趋势 (图6C)。MeJA 处理ZjERF2基因表达变化与ET基本一致,在处理后 6 h 达到峰值,是 0 h 的 2.56 倍 (P< 0.05),24 h显著低于初始水平(图6D)。
ABA、PEG、NaCl处理后 24 h内ZjERF2基因的表达均受到抑制,其中PEG抑制作用最为明显,表达水平在24 h内一直处于抑制状态,6 h时比起始水平下降了40倍左右,ABA处理ZjERF2基因表达则先下降后又有小幅度的回升,ABA和NaCl处理均不高于起始水平(图6 E、F、G)。

图2 ZjERF2基因的同源性比对和遗传进化分析Figure 2 Multiple sequences alignment and genetic evolution analysis of ZjERF2 gene
3 讨论
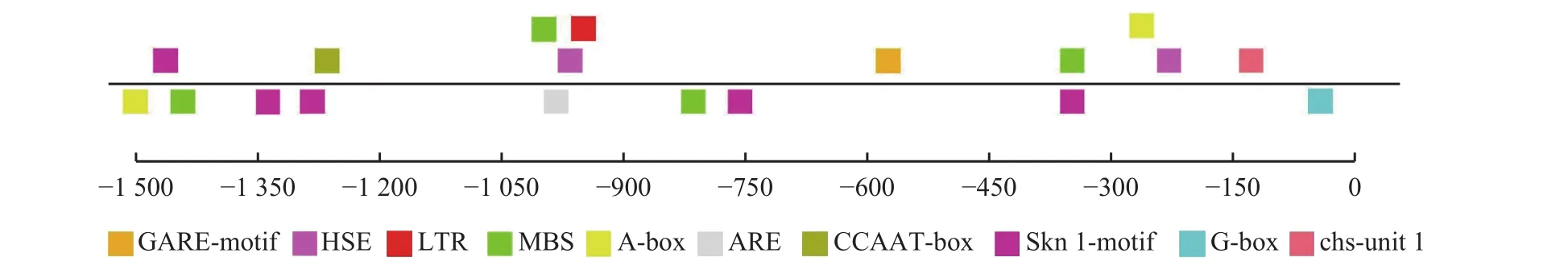
图3 启动子作用元件分布Figure 3 Distribution of promoter cis-element

图4 ZjERF2转录激活活性验证Figure 4 Validation of ZjERF2 transcriptional activation activity
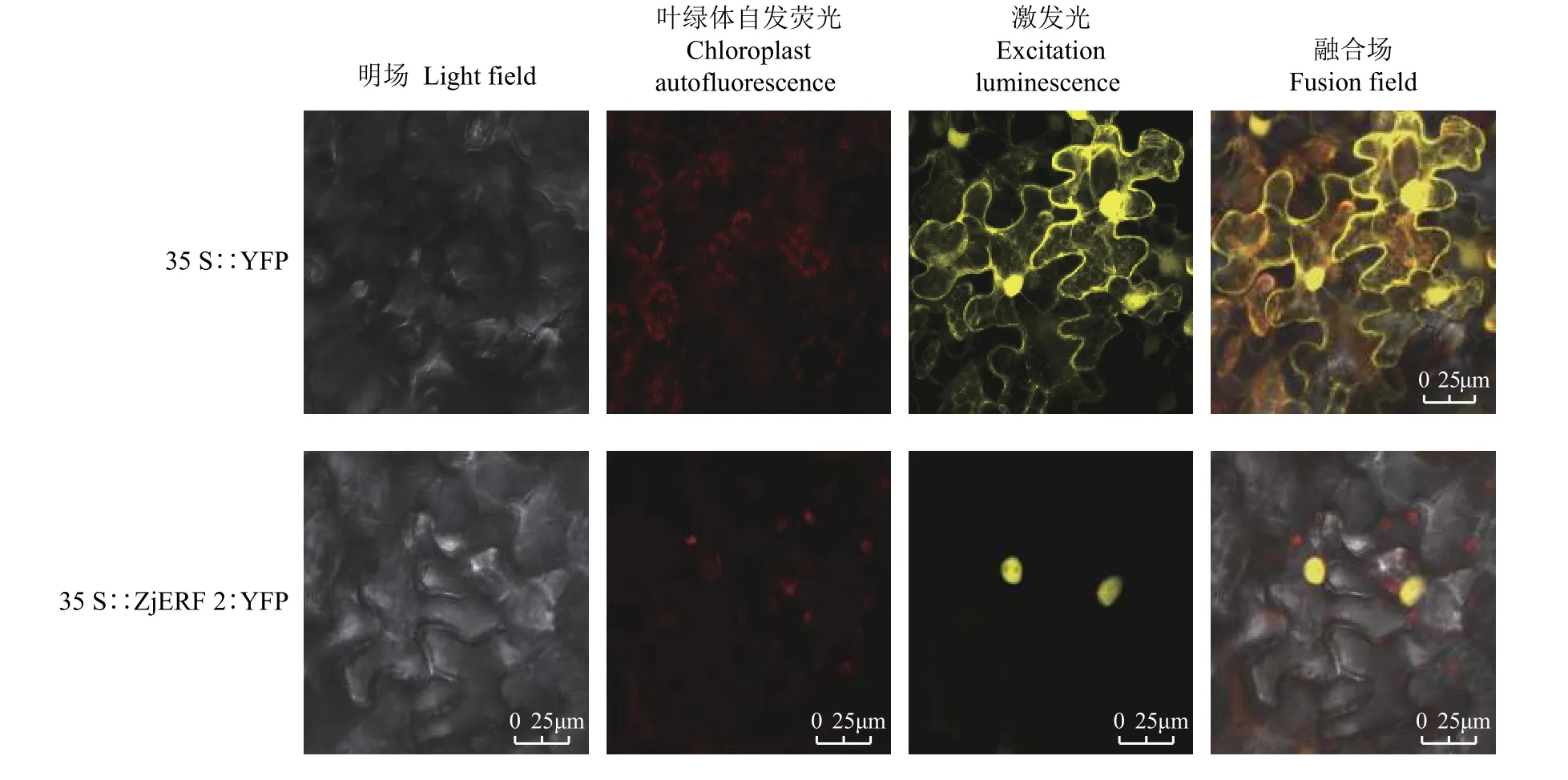
图5 ZjERF2的亚细胞定位Figure 5 Subcellular localization of ZjERF2
日本结缕草作为一种广泛利用的草坪草,其对不良环境的适应能力直接关系到草坪的品质[17]。AP2/ERF TFs是同植物抗逆应答密切相关的一类转录因子大家族,它们与顺式作用元件或其他蛋白特异性结合的亲和力使它们能够同时响应不同的调控过程[18]。本研究从日本结缕草内克隆得到ZjERF2基因。对ZjERF2基因编码的蛋白序列进行生物信息学分析,结果表明其与谷子、黍的同源物序列相似性较高,含有一个AP2蛋白保守结构域,属于ERF亚家族;N端不含信号肽,说明该蛋白翻译后水平不需要进行加工和切除可直接发挥功能。亚细胞定位结果显示该蛋白分布在细胞核中,与丹参(Salvia miltiorrhiza)SmERF1[19]、青蒿(Artemisia annua)AaORA[20]、杨树(Populus)ERF76[21]等的定位情况一致。酵母自激活分析证明日本结缕草ZjERF2具有转录激活活性,与水稻(Oryza sativa)核定位蛋白OsEFF71的结果一致[11]。亚细胞定位和转录激活分析结果表明:ZjERF2具有典型的转录因子特性。

图6 ZjERF2在不同组织中、不同发育时期及不同激素和胁迫处理下的表达特征分析Figure 6 Analysis of ZjERF2 expression characteristics in varied tissues, and at different developmental stages,and under hermone and stress treatments
荧光定量结果表明,ZjERF2在日本结缕草根、茎、叶中均有表达,但不同组织中存在显著差异,叶中表达量明显高于根和茎。这与甜瓜(Cucumis melo)CmERFIV-5、茶树 (Camellia sinensis)ERF基因在根、茎、叶中的表达情况一致[22-23]。不同发育时期荧光定量结果显示,随着植物成熟,叶片ZjERF2基因表达量升高,在植物衰老期又有所下降但高于幼苗期,表明该基因可能参与调控植物成熟及衰老进程。这与果实中ERF基因促进果实成熟机理一致,如西红柿(Lycopersicon esculentum)SIAP2a[24]、甜瓜CMeERF1/2[25]、柑橘CitERF13[19]等。
乙烯信号转导参与多种发育过程和应激反应,AP2/ERF对这些信号级联反应高度敏感[26]。本研究发现,喷施ET和MeJA都可以诱导ZjERF2基因表达。前人研究也有相同结果,如拟南芥AtERF1/4[27-28]、谷子(Setaria italica)SiERF[29]和烟草Tsi1基因等[30]。研究发现ERFs基因不仅受乙烯诱导,还受多种非生物胁迫的诱导。本研究用NaCl和PEG6000处理后,日本结缕草ZjERF2基因处于抑制表达状态,这与小麦ERF1/2[31]、大豆GmERF[32]、青杨[33]受盐和干旱强烈诱导的结果不同。原因可能是日本结缕草中ZjERF2基因在SA、JA、ET等参与的植物抗病防卫反应中具有重要作用,而不参与干旱、盐等渗透胁迫应答;或者非生物应答途径独立于乙烯信号途径。具体原因有待于进一步试验论证。许多AP2/ERF响应ABA信号,本研究ABA处理对ZjERF2基因有明显的抑制作用,这与拟南芥AtERF1/4[9]、 丹参SmERF1[19]和矮牵牛(Petunia hybrida)PhERF9/10/12/1[34]结果一致。
4 结论
本研究从日本结缕草中克隆了ZjERF2基因,其开放阅读框为825 bp,编码274个氨基酸。同时,得到ZjERF2基因上游1 549 bp的启动子序列,该序列含有多个与生长发育相关和响应非生物胁迫的作用元件。亚细胞定位结果显示,ZjERF2定位于细胞核,说明该蛋白在细胞核发挥功能;转录激活分析表明其具有转录激活活性。荧光定量数据表明,ZjERF2在成熟叶片中高表达,且ZjERF2的表达受ET、MeJA、ABA及盐和干旱处理的调节。本研究为进一步探索ZjERF2基因的功能奠定了基础。
