前列腺癌中锌指蛋白ZIC2表达及对细胞增殖和凋亡的影响
2019-06-03陈书练李晓光
张 能,苏 鹏,陈书练,李晓光,黄 翔,罗 旭
遵义医学院附属医院泌尿外科,贵州 遵义 563003
前列腺癌发生远处转移是患者致死的首要原因[1-2],5年生存率仅为28%[3]。并且,我国大多数前列腺癌患者就诊时已属于晚期[4]的现状造成疗效及预后差。因此,对相应关键蛋白的深入研究有重要的临床价值。锌指蛋白ZIC2在口腔鳞癌[5]、卵巢癌[6]及鼻咽癌[7]中均明显上调,预示预后不良,并发挥癌基因作用。在肝癌干细胞中ZIC2高表达,能促进肝癌干细胞自我更新,ZIC2下调后通过抑制OCT4表达而降低干细胞成球能力、裸鼠移植瘤生长[8]。因此,ZIC2在肿瘤的发生和发展中均具有重要的调控作用。
本文通过检测前列腺癌组织中ZIC2的表达,探讨ZIC2异常表达与前列腺癌病理参数间的关系,明确ZIC2的临床价值;沉默前列腺癌中ZIC2基因后观察其对前列腺癌细胞增殖与凋亡的影响。
1 资料和方法
1.1 临床资料
回顾性检测2015年1月—2018年1月遵义医学院附属医院泌尿外科行前列腺穿刺活检确诊为前列腺癌组织,共31例。患者年龄55~70岁(平均65.6±3.7岁);术前检测前列腺特异性抗原(prostate-specific antigen,PSA)分布如下:<10 mg/L 4例,10~20 mg/L 17例,>20 mg/L 10例;病理学检查Gleason评分:≤6分3例,7分21例,≥8分7例;临床分期≤T2a5例,T2b14例,≥T2c12例。以同期行经尿道前列腺电切术(transurethral resection of the prostate,TURP)治疗的35例良性前列腺增生(benign prostatic hyperplasia,BPH)组织作为对照组。
1.2 主要实验试剂
RPMI-1640培养基、胰蛋白酶购自美国Gibco公司,新生小牛血清购自杭州四季青生物工程材料有限公司,DMSO购自美国Sigma公司,兔抗人ZIC2单克隆抗体(PA5-38538)购自美国Thermo Fisher Scientific公司,PBS、SP试剂盒及DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 细胞与慢病毒载体
人前列腺癌细胞系DU145购自武汉博士德生物工程有限公司。含有效ZIC2基因干扰片段的慢病毒载体PSE2609由上海生博医学生物工程科技有限公司构建。
1.4 前列腺癌组织中ZIC2蛋白检测
免疫组织化学SP两步法检测ZIC2蛋白水平。制作5 μm厚组织切片后根据试剂盒说明书完成免疫组织化学实验步骤:常规脱蜡水化,经微波抗原修复后使用过氧化氢(H2O2)灭活内源性过氧化物酶,PBS冲洗3次后用山羊血清封闭。滴加一抗(ZIC2为1∶100),4 ℃冰箱过夜,用PBS反复冲洗3次后滴加二抗37 ℃温育30 min,DAB显色蒸馏水终止反应,经苏木精复染后,树脂封片后显微镜下观察。阴性一抗对照用PBS缓冲液代替,以检测细胞出现棕黄色颗粒为阳性细胞。随机计数5个视野,对ZIC2蛋白阳性染色情况进行评判,<10%的肿瘤细胞染色为(+),10%~40%为(2+),40%~70%为(3+),>70%为(4+)。用Image-proplus 6.0图像分析软件测量积分光密度(D)值进行相对定量分析,总体阳性率判断标准以染色细胞10%~40%(2+)为阳性;染色细胞<10%为阴性。ZIC2蛋白在前列腺癌组织细胞的细胞质中呈阳性表达,大部分细胞核呈棕黄色。
1.5 前列腺癌细胞系培养
人前列腺癌细胞系DU145培养于含10%新生小牛血清的RPMI-1640培养基中,置于37 ℃、CO2体积分数为5%细胞培养箱进行培养。倒置显微镜下观察细胞生长情况,每隔2 d更换新鲜培养基。待细胞生长至80%~90%,0.1%胰蛋白酶消化收集细胞,按 1∶4~1∶2传代。
1.6 含ZIC2干扰片段慢病毒载体的合成及细胞转染
设计并筛选两条ZIC2干扰片段靶点:序列1为5'-TGCACATGAAGGAGCACCCGGATTA-3';序列2为5'-CATGAAGGAG CACCCGGATTATAAA-3'。两条干扰片段的干扰效果前期预实验已经验证,均达到标准。实验中选择了序列1作为研究材料。由上海生博医学生物工程科技有限公司构建含有效ZIC2干扰片段的慢病毒载体PSE2609。按照慢病毒转染操作手册进行细胞转染前列腺癌细胞系DU145并培养,对数生长期细胞经0.1%胰酶消化取0.5×105个接种于24孔板内,待融合度到50%后按慢病毒复染指数(multiplicity of infection,MOl)100进行转染,即每孔转染病毒数5×106个,常规培养液继续培养。采用蛋白质印迹法(Western blot)检测ZIC2蛋白水平变化。
1.7 流式细胞术检测细胞周期及细胞凋亡
收集DU145及DU145-RNAi细胞,800 r/min离心5 min去除培养液。用PBS清洗3遍后重悬计数,将细胞密度调整为1×106个/mL,依次加入5 μL Annexin Ⅴ-FITC、5 μL碘化丙啶(propidium iodide,PI),混匀、避光放置15 min。用0.9%NaCl溶液再次重悬后流式细胞术检测细胞增殖及细胞凋亡情况。采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法检测细胞增殖情况,细胞生长周期需用4 ℃预冷的75%酒精重悬过夜后再送流式细胞术检测。计算细胞增殖指数(proliferation index,PI)。
1.8 统计学处理
资料采用SPSS 19.0软件包进行统计分析,两组间阳性率的检验采用χ2检验完成,临床病理参数及细胞周期与凋亡间差异比较采用行×列表χ2检验,配对资料采用t检验。P<0.05为差异有统计学意义。
2 结 果
PSA、Gleason分值及临床分期是前列腺癌危险度的关键临床病理参数[9]。本研究检测前列腺癌中ZIC2并探讨其表达情况与PSA、Gleason分值及临床分期的可能关系。
2.1 ZIC2蛋白在前列腺癌及BPH组织中的水平
本研究中ZIC2蛋白在前列腺癌组织中的阳性表达率为(以++为阳性标准)90.32%(28/31),其中(4+)为12例,(3+)为11例,(2+)为5例,(+)为2例,(-)为1例;明显高于BPH组织中表达率20%(7/35),其中(4+)为1例,(3+)为2例,(2+)为4例,(+)为12例,(-)为16例。两者间差异有统计学意义(χ2=32.639,P=0.000,表1和图1)。

表 1 ZIC2在前列腺癌组织及BPH中总体阳性表达情况Tab. 1 Overall positive expression of ZIC2 in prostate cancer and BPH tissue
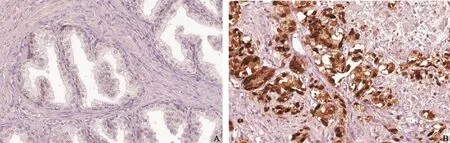
图 1 前列腺癌及BPH组织中ZIC2蛋白表达免疫组织化学结果Fig. 1 ZIC2 protein level was detected by immunohistochemistry in prostate cancer and BPH tissue (SP, ×100)
2.2 前列腺癌中ZIC2蛋白水平变化与前列腺癌临床病理参数间的关系
31例前列腺癌组织中ZIC2蛋白呈阳性表达为28例,总体阳性表达率为90.32%(28/31)。ZIC2阳性表达数量在不同PSA中的分布情况分别是:<10 mg/L 3例,10~20 mg/L 16例,>20 mg/L 9例,ZIC2在不同PSA分级中进行分析,结果表明ZIC2阳性表达率与PSA高低差异无统计学意义(χ2=1.888;P=0.527);ZIC2阳性表达数量在不同Gleason分值中的分布情况分别是:≤6分 2例,7分 20例,≥8分6例,ZIC2及在不同Gleason分值中进行统计学分析,结果显示ZIC2蛋白与Gleason分级差异有统计学意义(χ2=9.753,P=0.003);ZIC2阳性表达数量在不同临床分期中的分布情况分别是:≤T2a期3例,T2b期13例,≥T2c期12例,ZIC2在不同临床分期中进行统计学分析,结果显示差异无统计学意义(χ2=4.837,P=0.060,表2)。

表 2 ZIC2蛋白在前列腺癌中的表达情况及临床病理参数的相关程度Tab. 2 Relationship between the expression of ZIC2 and clinical and pathological parameters in prostate cancer tissue
2.3 前列腺癌细胞中ZIC2基因干扰后其蛋白水平变化
Western blot检测受干扰前后前列腺癌细胞中ZIC2蛋白变化情况。经过siRNA处理后前列腺癌细胞DU145中ZIC2表达明显降低,与亲代细胞DU145相比较ZIC2蛋白表达显著降低,差异有统计学意义(P<0.05,图2)。

图 2 干扰前后ZIC2蛋白在前列腺癌细胞DU145中变化情况Fig. 2 Expression levels of ZIC2 protein in prostate cancer cell DU145 before and after interference
2.4 前列腺癌细胞中ZIC2低表达后细胞增殖、凋亡的变化

图 3 MTT法分析ZIC2基因受干扰后前列腺癌细胞DU145增殖情况Fig. 3 The proliferation rate of DU145 prostate cancer cells interfered by ZIC2 gene detected by MTT analysis
本研究使用siRNA降低前列腺癌细胞中ZIC2的表达水平,明确ZIC2对前列腺癌细胞增殖及凋亡的影响。结果显示,转染含有ZIC2基因干扰片段后前列腺癌的增殖、细胞周期及细胞凋亡均发生改变。采用MTT检测亲代前列腺癌细胞DU145及ZIC2在siRNA作用后DU145(DU145-RNAi)中细胞增殖情况,结果显示ZIC2表达降低后前列腺癌细胞增殖速度显著减慢;与DU145相比,48、72及96 h细胞的增殖情况差异均有统计学意义(图3)。采用流式细胞术检测细胞周期及细胞凋亡。与DU145相比较,DU145-RNAi 细胞中G1及G2期细胞增殖比率明显增加,差异有统计学意义(表3及图4)。S期细胞增殖比率增加(27.64±1.51)% vs(39.43±2.95)%(t=4.362,P=0.012);ZIC2低表达的细胞系DU145总凋亡率明显增加,与亲本细胞系DU145相比较差异有统计学意义(P<0.05,图5及表3)。

表 3 ZIC2低表达后前列腺癌细胞周期变化及凋亡比较Tab. 3 Comparison of cell cycle and apoptosis after downregulation of ZIC2 in prostate cancer cells

图 4 流式细胞术检测细胞周期显示ZIC2受干扰后细胞周期发生改变Fig. 4 Cell cycle changes were detected by fl ow cytometry after ZIC2 interference

图 5 流式细胞术检测ZIC2干扰后细胞凋亡变化Fig. 5 Changes in apoptosis after ZIC2 interference were detected by fl ow cytometry
3 讨 论
前列腺癌是欧美等国家男性最常见的恶性肿瘤,来自美国国立癌症研究所(National Cancer Institute,NCI)的数据显示前列腺癌的死亡率仅次于肺癌,成为第二位致死性恶性肿瘤[10]。近12年来我国前列腺癌的发病率年增速为4.7%,死亡率年增速为5.5%[11]。患者血清PSA、Gleason评分和临床分期是前列腺癌危险等级公认的三个核心指标。随着对前列腺癌的深入研究,探讨前列腺癌相关的其他蛋白对该疾病的诊断和治疗有重要的临床意义,其可能成为潜在靶点。
ZIC2是锌指蛋白家族重要的成员之一,在结构上包含高度保守、串联的C2H2锌指样结构[12]。ZIC2对脊椎动物神经发育发挥着重要的作用,参与神经管和神经嵴的形成[13]。人和小鼠胎儿发育过程中,若ZIC2基因发生突变将导致前脑无裂畸形[14]。小鼠和斑马鱼神经嵴形成过程中ZIC2发挥重要作用[15]。在许多肿瘤中发现ZIC2异常表达,并发挥癌基因作用[5,16-17]。口腔鳞状细胞癌和卵巢癌中,ZIC2表达均明显上调,并且与不良预后密切相关[5,16];鼻咽癌中ZIC2表达显著增加,其启动子与HOXA10功能区结合后促进表达导致肿瘤增殖及侵袭能力增强[7];ZIC2表达下调能明显抑制卵巢癌细胞的存活率[8];宫颈癌中ZIC2表达也明显升高,下调ZIC2表达会通过抑制Hedgehog信号通路中Gli1表达降低Hedgehog信号通路活性,最终抑制宫颈癌细胞增殖和软琼脂中克隆形成能力[6];ZIC2在胰腺癌细胞中呈高表达,下调ZIC2则会通过抑制FGFR3和ANXA8的表达阻滞细胞增殖、细胞周期并诱导细胞凋亡[17]。Zhu等[16]研究表明,ZIC2在肝癌干细胞中高表达,并且可以促进肝癌干细胞的自我更新,ZIC2下调后会通过抑制OCT4的表达降低干细胞成球能力和裸鼠体内成瘤性。因此,ZIC2在肿瘤的发生、发展中均具有重要的调控作用。
本研究结果显示,31例前列腺癌组织中ZIC2蛋白呈阳性表达为28例,总体阳性率为90.32%(28/31),明显高于BPH组织中表达率为20%(7/35),二者间差异有统计学意义(χ2=32.639,P=0.000)。其中ZIC2阳性表达数量在不同PSA分级中的分布情况分别是:<10 mg/L 3例,10~20 mg/L 16例,>20 mg/L 9例,ZIC2在不同PSA分级中进行分析,结果表明ZIC2阳性表达率与PSA分级差异无统计学意义(χ2=1.888;P=0.527);ZIC2阳性表达数量在不同Gleason分级中的分布情况分别是:≤6分2例,7分20例,≥8分6例,ZIC2在不同Gleason分级中进行统计学分析,结果显示ZIC2蛋白与Gleason分级差异有统计学意义(χ2=9.753,P=0.003);根据此结果,我们推测前列腺癌中ZIC2的表达与Gleason分级越高的细胞形态学异型性不断升高甚至出现前列腺癌干细胞数量增加有关,具体关系需在干细胞的分子水平进一步探讨Gleason分值与ZIC2表达量间相关性,ZIC2可能成为与Gleason评分一样具有重要临床价值的危险因素。ZIC2阳性表达数量在不同临床分期中分别是:≤T2a期3例,T2b期12例,≥T2c期13例,ZIC2在不同临床分期中进行统计学分析,结果显示差异无统计学意义(χ2=4.837,P=0.060),目前ZIC2阳性表达与临床分期之间无相关(P=0.060),我们考虑可能与以下因素相关:本次为纳入T3期以上的患者资料,并且在T2期分期中总的阳性病例数28例,再分为3个亚组后统计学数值与ZIC2临床标本中的实际表达存在偏差,为明确ZIC2的表达情况需进一步增加病例数量及优化分层进行比较。
通过对前列腺癌DU145细胞中ZIC2蛋白检测显示,亲代前列腺癌细胞DU145中ZIC2蛋白呈高表达,ZIC2基因受干扰后的DU145中ZIC2蛋白相对表达量显著下降,结合文献及结果提示ZIC2在前列腺癌起癌基因的作用,并且干扰处理后达到预期效果。既往研究显示ZIC2表达降低后导致肿瘤细胞增殖及侵袭能力降低[8]及抑制卵巢癌细胞的存活率[6]。本文通过MTT法、流式细胞术检测细胞增殖及凋亡情况。MTT法结果显示ZIC2表达降低后前列腺癌细胞增殖速度显著减慢;与DU145相比,48、72及96 h细胞的增殖差异有统计学意义;ZIC2基因低表达后细胞周期发生明显变化(表3及图4),与对照组DU145相比较G1期及G2期细胞增殖比率明显降低,而S期细胞增殖比率增加[(27.64±1.51)% vs(39.43±2.95)%]。MTT及细胞周期分析结果提示ZIC2表达降低后能够有效抑制细胞的增殖,并使细胞向S期转化。流式细胞术检测凋亡结果显示,ZIC2低表达细胞株DU145的晚期凋亡率及总凋亡率明显增高;与亲代细胞DU145相比,晚期凋亡及总凋亡率,分别为(5.76±0.66)%及(24.78±2.15)%,差异有统计学意义。本研究显示ZIC2在前列腺癌中高表达,属癌基因,且与前列腺癌Gleason评分密切相关;表达降低后能明确改变前列腺癌细胞的增殖和凋亡。结果提示ZIC2可能是前列腺癌侵袭转移的重要调节因子,但其中的机制,特别是与相关信号通路间的相互作用,值得进行深入研究。
