利用分叉微通道提高夹切进样微流控芯片电泳可靠性的探索
2019-05-22王兆彦蒲巧生
魏 轩,王 琰,王兆彦,蒲巧生*
(1.兰州大学 化学化工学院,甘肃 兰州 730000;2.通化师范学院,吉林 通化 134002;3.兰州大学 药学院,甘肃 兰州 730000)
微流控芯片电泳分析速度快、试剂和样品消耗量少,在基因分析[1-4]、药物分析[5-6]、食品安全[7]和医疗诊断[8-9]等领域具有广阔的应用前景。夹切进样是微流控芯片电泳常用的进样方式之一,该方式利用电场控制进样区带的大小,使用方便[10]。但在微流控芯片电泳的实际操作中,该方式仍存在一些需要解决的问题。首先,进样所需时间比较长。在夹切进样过程中,样品池中的待测物质是在电场驱动下迁移到十字或双T结构处,然后进入分离通道完成分离。由于各待测物质电迁移速率的差异[11-13],为保证分析结果的可靠性,进样时间取决于有效电迁移速度最慢的成分[14-16],耗时很长(与分离所需时间相比)。其次,在多次进样-分离循环中,样品可能被运行缓冲液稀释,导致进样区带中分析物浓度低于样品中的实际浓度,且重现性变差。再次,随着进样次数的增加,样品废液池的溶液逐渐增多,引起分离通道中的压力流动,造成峰形拖尾和重现性变差[17]。最后,进样阶段施加在分离通道上的电压会将前一次分离的样品推回检测位点,造成基线的抬升或漂移。Revermann等[18]通过综述总结了解决这些问题的方法。如Thomas等[10]提出了一种多次夹切进样的方法,但该进样方式需要6根电极,增大了系统的复杂程度;Lin等设计了带有废液移除功能的流通式芯片,重复进样3 h以上仍能保持很好的重复性[19],但该方法需额外的注射泵,且样品和试剂消耗量较大;Karlinsey等通过在PDMS-glass芯片上整合隔膜泵压力注射来消除样品的进样歧视[20],但这种芯片制作过程比较复杂;Luo等在双十字芯片上通过排空样品废液槽产生的液体静压力来实现样品的进样,其中一个十字用来形成样品塞,另一个十字用来对样品塞进行调控,该双十字芯片能够重复进样33次[21]。最近,Majarikar等利用带有旁路结构的微流控芯片来自动补偿微流控芯片电泳中压力差引起的流动,但该方法不适合离子强度较大的缓冲体系[22]。
本研究在进样和分离微通道中引入分叉结构,增加额外的样品废液池和缓冲废液池,利用液面差实现进样微通道入口端和分离通道出口端溶液的连续更新,在不引入其它设备,也不会显著加大芯片制作难度的前提下,有效解决了上述问题,显著提高了微流控芯片电泳的重复性,且有一定程度的样品预分离能力。
1 实验部分
1.1 仪器与试剂
研究所用四路程控高压电源和激光诱导荧光检测器均由本课题组设计制作。其中高压电源由4个高压模块(DW-P303-1AC,东文高压电源(天津)股份有限公司)、继电器和控制电路构成,输出电压0~3 000 V可调。激光诱导荧光(LIF)检测器由MBL-Ⅲ-473二极管泵浦全固态蓝色激光器(长春新产业光电技术有限公司)、显微镜物镜(40×,重庆麦克光电仪器有限公司)、DM 505二向色镜和BP 520长通滤波器(沈阳汇博光学技术有限公司)组成。检测器采用共聚焦光路,激光照射到二向色镜上(45°放置),经二向色镜反射到物镜,聚焦至微流控芯片检测点,激发的荧光被同一物镜收集,经二向色镜、长通滤波器聚焦到CR105-01光电倍增管(北京滨松光子技术股份有限公司)前的针孔上。产生的光电流经放大滤波后由USB-6008多功能采集卡采集,高压电源和LIF检测器均通过USB6008控制,用Labview编写的程序实现高压输出控制和电泳谱图的显示、存储、谱图积分等功能。
草甘膦(GLYP)、草铵膦(GLUF)和氨甲基膦酸(AMPA)购自德国Riedel-de Ha⊇n公司;异硫氰酸荧光素(FITC)购自Sigma-Aldrich公司;硼砂、羟丙基纤维素(HPC)购自上海Bio Basic公司;西兰花购于当地市场;其它试剂均为分析纯。
1.2 样品处理与衍生
称取5 g西兰花,用榨汁机榨汁,汁液静置1 min后取其上层清液,用0.45 μm的滤膜过滤,取滤液放入冰箱中保存待用。样品衍生参照文献[23]进行,衍生后立即进行微流控芯片电泳分析。
1.3 微流控芯片的制作
研究所用环烯烃共聚物(COC)微流控芯片均采用改进的金属丝热压法制作,详细制作流程参考文献[24],过程简要描述如下:①首先将COC片裁成6.0 cm×1.5 cm的长方形小片,然后依次用1 mol/L NaOH、1 mol/L HCl、超纯水清洗,于70 ℃烘箱中烘干;②将直径80 μm的细铜丝按预定的方式固定在载玻片上,把COC片放在铜丝上面,再盖一片载玻片,用3对长尾票夹对称夹紧固定,置于140 ℃的烘箱中加热25 min;③取出自然冷却使COC片与载玻片分开,将带有铜丝的COC片放入硝酸溶液中;④待铜丝完全溶解后,水洗,空气吹干,在COC片的适当位置打孔(直径3 mm),用超纯水和无水乙醇清洗;⑤将另一片COC片盖在通道上,并将这两片COC夹在两片载玻片中,于122 ℃烘箱中加热10 min完成两片COC的封接;⑥在打孔位置粘上储液池,并用COC的甲苯溶解液密封边沿,即可得到所需的微流控芯片。
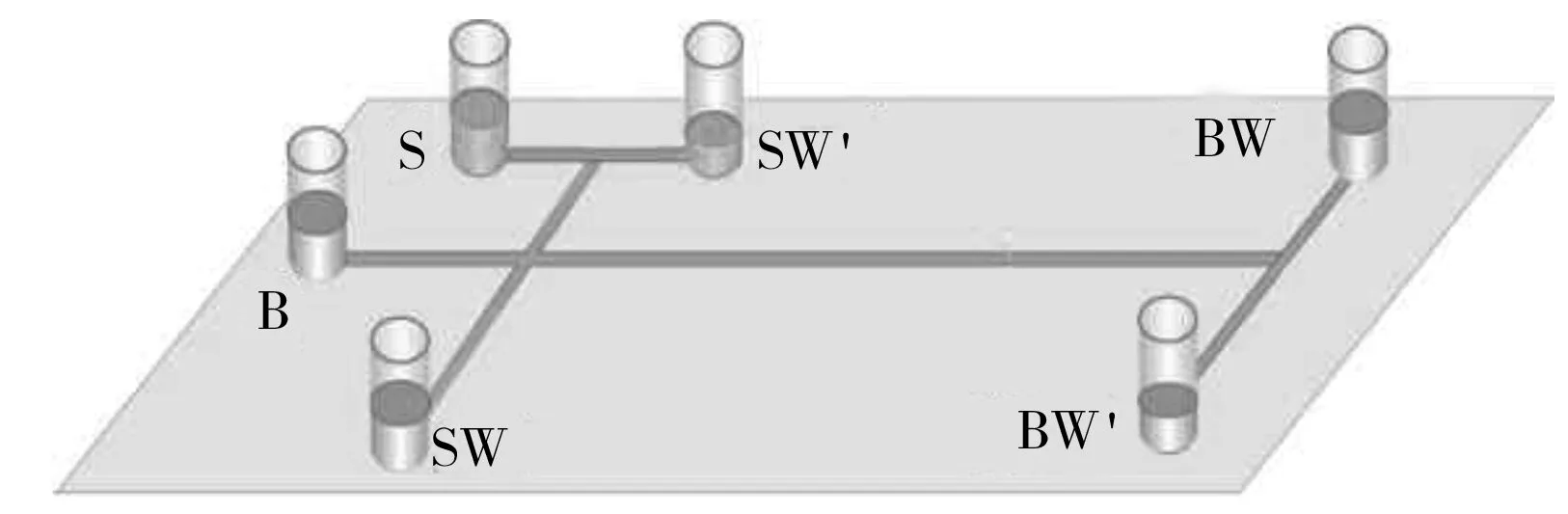
图1 具有分叉微通道结构的电泳芯片示意图Fig.1 Schematic diagram of a microchip with branched microchannels
1.4 微流控芯片电泳分离
微流控芯片(图1)的6个储液池分别标记为S(样品池)、SW(样品废液池)、SW’(额外的样品废液池)、B(缓冲液池)、BW(缓冲废液池)、BW’(额外的缓冲废液池),各液池中所加溶液体积分别为100、100、30、100、100、30 μL。进样阶段中,SW池加400 V电压,SW’池接地,B池和BW’池分别加140 V和80 V电压来限制样品区带的宽度。分离阶段,B池和BW’池的电压切换为0 V和1 800 V,实现电泳分离。同时,SW池和SW’池的电压切换为700 V和600 V,防止样品渗漏进入分离通道。
2 结果与讨论
2.1 微流控芯片微通道设计思路
Crabtree等[17]早在2001年就报道了压差引起的流动对微流控芯片电泳重现性的影响,Revermann等[18]详细讨论了微流控芯片电泳面临的问题和解决方法。仔细调整各储液池中的溶液体积、及时更换储液池中的溶液是提高微流控芯片电泳重现性的重要途径。由于电泳过程中各储液的液面会随时间变化,为保证分析结果的重现性,必须增加溶液更换的频次,这势必影响总的分析速度,也增加了微流控芯片电泳的操作难度,不利于其实际应用。夹切进样是一种理想的微流控芯片电泳进样方法,但存在进样时间长的问题。采用该方式连续进样分析时,进样阶段施加在分离通道出口端的夹切电压会将前次分离的分析物和样品基体推回分离通道检测位点,导致基线异常抬升,影响分析重现性。
为解决这些问题,本研究在进样通道和分析通道末端引入了分叉结构,增加了额外的样品废液池和缓冲废液池(图1)。基本思路是SW’和BW’仅加入少量溶液(30 μL),借助S和SW’、BW和BW’之间的液面差来维持连续流动,4根电极分别加在B、BW’、SW、SW’储液池中。溶液流向如图2所示,在进样阶段,由于电场的作用样品从S与SW’之间的分叉点进入进样通道流向SW,而S和SW’的液面差阻止了SW’中的溶液回流,分叉点始终为新鲜样品(未被稀释也未受电解影响)。同样,BW的BW’的液面差也阻止了BW’中的溶液进入分离通道,防止多次进样分离后废液池中的样品在进样时被夹切电压反推进入分离通道引起基线的异常抬升。分离阶段,在电场的作用下样品区带从进样十字进入分离通道向缓冲废液池迁移,由于BW和BW’的液面差,使得分离过程中的废液全部流向BW’,保证了分离通道末端始终为新鲜缓冲溶液。S和SW’之间分叉点的显微荧光照片显示,在进样阶段样品可以稳定进入进样通道,而分离阶段样品不会进入进样通道(图3)。需要说明的是,S和SW’之间的流动不会显著增加样品的消耗(测量得出的S和SW’之间样品的流速仅为3.6~5.2 μL/h)。
采用具有分叉结构微通道的芯片进行电泳分离,多次重复进样未观察到基线抬升的现象,说明这种芯片通道设计可行。
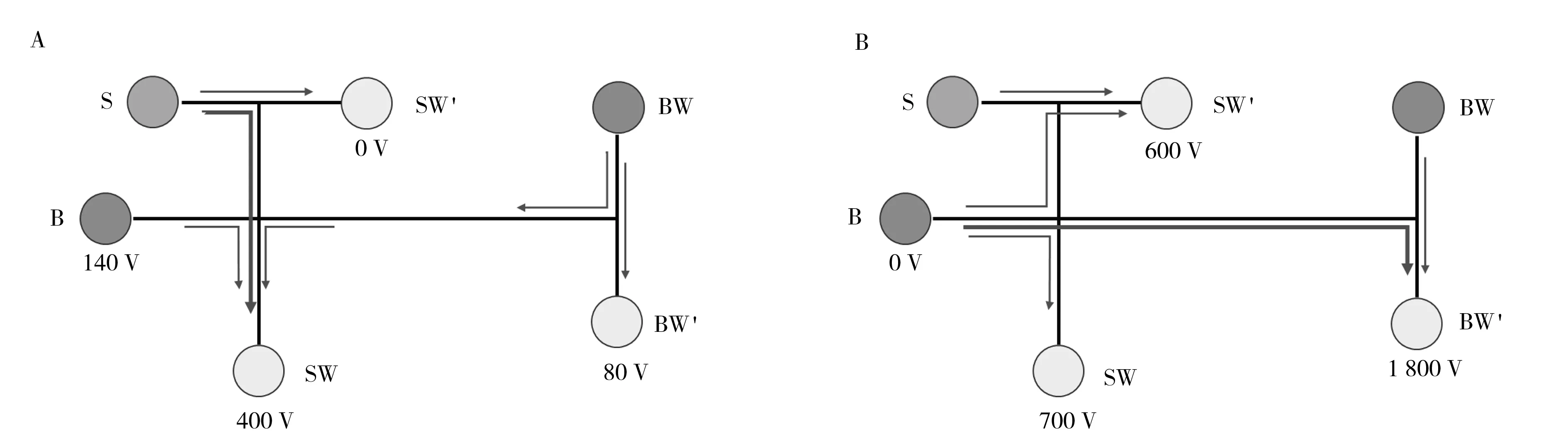
图2 进样(A)和分离(B)阶段通道内的溶液流向示意图Fig.2 Schematic diagram of flow direction during injection(A) and separation(B) phases
2.2 进样时间与进样通道长度的影响
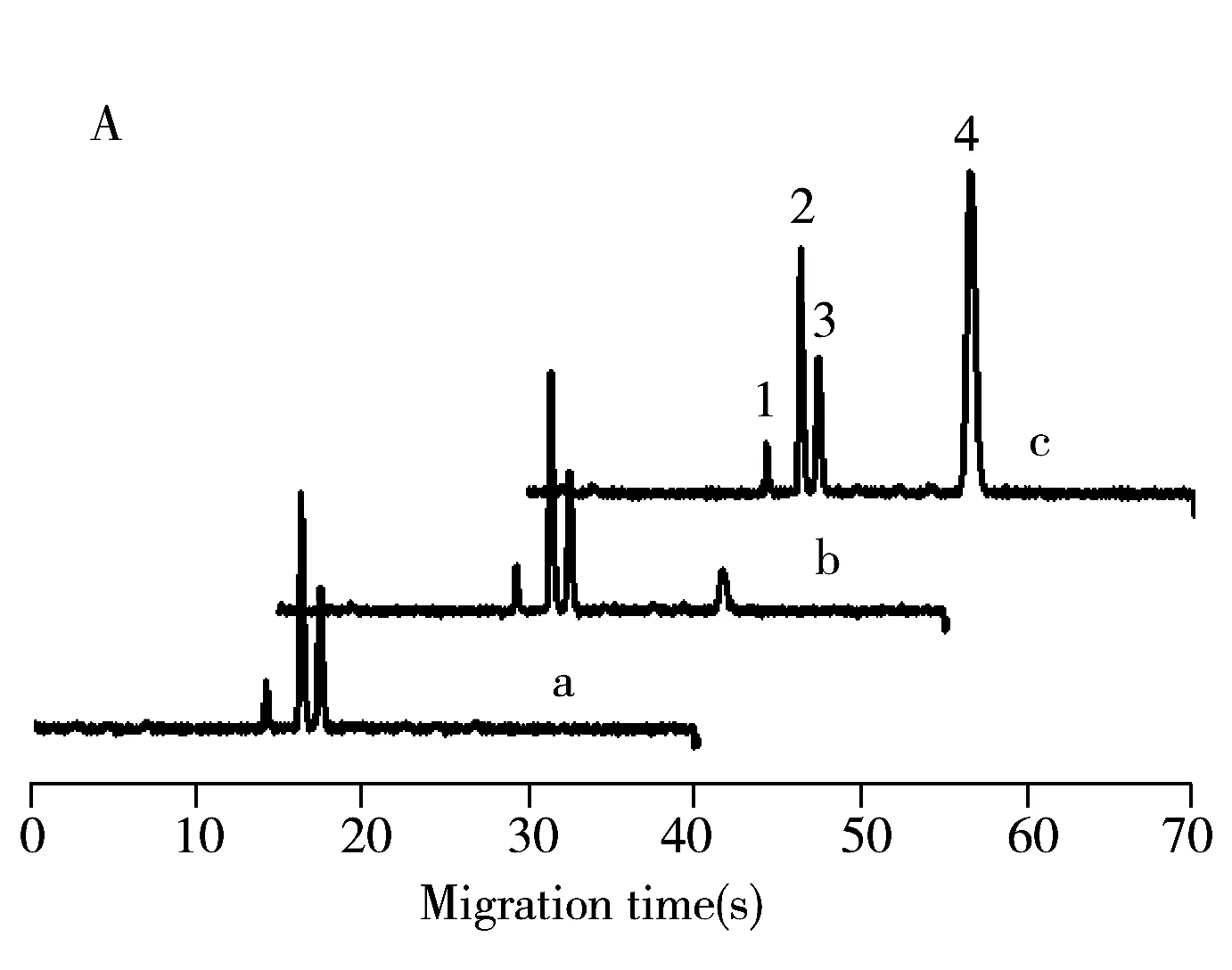
以FITC标记的有机磷除草剂及其降解产物为模型,在带有分叉结构微通道的芯片上,考察了进样时间对出峰个数的影响(图4A)。结果显示,进样时间为30 s时即可保证3种除草剂出峰,进一步延长进样时间衍生试剂FITC的峰才会出现,这意味着可通过控制进样时间来达到简化谱图的目的。为了进一步证实利用该方法简化谱图的可行性,采用FITC衍生的西兰花汁液作为样品,在同样条件下测试了进样时间的影响(图4B),发现进样时间为45 s时,样品中大量的基体物质进入分离通道出峰,谱图非常复杂,进样时间为35 s时谱图相对简单,进样时间为30 s则仅有3种有机磷化合物的峰。因此通过选择合适的运行缓冲介质,尽可能使待测组分在前面出峰,同时控制进样时间,可以达到简化谱图的目的。这样也避免了大量样品基体进入分离通道,减小了分离通道污染的可能性。
将LIF检测位点置于进样通道时所获得的谱图也证实了这一点,对于FITC衍生的3种有机磷混合物,谱图呈现两个明显的平台,说明进样通道中发生了分离(迎头模式)(图5)。
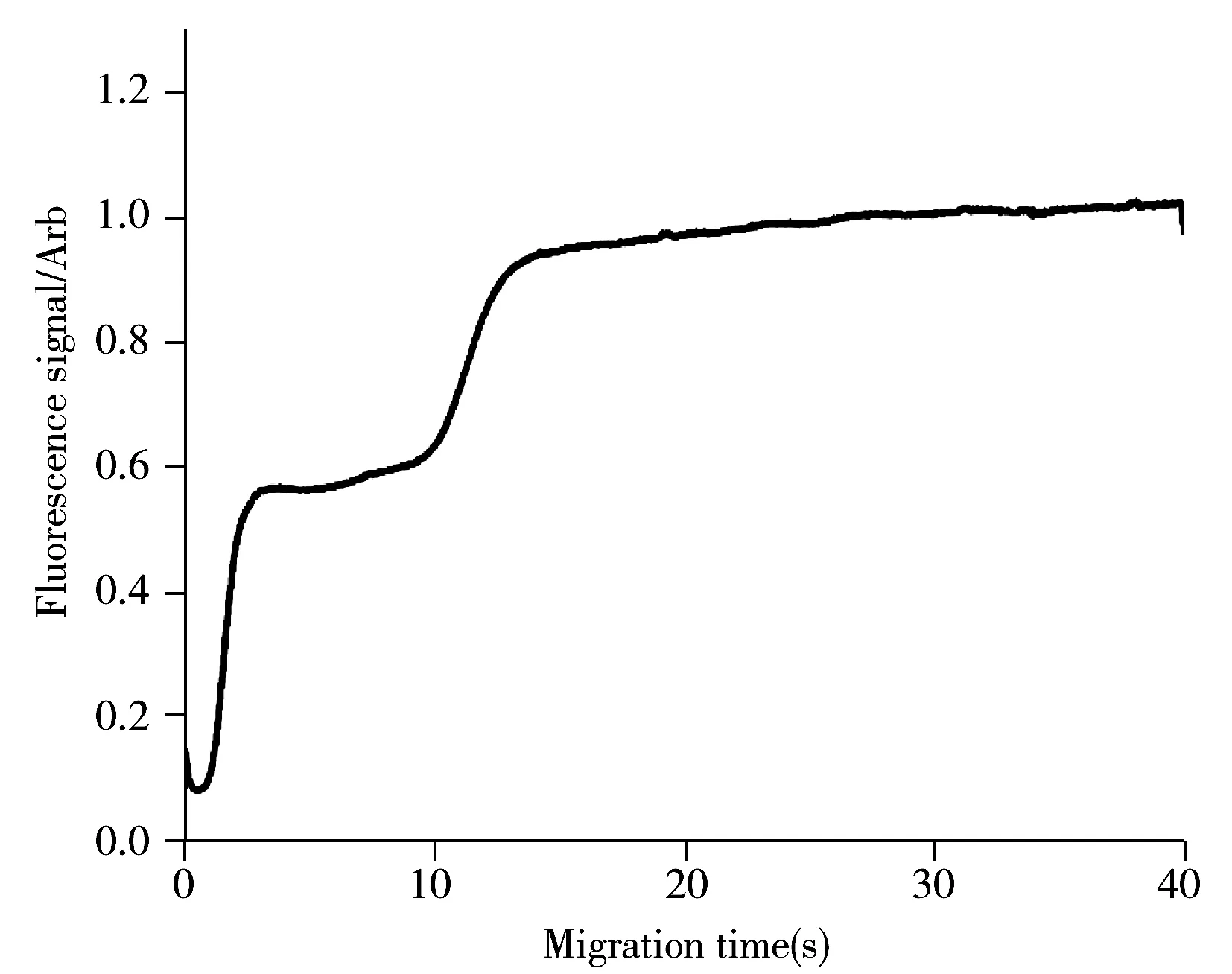
图5 进样通道检测信号Fig.5 Fluorescent signal detected at the sampling microchannelsample:FITC labeled GLYP,AMPA and GLUF;detected at a point of 0.4 cm from the cross
实验还考察了进样通道长度(从分叉点到十字)为0.5、0.8、1.0、1.3、1.5 cm的微流控芯片的分离效果,发现不同长度的微流控芯片均可实现简化谱图的目的,使用时可灵活选择。S池及SW’池至分叉点的距离相等,均为1 cm,受储液池布局限制,未尝试其它长度。
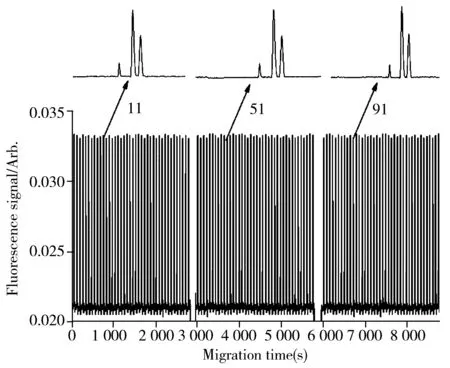
图6 连续进样分离120次的电泳谱图Fig.6 Electropherograms of a consecutive injection and separation of organophosphorus herbicides(n=120)analytes are same as those in Fig.4;insert:enlarged electropherograms of 11,51 and 91st injection
2.3 重复性
采用这种具有分叉结构的微流控芯片时,由于电极放置在BW’池,既使长时间运行也不会因电解产物影响分离通道中运行缓冲液组成,这有利于提高电泳分析的稳定性。实验证实采用该芯片可以至少进行40次连续进样分析,40次后更换各储液池中的溶液,即可开始下一轮连续测定。图6是120次连续分析的谱图,以氨甲基磷酸的峰高计算得到的相对标准偏差(RSD)为0.56%。在本实验条件下,每运行40次更换溶液的原因是研究所用微流控芯片的储液池体积较小(150 μL),缓冲液池中的电解会改变运行缓冲液的pH值,溶液的挥发也会改变缓冲液浓度,因此采用更大的缓冲液池应该能够增加稳定连续进样的次数。
3 结 论
本研究在进样通道和分离通道末端引入分叉结构,增加额外的样品废液池和缓冲废液池,并在样品池与额外的样品废液池、缓冲废液池和额外的缓冲废液池之间维持一定的液面差,保持进样通道和分离通道末端溶液的持续更新,可有效缩短多次连续进样分离时的进样时间,消除基线异常抬升等问题,显著改善了夹切进样微流控芯片电泳连续进样分析的重现性。由于电极置于额外的样品废液池,避免了电解对样品的影响。对于待测物提前出峰的情况,还可以通过控制进样时间来避免大量的样品基体成分进入分离通道,减小了分离通道污染的可能性,简化了谱图。方法可提高微流控芯片电泳的可靠性,对促进其实际应用有一定的参考意义。
