组氨酸激酶HK853酸碱调控机制的NMR研究
2019-05-22吉仕夏刘乙祥姜红鹰李从刚刘买利
吉仕夏,刘乙祥,姜红鹰,李从刚,姜 凌*,刘买利*
(1.中国科学院生物磁共振重点实验室,波谱与原子分子物理国家重点实验室,武汉磁共振中心(中国科学院 武汉物理与数学研究所),湖北 武汉 430071;2.中国科学院大学,北京 100049)

图1 组氨酸侧链基团在蛋白酶催化反应过程中的作用Fig.1 The role of the histidine side chain group in the process of protease catalysisA.balance of different protonation states of histidine side chains;B.crystal structure of complex at pH 8.0(dark,PDB:3DGE) and pH 5.0(light,PDB:5HUT),respectively,where in the CA domain of HK853 is in purple,the DHp domain of HK853 in cyan,and RR468 in green[13-14](A.组氨酸侧链不同质子化态的平衡;RR468复合物分别在pH 8.0(深色,PDB:3DGE)和pH 5.0时的晶体结构(浅色,PDB:5HUT),其中紫色为HK853的CA结构域,青色为HK853的DHp结构域,绿色为RR468[13-14])
双组分信号转导系统( Two-component signal transduction system,TCS)是细菌感知和响应周围环境的主要手段[1],细菌的绝大多数生理过程(例如感知渗透压[2]、营养元素的代谢[3]、细胞壁的合成、细胞的增殖和分裂[4]等)都受到双组分系统的调控。双组分信号转导系统在细菌中广泛存在,平均每个物种有超过20个双组分系统,一些真菌和植物中也发现了双组分系统,但是目前为止尚未在人类和其他哺乳动物中发现它的存在[5-6]。双组分系统也被认为是一种潜在的抗菌药物靶点,正确认识其生物作用/功能的分子机制,有利于为日趋严重的细菌耐药性问题提供新的抗菌药物靶点[7],为对抗相关疾病提供新的潜在的方向。
双组分信号转导系统主要由两类蛋白组成:组氨酸激酶(Histidine kinase,HK)和应激调节蛋白(Response regulator,RR)[8]。HK蛋白由膜外的Sensor结构域、跨膜区、胞内的DHp结构域(Dimerization and histidine phosphotransfer domain)和 CA结构域(Catalytic and ATP binding domain)组成[6,9]。其中最为重要的结构域DHp是形成二聚体界面的核心区域,并且含有高度保守的组氨酸残基以实现磷酸转移。大多数HK蛋白具有多功能性,不仅能实现自身磷酸化并传递磷酸基团给RR蛋白,还能介导催化RR蛋白的去磷酸化[10-12]。笔者在前期研究中发现,HK853的磷酸酶功能受pH值调控,在不同pH值条件下,HK853胞内全长蛋白(HK853cp)与底物RR468的复合物晶体结构不同,特别是参与去磷酸化反应的His260残基的咪唑侧链空间位置发生变化(图1B)[13-14]。组氨酸的咪唑侧链在催化反应中常通过不同的质子化状态灵活调控反应进程(图1A),但是受限于晶体结构的分辨率,关键残基His260在催化去磷酸化反应时的质子化状态并不清晰。由于蛋白复合物的分子量超过80 kDa,普通的同位素标记方法无法获得可分辨的NMR信号,本研究对DHp结构域的组氨酸残基侧链采用选择性标记的方法,获得了清晰的NMR信号,有利于运用核磁共振方法研究His260侧链的质子化状态,阐明HK853行使磷酸酶功能时的酸碱调控机制。
1 实验部分
1.1 表达与纯化
1.1.1 HK853cp、HK853DHp及RR468的表达13Cε1-His选择性标记的蛋白的表达,需将HK853cp或其突变体(H260A、H301A、H347A、H419A、H456A)、HK853DHp或其突变体(H259A、H260A、H301A)的质粒转化至组氨酸缺陷型大肠杆菌菌株BL21(DE3)-His-中[15],于LB固体培养基中37 ℃过夜培养后,接种至5 mL LB培养基中37 ℃过夜培养,再转移至添加了非标记的组氨酸、酪氨酸、苯丙氨酸和色氨酸的M9培养基中,37 ℃培养至OD600达到0.8~1.0,然后转移至新的添加了13Cε1标记的组氨酸和非标记的酪氨酸、苯丙氨酸和色氨酸的M9培养基中,加入终浓度为0.5 mmol/L的异丙基硫代半乳糖苷(IPTG),于20 ℃诱导表达10 h,6 000 r/min离心10 min收菌,菌体保存于-20 ℃冰箱。
非标记的RR468的表达,需将RR468的质粒转化至大肠杆菌BL21(DE3)中,并于LB固体培养基中37 ℃过夜培养,然后接种至LB培养基中,37 ℃培养至OD600达到0.6~0.8,加入终浓度为0.5 mmol/L的IPTG,于20 ℃诱导表达16~20 h,6 000 r/min离心10 min收菌,菌体保存于-20 ℃冰箱。
1.1.2 HK853cp、HK853DHp及RR468的纯化HK853cp的纯化:将菌液超声破碎,20 000 r/min离心30 min,取上清液加入40%的硫酸铵使蛋白沉淀,20 000 r/min离心30 min,沉淀重悬后于65~70 ℃加热30 min,除去部分杂蛋白,20 000 r/min高速离心后留取上清。样品液用0.22 μm滤膜过滤后,上样至QFF离子交换柱(缓冲液为Buffer A和Buffer B,见表1),以15%~50%体积分数的Buffer B进行梯度洗脱,收集目标蛋白并浓缩样品液体积至5 mL以内;再用S-200分子筛柱(缓冲液为Buffer C)对蛋白进一步纯化,收集目标蛋白并浓缩样品液体积至5 mL以内;最后用脱盐柱去除盐离子(缓冲液为ddH2O)。分装蛋白并冻干,-20 ℃保存备用。
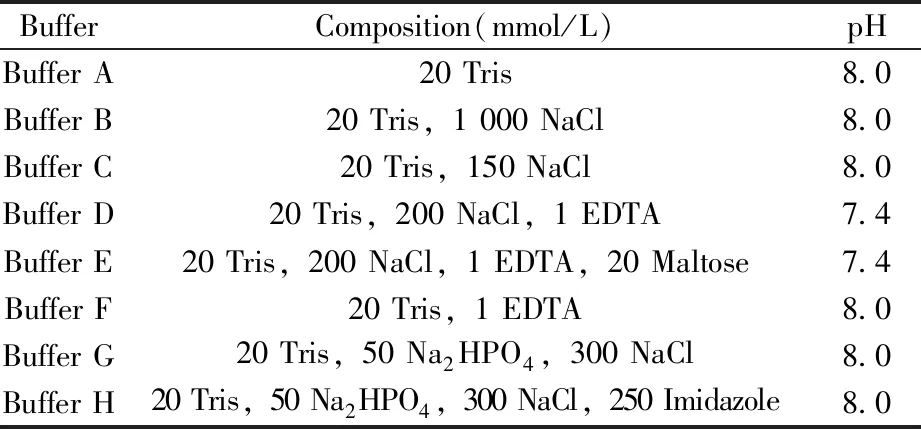
表1 蛋白质纯化的缓冲液配方Table 1 Buffer for mulation for protein purification
HK853DHp的纯化:将菌液超声破碎后,20 000 r/min离心30 min,取上清液用0.22 μm滤膜过滤,上样至MBP标签亲和柱(缓冲液为Buffer D和Buffer E),Buffer D冲洗至紫外吸光光度值达到基线值后,用Buffer E洗脱,收集目标蛋白并浓缩样品液体积至5 mL以内;用Buffer F作缓冲液经脱盐柱脱盐后,再用Buffer F透析24 h,除去NaCl和麦芽糖(NaCl和麦芽糖会影响TEV酶切效率);加入TEV酶25 ℃下酶切过夜,切除MBP标签;用Buffer D透析4 h后,过MBP柱层析(缓冲液为Buffer D和Buffer E)分离除去MBP标签蛋白;然后进行镍柱层析(缓冲液为Buffer G和Buffer H),梯度洗脱(目标蛋白在12%Buffer H时洗脱)分离除去TEV酶;最后进行脱盐,再冻干保存备用。
RR468的纯化:将菌液超声破碎后于60 ℃加热30 min,除去杂蛋白,20 000 r/min高速离心后留取上清。样品液用0.22 μm滤膜过滤,上样至QFF离子交换柱(缓冲液为Buffer A和Buffer B)。用0%~30%体积分数的Buffer B进行梯度洗脱,收集目标蛋白并浓缩样品液体积至5 mL以内;再用S-100分子筛柱(缓冲液为Buffer C)对蛋白进一步纯化,收集目标蛋白并浓缩样品液体积至5 mL以内;最后用脱盐柱去除盐离子(缓冲液为ddH2O)。分装蛋白并冻干以备用。
1.2 去磷酸化功能实验
1.2.1 RR468磷酸化样品的制备将6 mg/mL的RR468蛋白与12.5 mmol/L的乙酰磷酸在含20 mmol/L Tris(或NaAc)、100 mmol/L NaCl、10 mmol/L MgCl2的缓冲液中混合,于25 ℃下反应1 h;然后在同样的缓冲液体系下进行脱盐柱层析,除去多余的乙酰磷酸,得到磷酸化的RR468蛋白;最后分装蛋白,并于-20 ℃下保存备用。分别在不同pH值的缓冲液中反应,可制得不同pH值环境下的磷酸化RR468样品。
1.2.2 不同pH值下HK853的去磷酸化速率比较将P~RR468(磷酸化的RR468)与HK853DHp蛋白按照物质的量之比10∶1的比例混合,在4 ℃下反应,间隔不同时间取样,时间间隔分别为0、5、10、20、40、60、90 min,另外设置不加入HK853DHp的P~RR468为对照组并同时取样,用液氮速冻终止反应,然后利用Phos-Tag凝胶电泳实验表征反应结果。
1.3 核磁共振实验
1.3.11H-13C HSQC实验1H-13C HSQC实验于Bruker Avance 700 MHz核磁共振谱仪上完成。将冻干的HK853cp或HK853DHp蛋白样品溶于含有20 mmol/L HEPES(4-羟乙基哌嗪乙磺酸)、50 mmol/L KCl、10 mmol/L MgCl2和10%D2O的缓冲溶液中,复合物样品则额外加入5 mmol/L BeCl2、50 mmol/L NaF和略过量的RR468,蛋白终浓度为0.5~1.0 mmol/L,pH值调为7.0,实验温度为298 K。实验参数:F2(1H)和F1(13C)维谱宽分别设为7 002.801 Hz和1 760.892 Hz,采样数据点阵t2×t1=2 048×256,累加次数ns=16,弛豫等待时间d1=1.0 s。在pH滴定实验中,通过改变样品的pH值,采集相应pH值下的1H-13C HSQC谱。
1.3.21H-13C HSQC谱图的信号归属由于13Cε1-His选择性标记样品的谱图简单,信号少,本研究通过定点突变的方式对1H-13C HSQC谱图的信号进行归属。
信号归属实验于Bruker Avance 700 MHz核磁共振谱仪上完成,实验数据使用软件Bruker Topspin 3.2处理。将HK853cp的各个组氨酸位点分别突变为丙氨酸,得到突变体H260A-HK853cp、H301A-HK853cp、H347A-HK853cp、H419A-HK853cp和H456A-HK853cp,将HK853DHp的各个组氨酸位点分别突变为丙氨酸,得到突变体H249A-HK853cp、H260A-HK853cp和H301A-HK853cp。再采集各个突变体13Cε1-His选择性标记样品的1H-13C HSQC谱图。结合野生型和突变体蛋白的1H-13C HSQC谱图,对13Cε1-His选择性标记样品的1H-13C HSQC谱图进行信号归属。
2 结果与讨论
2.1 选择性同位素标记与信号归属

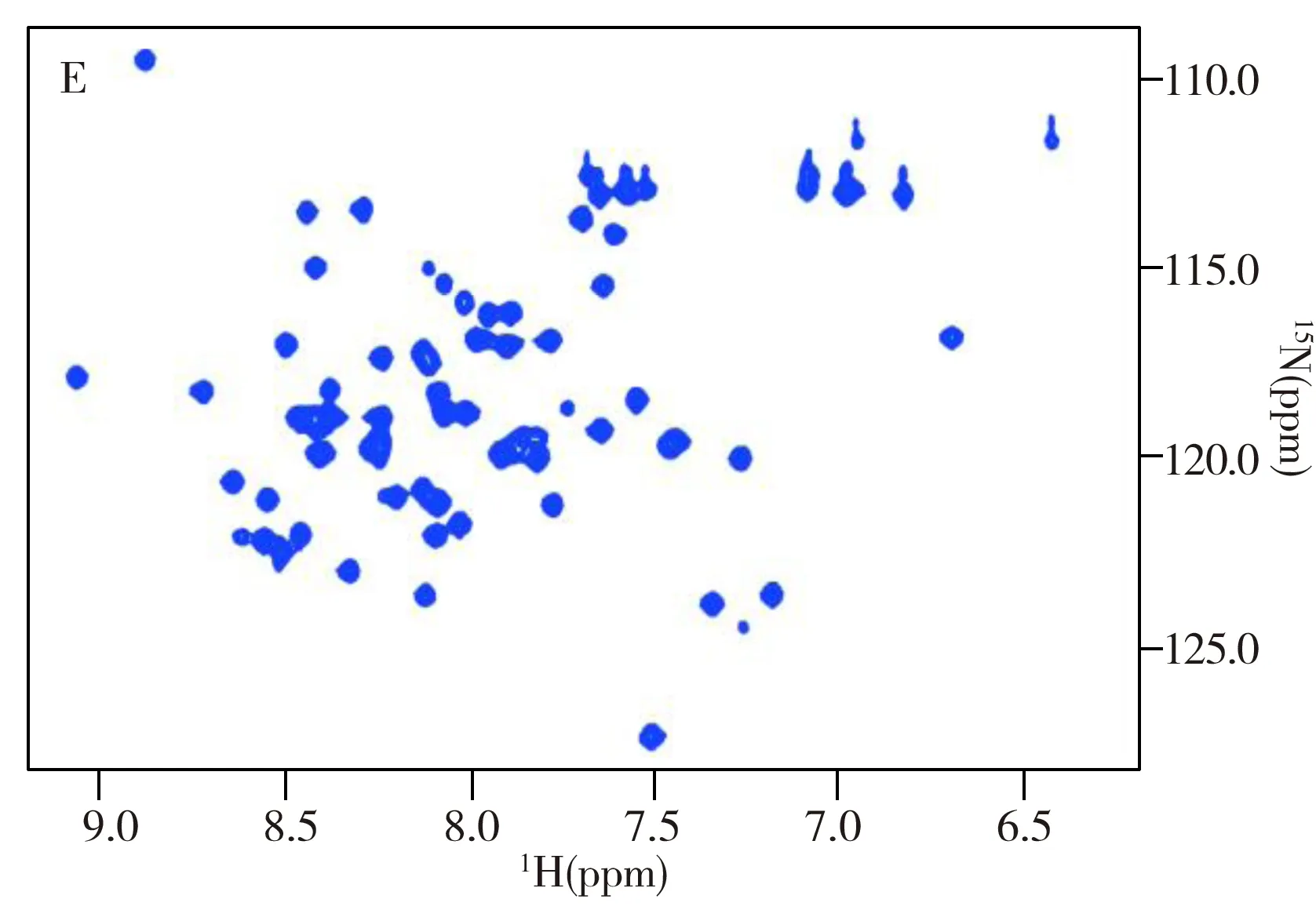
本研究对咪唑基团的Cε1位置进行选择性标记,并使用组氨酸缺陷型大肠杆菌菌株BL21(DE3)-His-以保障标记的顺利进行,减少交叉串扰。选择这一标记位点,是因为咪唑基团的质子化发生在Nε1和Nε2位点,Cε1与它们距离相近,对化学位移变化敏感,而且碳氢键十分稳定,不会受到溶液质子交换的影响,是理想的表征咪唑基团质子化程度的原子探针。通过氨基酸定点突变对HK853cp的1H-13C HSQC谱进行了信号归属和验证。HK853cp共含有5个组氨酸残基,谱图(图2A)下部的信号分别对应于HK853 DHp结构域的His301和His260位点,以及位于CA结构域Loop区的His419;谱图上部的信号分别对应CA结构域α-螺旋上的His456和His347(图2A)。其中His301、His260和His419在后续的pH滴定中均表现出化学位移变化,而His456和His347处于蛋白质的疏水内部,无法与溶液发生质子交换,因此在pH滴定中未表现出化学位移的变化。HK853的DHp结构域共含有2个组氨酸残基,分别为His301和His260(图2B)。需要指出的是,图2B中的His249是设计蛋白质纯化标签时额外引入的,TEV酶切后残留了一个组氨酸残基,不影响蛋白质的结构与功能。
2.2 pH滴定谱图
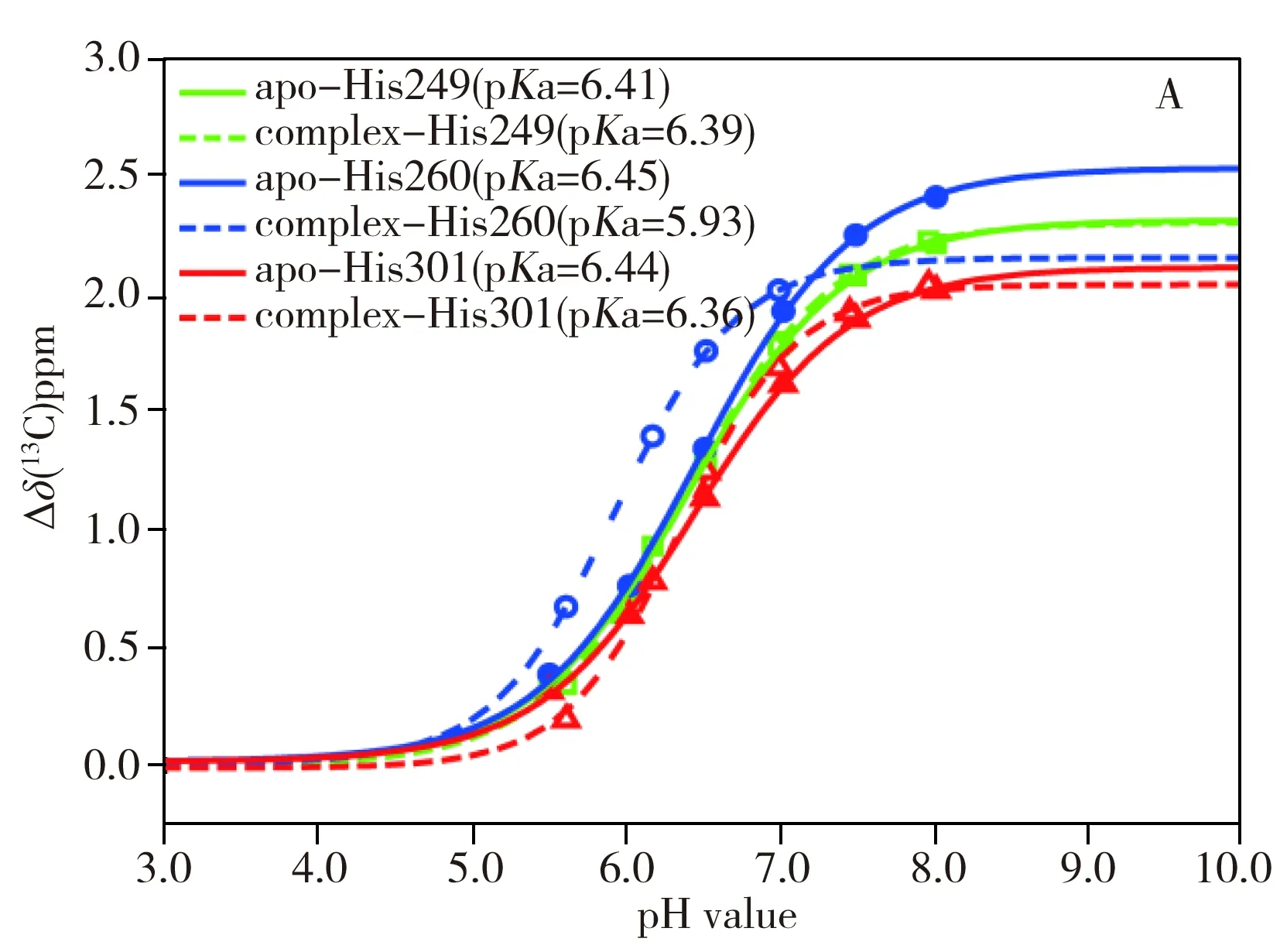
2.3 形成复合物对HK853 His260侧链pKa值的影响
酸度系数pKa是一种描述酸解离质子能力的物理量,其值越小说明解离出质子的能力越强。从图3A中可以看到,His249和His301两个组氨酸位点在形成复合物前后pKa值变化较小,说明复合物的形成对于两个位点几乎没有影响。His260位点的pKa值在形成复合物之后明显减小,响应明显异于其它位点。这是由于His260位点是HK853磷酸酶催化活性的关键位点,pKa对复合物的形成十分敏感,形成复合物前His260的pKa值为6.5左右,与其他组氨酸位点近似,而形成复合物后pKa值减小,意味着该咪唑侧链的质子更易于离去,pH值小于6.0时即大部分处于去质子化状态。
从图3B可以看到,无论是HK853的胞内全长(HK853cp)还是DHp结构域(HK853DHp),在形成类磷酸化复合物之后His260位点的pKa值都明显减小,变化趋势和变化幅度基本一致,说明具有磷酸酶活性的主要结构域为DHp。形成复合物之后His260咪唑侧链在中性条件下即处于去质子化状态,有利于催化底物的去磷酸化反应。


2.4 pH值对HK853磷酸酶活性的影响
根据上述测定的pKa值,通过HK853DHp的去磷酸化功能实验能够很好地说明pH值对HK853磷酸酶活性的影响。实验设计了4种pH值溶液条件(pH 5.0,6.0,7.0,8.0),将HK853DHp与底物P~RR468混合,在不同反应时间点取样,测定HK853DHp的去磷酸化能力。凝胶电泳出现上下两个条带,分别为P~RR468和RR468(图4)。由于P~RR468有自去磷酸化的功能,所以每张胶图的右半部分都用未加HK853的样品做对照(apo-RR468)。当反应溶液pH 值(5.0)小于His260的pKa时(图4A),HK853DHp不能明显加速底物P~RR468的去磷酸化;当pH 值(6.0)接近His260的pKa时,HK853DHp的催化能力加强,RR468条带渐深(图4B);当反应溶液pH值大于His260的pKa时(图4C,4D),底物P~RR468的浓度显著减少,apo-RR468的浓度显著增加,说明HK853DHp的催化能力大幅增强,而且,在pH 8.0时HK853DHp的去磷酸化速率比在pH 7.0时更快。

3 结 论
本文运用13Cε1选择性标记组氨酸侧链的咪唑基团的方法研究了HK853与底物形成复合物前后组氨酸残基侧链的pKa值,发现His260侧链在催化反应中呈现去质子化状态。蛋白质的酶活功能实验说明,不同的pH值下组氨酸激酶HK853的磷酸酶活性表现出显著差异,这可能是细菌通过双组分信号转导系统应对外界pH值变化的一个重要手段。在一般的组氨酸残基参与的蛋白酶催化过程中,组氨酸的pKa值大致为6.6~6.8[17],而在本实验结果中,形成复合物之前自由态的HK853cp和HK853DHp的pKa值比较接近这个范围,而形成复合物之后pKa值则下降到5.8~6.0。实验结果说明,当酶与底物形成复合物后,催化位点pKa值降低,即使在pH 6.0条件下His260咪唑基团也是以去质子态的形式存在,有助于磷酸酶活性的提高,有利于保证酸碱调控的效率。
上述结果进一步阐明了HK853组氨酸激酶的酸碱调控机制,为双组分信号转导系统调控机制的研究提供了新的数据。相对于常规标记方法无法有效解决的大分子量蛋白质体系,选择性标记是更好的选择,为大分子量蛋白之间相互作用的研究提供了新的思路。

图5 组氨酸激酶HK853的酸碱调控机制Fig.5 pH regulatory mechanism of HK853 investigated
