盐碱胁迫下一株促进苜蓿生长的细菌筛选与鉴定
2019-05-17向君亮唐呈瑞王佳琦张兴梅殷奎德
向君亮,唐呈瑞,王佳琦,刘 权,张兴梅,殷奎德
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319;2.中国科学院沈阳应用生态研究所,辽宁 沈阳 110016;3.黑龙江八一农垦大学农学院,黑龙江 大庆 163319)
土壤盐碱化严重制约着全球农牧业的发展,是当前亟待解决的问题之一。大庆地处松嫩平原西部,黑龙江省西南部,其盐碱化土壤主要为苏打盐碱化草甸土和沼泽化草甸土。据统计,大庆市共有盐碱化土地28.7万hm2,约占全市总土地面积的59.4%,其中耕地2.1万hm2,约占耕地总面积的20.9%,其余为牧业和其它用地。近年来,由于油田开发和其它人为因素的影响,土壤盐碱化现象呈明显加重趋势[1]。苜蓿被称为“牧草之王”,其不仅蛋白质含量高,产量大,耐旱、耐寒、耐盐碱胁迫能力强,还能够改善土壤环境,增加土壤含氮量,保持水土,在生态治理与恢复、高效优质畜牧业打造以及优化农业生产结构方面具有重要作用。有研究表明,苜蓿能在轻度盐碱地上种植,但随着草原以及耕地土壤盐碱化程度的加剧,可种植苜蓿的土地面积也逐渐减少[2]。
近年来,随着科技的发展,盐碱地的生物改良手段得到进一步应用。微生物改良盐碱地的实践,主要是利用对植物有促生作用的细菌在其根际定殖,改善植物根际环境,从而减轻盐碱胁迫对植物的生长抑制作用。植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)可以通过固氮、溶磷、解钾、产植物激素(IAA,GA等)、产ACC脱氨酶、产铁载体以及诱导植物对生物及非生物胁迫的系统抗性来促进植物生长[3-4]。大量研究表明,在应对非生物胁迫方面,根际有益微生物有增强植物耐受干旱胁迫、盐碱胁迫、重金属胁迫、养分亏缺等非生物胁迫能力。赵琦等[5]研究发现,混合盐碱胁迫下,接种丛植菌根真菌可以提高紫花苜蓿的存活率、株高、总生物量、可溶性蛋白质含量以及脯氨酸含量;张福海等[6]发现,施用耐盐碱促生菌剂后,能够显著提高盐碱环境下枸杞的产量及品质,枸杞枝条的生长、叶片叶绿素含量、产量、百粒重及果实多糖含量均显著增加;庞学兵等[7]研究表明,具有ACC脱氨酶活性的菌株能有效缓解盐碱胁迫对棉苗生长的抑制作用,提高棉苗对盐碱胁迫的抵抗能力。由于盐碱地土壤含盐量和pH值都较高,中性土壤中筛选得到的PGPR在盐碱环境中很难存活定殖,所以一些在中性土壤中有很好促生效果的菌肥在盐碱土中施用很难发挥促生作用。在大庆市大面积的盐碱地中,蕴藏着巨大的耐盐碱微生物资源,必将具有重要的应用价值。本研究从盐碱土壤中分离筛选鉴定耐盐碱菌株,并对其植物促生功能进行检测,为研制和开发能够治理盐碱土壤的生物制剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 盐碱土样品 本试验中的盐碱土样品于2017年9月采集于黑龙江省大庆市龙凤区未经人为破坏的盐碱地草原,轻度盐碱土采集于地表无白色碱斑,且植被覆盖度良好的地块,其pH值为8.34,含盐量为0.30%,速效钾、有效磷、碱解氮分别为398.00、19.20、315.00 mg·kg-1,有机质为33.70 g·kg-1;中度盐碱土样采集于地表有少量白色碱斑,且有稀疏植被覆盖的地块,其pH值为9.77,总含盐量为0.85%,速效钾、有效磷、碱解氮分别为334.00、17.75、59.00 mg·kg-1,有机质为7.50 g·kg-1;重度盐碱土采集于地表具有大量白色碱斑且无植被覆盖地块,其pH值为10.46,总含盐量为1.43%,速效钾、有效磷、碱解氮分别为257.00、56.80、56.00 mg·kg-1,有机质为1.72 g·kg-1;非盐碱土样于2017年9月采集于黑龙江省八五零农场水稻田,其pH值为5.58,含盐量为0.06%,速效钾、有效磷、碱解氮分别为114.10、113.20、223.60 mg·kg-1,有机质为31.40 g·kg-1;采样深度为地面0~20 cm,挑出枯草、草根及石块,混匀。
1.1.2 培养基 基础培养基参照Poli A等[8]的方法配制;筛选培养基[9]:在基础培养基中加入Na2CO3和NaHCO3使其终浓度分别为50、100 mmol·L-1,调节pH值至8.5;PKO无机磷培养基按照Gupta R等[10]的方法进行配制;阿须贝无氮培养基参照李艳星等[11]的方法进行配制;King氏培养基参照Glickmann E等[12]的方法进行配制;ADF培养基参照刘莎莎[13]的方法进行配制;CAS铁载体检测培养基参照荣良燕等[14]的方法进行配制。
1.1.3 植物种子 本试验使用的苜蓿品种为“敖汉”,种子由黑龙江八一农垦大学草业科学实验室提供。
1.2 方法
1.2.1 菌株的分离纯化 称取5 g土壤样品置于装有25 ml无菌水的三角瓶中,170 r·min-1振荡10 min,静置片刻,以此为原液,吸取上清液稀释10-4倍后涂于筛选培养基上。28℃培养1周后,挑取单菌落划线培养,传代至少3次,直至获得纯种,用50%甘油保存菌种,于-40℃冰柜中备用。
1.2.2 菌株的促生功能检测 分别参照Rani Gupta等[10]、李艳星等[11]、Eric Glickmann等[12]、刘莎莎[13]以及荣良燕等[14]的方法进行菌株解磷、固氮、产IAA、产ACC脱氨酶、产铁载体能力的定性检测;参照郑鹏[15]、詹寿发等[16]的方法对ACC酶活性以及IAA产量进行定量检测。
1.2.3 菌株16S rDNA序列分析 用“细菌基因组DNA提取试剂盒”提取菌株的总DNA后,利用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增其16S rDNA。PCR扩增体系为:2× Taq mix 25 μL,引物各1 μL,模板1 μL,ddH2O补至50 μL;反应条件:95℃ 5 min;94℃ 1 min-55℃ 1 min-72℃ 2 min,30个循环;72℃ 10 min。PCR产物用1%的琼脂糖凝胶电泳进行检测,然后利用PCR产物纯化试剂盒纯化,纯化后PCR产物送往生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI Blast进行序列比对,用MEGA 7做系统发育树。
1.2.4 种子的处理及幼苗生长 将菌株接种于基础培养基中,37℃,175 r·min-1振荡培养24 h后,10 000 g离心15 min,弃上清,沉淀用无菌生理盐水洗涤3次后重悬,菌悬液稀释至108CFU·mL-1,将苜蓿种子经表面消毒后,按表1的处理方法对种子进行处理,CK和B处理组分别为在非盐碱胁迫下生理盐水和菌悬液浸种,S和BS处理组为盐碱胁迫下生理盐水和菌悬液浸种,培养皿经封口膜封口后置于光照培养箱中25℃,12 h/12 h光/暗培养,培养3 d统计种子发芽势,培养5 d统计种子发芽率,培养25 d统计苗株高、根长和鲜重,用叶绿素仪测定幼苗叶片的SPAD值,SPSS 18.0进行统计分析,Origin 8.5作图。
2 结果分析
2.1 细菌分离结果
对非盐碱土、轻度、中度、重度盐碱土按1∶5制备土壤浸提液后,将土壤浸提液稀释,涂布于Na2CO3和NaHCO3终浓度分别为50、100 mmol·L-1,pH 8.5的筛选培养基上培养7 d后,各处理中耐盐碱细菌的种类和数量有所不同,如图1所示。在非盐碱土中,经过多次反复培养,筛选培养基上未生长细菌菌落,说明在本试验设定的盐碱条件下,非盐碱土中几乎没有可培养的耐盐碱细菌。轻度盐碱土中,培养基上生长出少量不同形态的菌落,随着盐碱土盐碱程度的加重,培养基上生长的菌落数与种类均有所增加,证明本筛选方法适用于耐盐碱细菌的筛选。通过筛选,共得到43株不同菌落形态的耐盐碱细菌,编号为S01-S43。
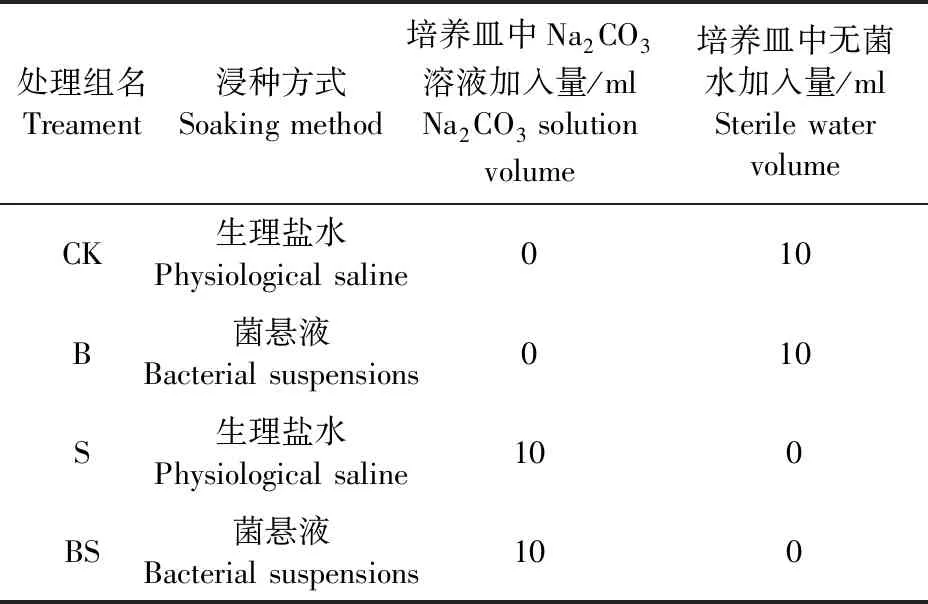
表1 苜蓿种子的处理方法
2.2 菌株促生功能鉴定
将分离得到的耐盐碱细菌分别接种于阿须贝无氮培养基、PKO无机磷培养基、CAS铁载体检测培养基、ADF培养基以及King氏培养基中,37℃培养,对菌株的促生功能进行检测,结果如表2所示(无促生功能的菌株已剔除):共有8株细菌能在阿须贝无氮培养基上生长,具有固氮能力;没有菌株能在PKO无机磷培养基上产生透明的溶磷圈,故所有菌株均无解磷能力;有6株菌能在CAS铁载体检测培养基上产生橘黄色的晕圈,具有产铁载体的能力;有3株菌能在ADF培养基上生长,具有产ACC脱氨酶的能力;有4株菌的发酵液上清能与S2比色液反应显粉红色,故仅有5株菌能产IAA。菌株S11虽然无固氮、解磷、产铁载体的能力,但其同时具有产ACC脱氨酶和产IAA的能力,且两种能力均强于其他菌株,而ACC脱氨酶可以降低植株体内乙稀含量,提高植物对盐碱胁迫的抗性,故选择菌株S11对其ACC脱氨酶活力以及产IAA量进行定量分析及后续试验;通过对菌株ACC脱氨酶的定量检测,结果显示:菌株S11的ACC脱氨酶活性为25.38 nmol·mg-1·h-1;如图2C所示,菌株S11在King培养基中培养,每隔12 h取培养液上清液测定其IAA产量,结果发现,0~36 h IAA产量增速最快,当培养到60 h时,IAA产量几乎稳定在24 mg·L-1左右,不再增长,故可以认为,菌株S11产IAA最佳培养时间为48~60 h,其IAA产量最大为24 mg·L-1左右。
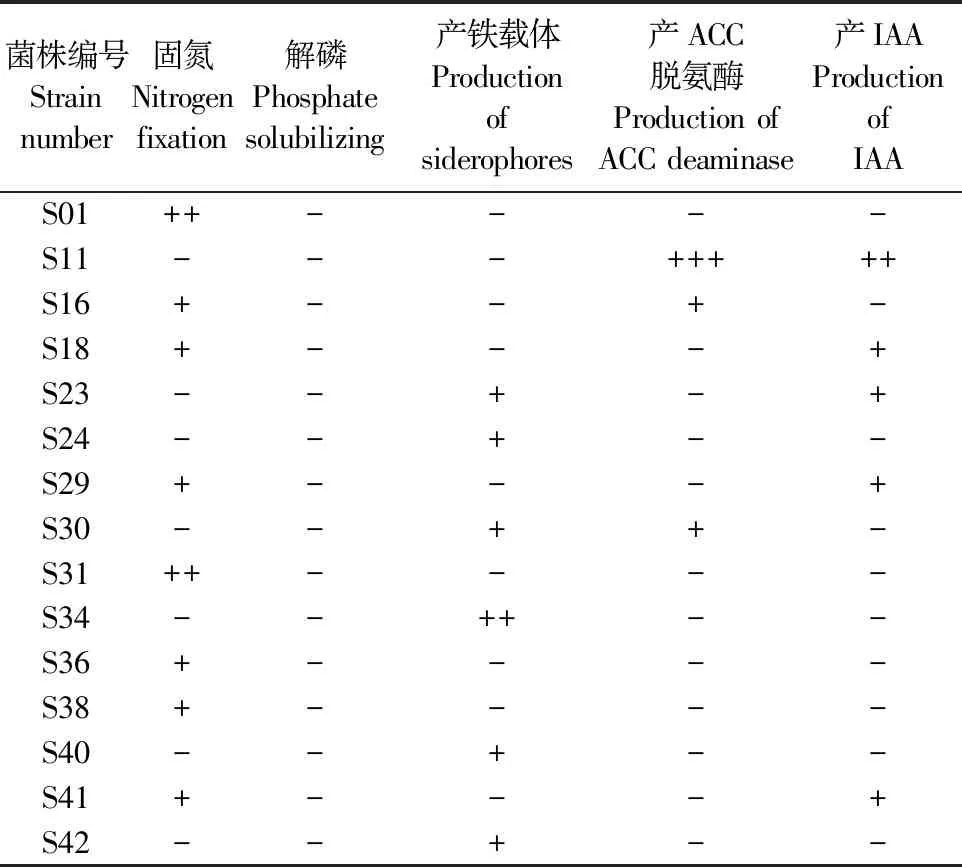
表2 各菌株所具有的促生功能情况统计表
注:“+”表示该菌具有此项功能,“+”的数量多少表示该功能的强弱;“-”表示该菌无此项功能。
Note: “+” indicates that the strain has this function, and the number of “+” indicates the strength of this function; “-” indicates that the strain has no such function.
2.3 细菌菌种鉴定
对具有较好促生功能的菌株S11的基因组DNA进行提取后,利用引物27F与1492R对其16S rDNA进行PCR扩增,纯化后对序列进行测序,所得序列长度为1 460 bp。将获得的序列片段在NCBI数据库中进行Blast序列比对分析,并挑选与该菌株16S rDNA序列最相似的模式菌株及其它不同种属的模式菌株,利用临近法在Mega 7.0软件上做系统发育树。如图3所示,菌株S11与模式菌株BacillushorikoshiiDSMZ8719T在同一分支上,遗传关系最为接近,其序列相似度为97.94%,其它序列相似度较高的菌株也均为芽孢杆菌属,所以初步判定S11为Bacillushorikoshii。
2.4 菌株S11对盐碱胁迫下苜蓿种子发芽及幼苗生长的影响
2.4.1 菌株S11对发芽率及发芽势的影响 将苜蓿种子在不同条件下进行处理后进行萌发试验,对不同处理条件下的苜蓿种子发芽势及发芽率进行统计,结果如图4所示,pH 8.5, 25 mM Na2CO3盐碱胁迫可以明显降低苜蓿种子发芽势和发芽率(P值分别为0.002和0.019),抑制苜蓿种子发芽,其发芽率仅为55.00%;菌悬液浸种接菌后,苜蓿种子的发芽率明显上升(P=0.043),达到70.00%,而CK组的发芽率为73.33%,菌株S11几乎消除了盐碱胁迫对种子萌发的抑制作用;与对照相比,在无盐碱胁迫下菌液处理后种子的发芽率无显著差异,表明菌液处理对种子的发芽率没有影响,但在盐碱胁迫下,苜蓿种子发芽受到抑制,接种菌株S11后能显著增强苜蓿种子对盐胁迫环境的耐受力,提高发芽率。

注:(A)为非盐碱土,(B)为轻度盐碱土,(C)为中度盐碱土,(D)为重度盐碱土。Note:(A) Non saline-alkali soil; (B) Mild saline-alkali soil; (C) Moderate saline-alkali soil; (D) Heavy saline-alkali soil.图1 不同程度盐碱胁迫下细菌生长情况Fig.1 Bacteria growth status in different degrees of saline-alkali stress
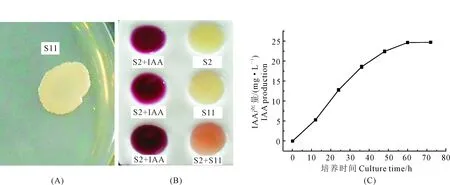
注:(A)产ACC脱氨酶定性检测结果;(B)产IAA定性检测结果,其中S2+IAA为阳性对照,S2为比色液,S11为菌株培养液上清液;(C)不同培养时间IAA产量。Note: (A) Production of ACC deaminase; (B) IAA production, S2+IAA is a positive control, S2 is a colorimetric solution, S11 is a culture supernatant of the strain; (C) IAA production at different culture times.图2 菌株S11促生功能鉴定结果Fig.2 Growth promoting function identification results of strain S11
2.4.2 菌株S11对幼苗生长的影响 幼苗在光照培养箱中培养25 d后,测定幼苗的根长、株高、鲜重以及叶绿素含量,结果如图5所示,非盐碱处理下浸种接菌后,幼苗的根长、株高以及叶绿素含量与对照相比无显著变化,但鲜重显著增加(P=0.000);与对照相比,在碱胁迫条件下,苜蓿幼苗的根长、株高、鲜重和叶绿素含量均显著降低,幼苗的生长受到了抑制;盐碱胁迫后接种S11,幼苗的根长、鲜重和叶绿素含量较盐碱胁迫下显著增加(P值分别为0.002,0.000和0.000);可见,芽孢杆菌S11可以缓解轻度盐碱条件对苜蓿幼苗生长的胁迫作用,促进幼苗生长。

图3 菌株S11系统发育树Fig.3 The phylogenetic tree of strain S11
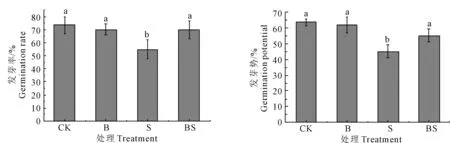
注:同一指标不同字母表示差异显著(P<0.05),下同。Note: The different letters in the same index mean significant difference atP<0.05, the same below.图4 不同处理对苜蓿种子发芽率及发芽势的影响Fig.4 Effects of different treatments on germination rate and germination potential of alfalfa seeds
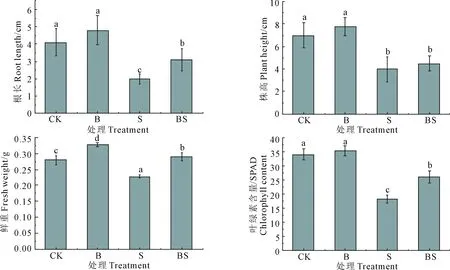
图5 不同处理对幼苗生理指标的影响Fig.5 Effects of different treatments on physiological indexes of seedlings
3 讨 论
植物根际促生菌(PGPR)是一类存在于植物根际周围,并且能够通过其自身特有的功能,如固氮、溶磷、解钾、产植物激素或ACC脱氨酶等直接或间接促进植物生长的微生物。从1922年Lipman等报道了小麦上的PGPR到现在,研究人员已分离出许多具有促生功能的细菌并制成了微生物菌剂应用于生产实践中[3]。大多数PGPR很难适应盐碱环境,难以存活,所以普通生物菌肥在盐碱地应用起来具有很大难度。本试验从大庆地区盐碱草原土壤中分离得到了一株耐盐碱菌,经过促生功能检测,其具有产植物激素IAA及ACC脱氨酶功能,我们在前期研究中发现,菌株S11能在0.3~3 mol·L-1Na+浓度,pH 8.0~11.5的环境下生长,而大庆地区轻度盐碱土的pH值在8.5左右[14],故判断菌株S11对大庆地区的盐碱土具有良好的适应能力,具有一定的应用价值。
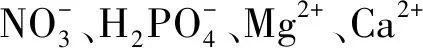
乙烯是植物体内合成的一种重要激素,可以帮助植物种子打破休眠,促进植物的成熟与衰老[21]。当植物遇到逆境胁迫时,其乙烯的合成量会显著增加,这就直接导致了植物的衰老。细菌产生的ACC脱氨酶可以帮助植物分解掉乙烯的合成前体ACC,将其代谢成α-丁酮酸和氨,并将其作为碳氮源利用,供应细菌生长需求,这样,一方面使其不断向体外分泌ACC,降低了植物体内的ACC含量从而减少乙烯的合成量,减轻了盐碱胁迫下乙烯对植物的毒害[22],提高了植物对环境胁迫的耐受力;另一方面细菌从ACC的分解产物中获得生长所必需的碳氮源,使得这个共生关系良好地被维持着。
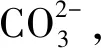
吲哚乙酸(IAA)是植物体内普遍存在的天然生长素,低浓度的IAA可以促进主根伸长,高浓度的IAA能促进侧根的形成和根毛的增加,菌株分泌一定量的IAA可以有效地促进植物根系新陈代谢,有助于植物吸收土壤中的营养。IAA有多种合成途径,其最主要的是色氨酸途径[26]。本试验在含有色氨酸的King培养基中培养菌株,经检测,其能产生IAA,最大产量在24 mg·L-1左右。盐碱胁迫下,苜蓿幼苗根的生长受到明显抑制,其根长较正常条件下下降43.90%,而在接种菌株S11后,幼苗根长所受到的抑制作用明显得到缓解,根长较盐碱胁迫下增加了34.78%,这可能是因为菌株产生了少量的IAA,低浓度的IAA可以促进植物根的伸长,从而缓解了盐碱胁迫对根的抑制作用;在接种菌株后,幼苗株高相对于盐碱胁迫下变化不显著,这和前人报道的IAA对根的影响大于茎的结果相符合,也侧面验证了菌株产生的IAA缓解了盐碱胁迫对幼苗生长的抑制作用,增强了苜蓿的耐盐碱能力。菌株S11对苜蓿的具体促生机理以及菌株的耐盐碱机理还有待于进一步研究。
4 结 论
本研究从大庆草原盐碱土壤中分离得到一株具有产植物激素IAA及产ACC脱氨酶功能的菌株,初步鉴定为堀越氏芽孢杆菌(Bacillushorikoshii);在盐碱胁迫条件下,接种菌株S11后能显著增加苜蓿种子的发芽率、发芽势、根长、株高、鲜重以及叶绿素含量,缓解盐碱胁迫对苜蓿的抑制作用,促进苜蓿生长。
