脊髓髓内神经鞘瘤的显微微创治疗*
2019-05-10林国中马长城王振宇谢京城陈晓东
林国中 马长城 王振宇 谢京城 刘 彬 陈晓东
(北京大学第三医院神经外科,北京 100191)
神经鞘瘤起源于Schwann细胞,是椎管内常见肿瘤,好发于髓外硬膜下,也可位于硬膜外,脊髓髓内神经鞘瘤非常少见,文献报道较少,多为个案报告[1]。我科2005年1月~2017年12月共收治16例脊髓髓内神经鞘瘤,经显微微创手术治疗,效果较好,现报道如下。
1 临床资料与方法
1.1 一般资料
本组16例,男10例,女6例。年龄18~76岁,平均41.38岁。病程1~5.5年,平均2.4年。
临床表现:相应神经支配区疼痛12例,以中度刀割样或电灼样疼痛为主;肿瘤所在节段以下感觉障碍(麻木)12例;肢体无力11例。首发症状为疼痛10例,麻木3例,肢体无力3例。9例具有上述2~3种症状,其中截瘫2例,伴二便功能障碍(尿潴留,排便困难)。
体格检查:针刺觉减退12例,肌力下降11例(0级1例,Ⅰ级1例,Ⅱ级1例,Ⅲ级2例,Ⅳ级6例),肌肉萎缩3例,肌张力增高9例,腱反射亢进和(或)病理征阳性11例。
影像学检查:均行MRI检查。肿瘤位于颈脊髓9例,颈胸交界区3例,胸脊髓4例。肿瘤在T1WI上表现为等或稍长T1信号,在T2WI上表现为等或稍长T2信号。2例完全位于髓内,增强扫描为实性明显强化结节;其余14例为髄内外病变(图1),其中2例为实性结节,增强明显强化,12例有囊性变,增强扫描不均匀强化。肿瘤位于脊髓的腹前外侧3例,背外侧13例。肿瘤长度0.5~2.5 cm。
术前诊断神经鞘瘤11例,室管膜瘤4例,星形细胞瘤1例。术前McCormick分级[2]Ⅰ级5例,Ⅱ级6例,Ⅲ级2例,Ⅳ级1例,Ⅴ级2例。
1.2 手术方法
气管内插管,全凭静脉麻醉,头低俯卧位。接电生理监测,包括体感诱发电位(somatosensory evoked potential,SEP),运动诱发电位(motor evoked potential,MEP)和肌电图(electromyography,EMG)。C形臂X线机透视定位,以肿瘤为中心设计切口,需完全显露肿瘤的头尾两极。将棘突椎板复合体整体取下,硬脊膜切开并悬吊,导入显微镜。
对于完全位于髓内的神经鞘瘤,硬膜切开后可看到扩张的脊髓,可借此确定肿瘤的位置。如定位存在困难,可行术中B超。以病变为中心,严格后正中切开脊髓,根据肿瘤的长度决定切开范围。见到肿瘤后,先瘤内分块切除肿瘤,缩小肿瘤体积。沿肿瘤与脊髓的边界锐性分离并切除肿瘤。遇到出血,可用明胶海绵及脑棉片轻压止血,如不满意,可用小功率双极电凝止血。处理肿瘤腹侧时,注意避免损伤脊髓前动脉。
对于髓内外肿瘤(图2),切开硬膜后一般即可看到肿瘤。先切除髄外肿瘤。如果肿瘤髓内部分较小,可沿肿瘤与脊髓的边界锐性游离,直至完整切除肿瘤;如果肿瘤髓内部分较大,可先瘤内切除部分肿瘤,再沿边界切除肿瘤。尽可能避免切开脊髓。
2010年后的9例将棘突椎板复合体原位回植,钛钉钛板固定。
术后给予神经营养等治疗,必要时辅以康复训练。术后1、3、6个月及1年复查,采用McCormick分级评价脊髓功能,并做MRI,如无异常,可间隔2~3年复查一次,如出现术前类似症状或体征,复查MRI,判断是否有复发(异常强化的肿物)。
2 结果
手术时间2~4 h,平均3.2 h;术中出血量20~300 ml,平均108.8 ml。术中5例SEP报警,1例MEP报警,适时终止该部位操作,手术结束时均恢复正常。术中3例EMG报警,暂停操作后恢复,手术结束时均无肌电爆发。16例肿瘤均全切(术中及术后1个月MRI证实,图3)。术后清醒后检查,10例有新发神经症状,包括3例肌力较术前减退(术前Ⅲ级1例,Ⅳ级2例,术后Ⅱ级1例,Ⅲ级2例),5例下肢深感觉轻度减退,9例肿瘤所在节段以下针刺觉较术前轻度减退。术后病理均证实为神经鞘瘤(图4)。均无伤口感染、脑脊液漏。
随访6个月~7年,中位数3年,复查MRI,均未见肿瘤复发。按McCormick分级,术后除2例截瘫患者从Ⅴ级恢复到Ⅲ级外,其余15例均为Ⅰ级。①术后新发症状情况:3例术后肌力较术前减退者,术后3个月恢复至术前水平,6个月恢复正常;5例术后出现深感觉障碍者,6个月后基本恢复正常;9例针刺觉较术前减退者,6个月后5例基本恢复正常,4例恢复至术前水平。②术前症状情况:12例疼痛症状术后1个月均完全缓解。12例术前感觉减退者中7例完全恢复,5例残余轻度感觉减退。11例术前肌力减退者中7例恢复正常,4例仍有肌力下降,其中2例截瘫患者可拄拐行走(1例术后肌力由术前的Ⅰ级恢复至Ⅲ级,6个月恢复至Ⅳ级,1例术后肌力由术前的0级恢复至Ⅱ级,1年恢复至Ⅳ级,二便虽费力,但均可自行排出)。
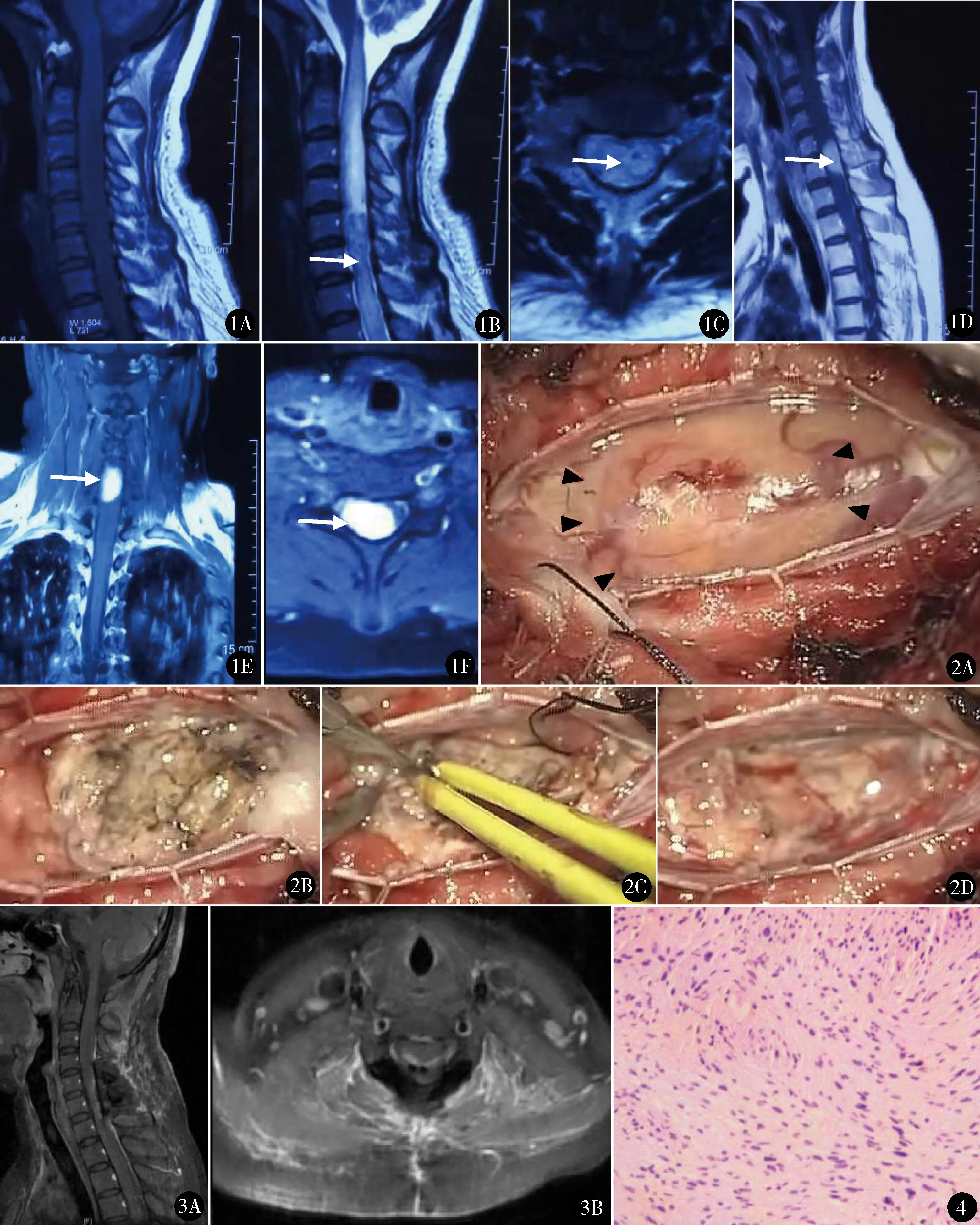
图1 髓内外神经鞘瘤术前MRI:矢状位T1WI(A)、T2(B)和水平位T2WI(C)显示C5~C6椎管内病变,病变呈等T1、稍长T2信号,其内信号不均匀,两端脊髓明显水肿;增强矢状位(D)、冠状位(E)和水平位(F)显示病变明显均匀强化,似有宽基底存在,位于椎管右侧背外侧,脊髓明显受挤压 图2 术中所见:切开硬膜悬吊后,见肿瘤(黑色三角形)位于髓内外,肿瘤与脊髓之间存在界限(A);瘤内切除肿瘤减压(B);沿肿瘤与脊髓之间的间隙锐性分离切除残余肿瘤(C);肿瘤全切,可见瘤床及完整的脊髓(D)图3 术后1个月增强MRI矢状位(A)、水平位(B)显示病变全切 图4 术后病理(HE染色 ×100)见大量梭形细胞,胞质丰富,胞界不清,呈整齐栅栏状或漩涡状排列,符合神经鞘瘤
3 讨论
发生于脊髓髓内的神经鞘瘤仅占髓内肿瘤的0.3%~1%,椎管内神经鞘瘤的1.1%,这可能与髓内缺乏Schwann细胞有关[3~6]。国内外文献仅有少量报道[5,7]。髓内神经鞘瘤好发于颈髓(63%),其次是胸髓(26%)、腰髓(11%)[7]。男性更多见,发病的平均年龄为30~40岁[8],但也有儿童甚至先天性髓内神经鞘瘤的报道[9]。
神经鞘瘤起源于Schwann细胞,但正常情况下脊髓实质内没有Schwann细胞,因此关于髓内神经鞘瘤的起源有多种说法:有学者认为起源于脊神经后根、沿髓内血管伴行的周围神经、迷走的周围神经纤维以及其他异常的髓内神经纤维周围的Schwann细胞[3,10],有学者认为来源于胚胎发育过程中异位的Schwann细胞[10],还有学者认为来源于神经外胚层的多潜能细胞或中胚层的软膜细胞[5,10]。髓内神经鞘瘤罕见,而且在术前影像上可能与其他髓内肿瘤如星形细胞瘤或室管膜瘤相混淆,因此有必要重视其临床特征[11]。
相应神经支配区疼痛是最常见的首发症状[8,12],其他包括肿瘤所在节段以下麻木、肢体无力和大小便功能障碍等[5]。疼痛有助于神经鞘瘤与其他常见髓内肿瘤如室管膜瘤或星形细胞瘤的鉴别。针刺觉减退是最常见的体征,其次是肌力减退,肌肉萎缩。病程上,髓内神经鞘瘤较其他常见髓内肿瘤更长(神经鞘瘤、室管膜瘤、星形细胞瘤分别为4.2、1.7、2.3年)[12]。
MRI是诊断髓内神经鞘瘤最有效的方法,肿瘤边界清楚,大多位于脊髓的背外侧,周围常见水肿,脊髓常有扩张,一般没有脊髓空洞;肿瘤在T1WI一般表现为等T1或稍长T1信号影,T2WI一般表现为等T2或稍长T2信号影[13]。如果在T2WI的长T2信号内能看到短T2信号区域,更有助于诊断髓内神经鞘瘤[13]。但是,MRI上的信号强度与肿瘤是否囊变及其组织学成分(Antoni A型或B型)有关[5]。增强扫描明显强化,髓内外神经鞘瘤多见囊性变,而完全位于髓内的神经鞘瘤囊性变少见,表现为实性结节[13]。完全位于髓内的神经鞘瘤在影像学上有时难以与室管膜瘤、血管网织细胞瘤鉴别。大部分位于髄外,小部分嵌入髓内的神经鞘瘤的MRI表现既可有脊髓增粗、脊髓水肿等髓内肿瘤的特点,也可有邻近肿瘤的蛛网膜下腔增宽等髄外神经鞘瘤的影像学特点,也常造成漏诊。
基于以上特点,需要重视髓内神经鞘瘤的鉴别诊断,包括2个方面:一是确定肿瘤的空间定位,明确肿瘤是完全位于髓内,还是位于髓内外。尤其是考虑为髓外硬膜下肿瘤,伴脊髓增粗,脊髓水肿或脊髓空洞等特点时,一定要考虑到髓内外肿瘤的可能性,对水平位、冠状位和矢状位的影像仔细阅片,如果肿瘤与脊髓相连处存在蜂腰形改变,则高度怀疑有髓内肿瘤可能。二是确定髓内肿瘤的性质,与髓内神经鞘瘤相比,以下几种常见髓内肿瘤各具特点:①室管膜瘤多位于脊髓中央,在T2加权像上肿瘤的上下极可见含铁血黄素沉积引起的极低信号;②星形细胞瘤边界不清,脊髓呈弥漫性梭形增粗,增强后强化不均;③血管母细胞瘤呈等或短T1、长T2信号,肿瘤背侧可见流空血管,部分表现为大囊伴有强化附壁小结节。
几乎所有学者都认为手术切除肿瘤是目前治疗髓内神经鞘瘤最有效的方法,但手术适应证及手术时机的选择还有争议。对于太小的髓内神经鞘瘤,术前定性困难且术中不易显露,切开脊髓有加重脊髓损伤的可能,故不建议早期手术;但另一方面,若术前已出现严重神经系统功能障碍,则手术后神经功能难以恢复,所以最佳手术应选择在神经系统症状有加重趋势时进行[14]。髓内神经鞘瘤的手术目的是解除脊髓受压和改善脊髓功能,应在不损伤周围神经组织的前提下争取全切肿瘤。
神经鞘瘤起源于Schwann细胞,属于良性肿瘤,生长缓慢,对脊髓造成压迫性损害,与胶质来源肿瘤的浸润性生长引起的损害不同。目前大多认为髓内神经鞘瘤与脊髓之间没有明显粘连,存在界限清楚的解剖平面,因此大多能够实现全切[7]。但是,如果肿瘤与周围神经组织粘连严重,应行次全切除,以免造成严重的神经功能障碍。
由于髓内神经鞘瘤常为实体型,整块切除肿瘤对周围神经组织的骚扰较重,可能需分块切除,并在显微镜下谨慎操作。术中要精准定位,包括术前体表标志物和C形臂X线机确定脊柱节段,术中B超确定髓内病变的位置。对于完全位于髓内的神经鞘瘤,严格脊髓后正中入路,切开的长度需根据肿瘤的长度决定,避免过多切开脊髓,加重脊髓损伤。分块切除肿瘤应严格限于“瘤内”,瘤内切除部分肿瘤后可减少肿瘤体积,获得更大的操作空间,再沿肿瘤与脊髓的边界切除肿瘤。一定要锐性分离,避免钝性剥离及大功率双极电凝止血,遇到出血,可用明胶海绵及脑棉片轻压止血,如不满意,可用小功率双极电凝止血。注意避免损伤脊髓前动脉,在尽量不加重神经功能损害的前提下争取全切肿瘤。
对于骑跨髓内外的神经鞘瘤,可先切除髄外部分肿瘤,再沿肿瘤与脊髓的边界锐性游离,直至完整切除肿瘤;如果髓内部分肿瘤较大,也可先瘤内切除部分肿瘤,再沿边界切除肿瘤。尽可能不切开脊髓,切除过程中也要注意轻柔操作,避免对脊髓造成不必要的损伤。
即使有显微镜的协助、术中轻柔操作,也很难保证不对脊髓造成损伤。为了实时了解脊髓功能状态,防止对脊髓造成不可逆的医源性损伤,有必要在术中辅以电生理监测[15]。常用的监测模式包括SEP、MEP和EMG。SEP直接反映的是脊髓后索的状态,MEP监测皮质脊髓束的功能状态,在脊髓内肿瘤切除术中与运动功能结局相关性很高。髓内神经鞘瘤术中可能出现的主要是脊髓损伤,联合应用SEP和MEP可对脊髓功能进行全面监测。但由于EMG监测可实时进行且非常敏感,对手术部位的神经根进行监测可敏感地反映脊髓受到的牵拉、挤压、电凝等多种刺激。我们建议综合运用SEP、MEP和EMG进行多模式神经电生理监测(multimodal intraoperative monitoring,MIOM),实时反馈脊髓上行和下行神经传导通路的功能完整性,协助术者在术中了解脊髓功能状态,从而在最小的神经损伤的前提下最大程度切除髓内肿瘤。本组在监测报警后适时终止操作,均未出现不可逆神经损伤。
髓内神经鞘瘤在病理上属于良性肿瘤,因此可以行椎板复位成形术[16,17]。术中先行椎板切开,将棘突椎板复合体整体取下,可以为切除肿瘤提供充分的显露。待肿瘤切除,硬膜吻合后,再将棘突椎板复合体原位回植固定。本组9例行椎板复位成形术,恢复脊柱后部结构,减轻瘢痕对椎管内神经结构的压迫。
总之,髓内神经鞘瘤罕见,是生长缓慢的良性肿瘤。较长的病程,较轻的临床症状以及MRI特征有助于该病的诊断。电生理监测辅助下行显微手术,大多能全切肿瘤,取得良好的疗效。
