缝隙连接蛋白40磷酸化介导自发性高血压大鼠脑基底动脉血管舒张功能*
2019-05-08赵小玲王家宁何琼
赵小玲, 王家宁, 何琼
1宜昌市优抚医院药剂科(湖北宜昌 443000); 2湖北医药学院临床医学研究所(湖北十堰 442000); 3湖北医药学院附属人民医院心脏中心(湖北十堰 442000)
维持小动脉血管内压力平衡的关键是血管收缩和舒张的协调[1],缝隙连接是小动脉平滑肌细胞间直接进行物质交换的通道[2]。缝隙连接允许钾离子通过细胞膜来调节血管的舒缩功能[3],当细胞外钾离子通过缝隙连接进入细胞内,引起细胞膜超极化,大鼠动脉血管舒张[4]。缝隙连接是由6个单体连接蛋白组成的六聚体[5],在血管壁上起主要作用的是缝隙连接蛋白40(Connexin 40, Cx40[6]),Cx40存在着多个磷酸化位点,单体连接蛋白磷酸化导致六聚体的功能发生改变[7-8],但是目前国内对Cx40在自发性高血压大鼠(spontaneously hypertension rats,SHR)脑基底动脉血管的功能尚未报道。因此,2016年12月至2018年3月我们以SHR脑基底动脉血管Cx40作为研究靶点,综合应用多种技术研究了Cx40磷酸化与脑基底动脉血管舒张功能的变化关系。
1 材料与方法
1.1 实验动物 实验所用Wistar大鼠和SHR购自北京维通利华实验动物有限责任公司,许可证号:SCXK京(北京)2007-0001。体重在200~300 g,雌雄不拘,清洁级。
1.2 实验药物及试剂 18-β甘草次酸(18-β glycyrrhetinic acid, 18β-GA)批号及规格:G10105-10g、乙酰胆碱(acetylcholine, ACh)批号及规格:A6625-500g、苯肾上腺素(phenylephrine, PE)批号及规格:1533002-200mg和硝普钠(sodium Nitroprusside, SNP)批号及规格:1614501-500mg,以上均购自Sigma公司;Connexin 40抗体批号及规格:sc-365107,购自SANTA公司,KCl等其余试剂均为国产分析纯试剂。
1.3 溶液制备 K-PSS液成分(mmol/L): KCl 123.70,MgSO4·7H2O 1.17,KH2PO41.18,CaCl22.5,NaHCO325,EDTA 0.026,葡萄糖5.5。生理盐溶液(physiological saline solution,PSS)成分(mmol/L):NaCl 119,KCl 4.69,MgSO4·7H2O 1.17,KH2PO41.18,CaCl22.5,NaHCO325,EDTA 0.026,葡萄糖5.5,pH 7.4。
1.4 方法
1.4.1 大鼠无创血压测量 在清醒安静状态下测量大鼠尾动脉的血压和心率,血压测量方法参考章艳萍等[9]。
1.4.2 压力机动图测量 参照王蕊等[10]实验方法,大鼠在麻醉状况下处死,取出基底动脉血管,固定在压力机动系统(Pressure myograph system, DMT, 110P, Denmark)水浴槽上,DMT自动分析血管直径,单位是μm。在相同实验条件下,对Wistar 大鼠和SHR脑基底动脉血管段分别进行孵育,待血管稳定(压力维持60 mmHg)后,预先给予10-5mol/L的PE孵育血管20 min,至血管收缩稳定后,累积给予不同浓度的血管舒张剂SNP (0.1~300 μmol/L)。
血管直径舒张幅度变化公式D(μm)=DX-DP,DP为血管在PSS中稳定时的直径,DX为血管加入不同浓度的药物时血管稳定后的直径,Dmax为血管加入药物后的直径舒张幅度最大值;血管舒张率(rate)=(DP-DX)/Dmax。
1.4.3 免疫荧光技术 参照罗勇等[11]实验方法:分离的脑基底动脉血管置于多聚甲醛内,冰冻切片后备用,依次加入:过氧化氢去除过氧化物酶,兔抗Cx40特异性抗体,加入二抗,共聚焦定量分析荧光强度。
1.4.4 Western blot技术 参照张传林等[12]实验方法:脑基底动脉血管加入200 μL细胞裂解液、冰上裂解20 min、超声波处理器破碎、收集上清、测定蛋白浓度、上样(20 μg)、电泳、转膜、封闭、加抗体孵育、ECL荧光显色,Image J图像分析软件定量分析。

2 结果
2.1 Wistar大鼠和SHR尾动脉血压的比较 Wistar大鼠尾动脉收缩压(121.2±10.6) mmHg,SHR的尾动脉收缩压(217.7±9.6) mmHg,SHR收缩压显著高于Wistar大鼠(P<0.01,n=6),但是两者心率分别是:(329.3±41.4)和(319.4±40.5)次/min,差异无统计学意义(P>0.05)。
2.2 18β-GA对Wistar大鼠和SHR脑基底动脉段舒张反应的影响 给予100 μmol/L的18β-GA预孵育脑动脉血管段20 min后,累积给予不同浓度的SNP也可浓度依赖的引起脑动脉段舒张,但与未加入18β-GA相比,SNP引起Wistar大鼠脑动脉段的舒张幅度在10~300 μmol/L之间发生下移(P<0.05,n=6)。SNP引起SHR脑动脉段舒张幅度与未加入18β-GA相比,SNP引起SHR脑动脉段的舒张幅度在0.1~300 μmol/L之间发生明显下移(P<0.05,n=6)。18β-GA干预20 min后,SHR舒张幅度对较低浓度(0.1~3 μmol/L)SNP反应下移,较Wistar大鼠差异有统计学意义(P<0.01,n=6)。见表1。


硝普钠浓度(μmol/L)Wistar& SNPWistar& SNP+18β-GASHR&SNPSHR&SNP+18β-GA 0.1168.6±10.2141.0±12.4170.1±12.746.1±5.9∗△ 0.3187.1±10.7167.5±15.4188.3±11.474.8±10.7∗△ 1206.3±11.4193.3±12.7209.2±10.989.2±9.4∗△ 3223.2±13.1197.8±12.6227.6±13.1161.0±10.9∗△ 10243.3±12.6204.6±10.9#239.1±12.5208.1±11.6△ 30270.2±15.2223.9±11.5#261.1±14.1219.7±12.4△ 100294.6±14.7234.6±12.9#283.1±13.0228.1±13.1△ 300304.7±15.6256.9±12.1#308.2±14.3243.8±12.8△
#与Wistar& SNP 比较P<0.05; △与SHR&SNP 比较P<0.05;*与Wistar& SNP+18β-GA 比较P<0.01
2.3 SHR脑基底动脉段连接蛋白Cx40分布 免疫荧光结果显示:Wistar大鼠脑基底动脉血管Cx40光密度均值为23.4±4.1;SHR脑基底动脉血管Cx40光密度均值为13.2±3.7。相比Wistar大鼠,SHR脑基底动脉血管Cx40光密度明显下调(P<0.01,n=6)(图1)。
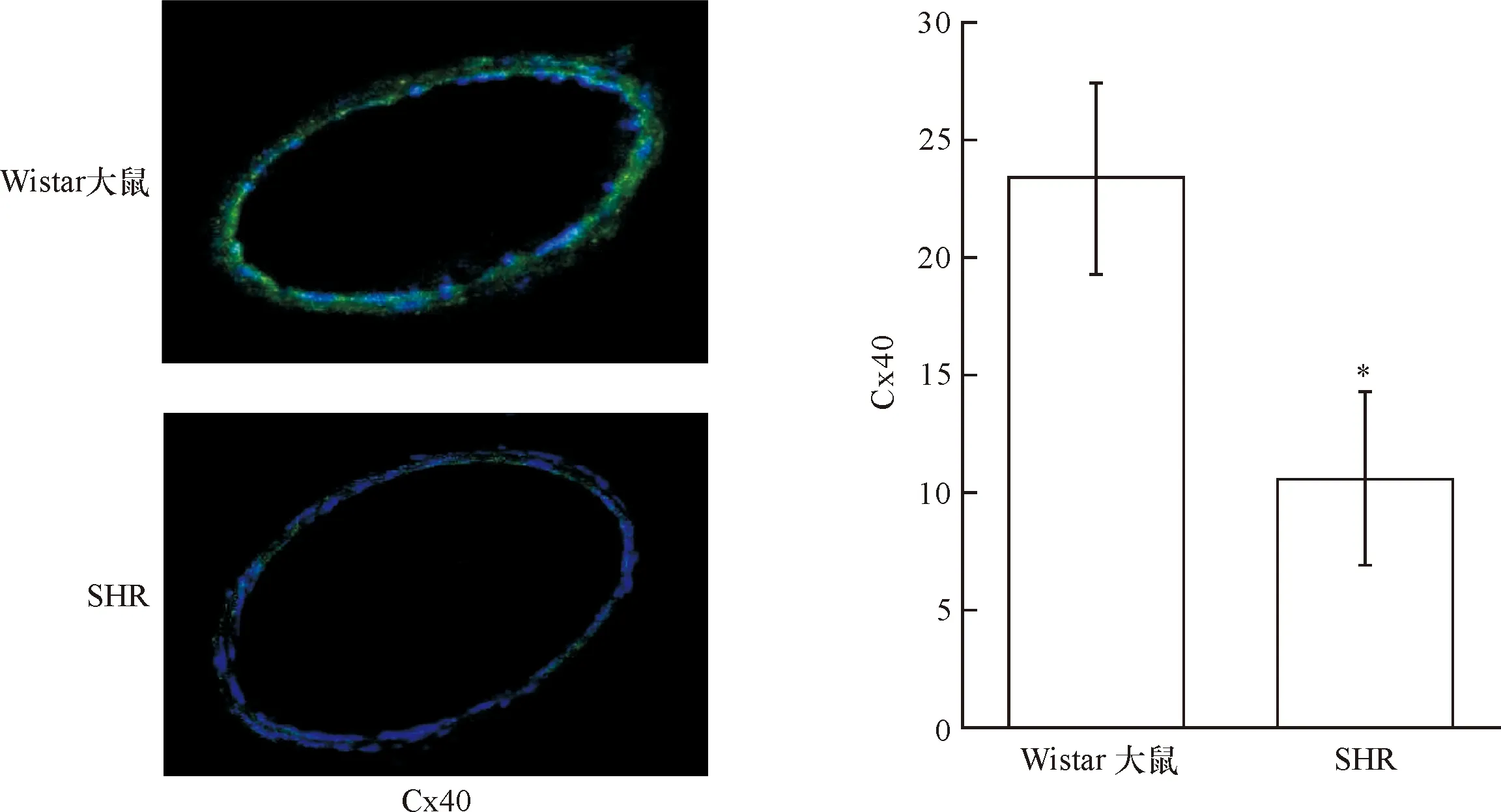
*与Wistar大鼠比较P<0.01
2.4 SHR脑基底动脉血管Cx40表达 Western blot结果显示:Wistar大鼠脑基底动脉血管Cx40平均值是22.1±1.2,磷酸化Cx40平均值是15.3±1.3;SHR脑基底动脉血管Cx40平均值是13.9±0.9,磷酸化Cx40平均值是21.6±1.0。相比Wistar大鼠,SHR脑基底动脉血管Cx40表达明显下调(P<0.01,n=6),磷酸化Cx40表达明显上调(P<0.01,n=6)(图2)。

*与Wistar大鼠比较P<0.05
3 讨论
SHR收缩压高于Wistar大鼠,提示SHR血管舒张功能降低,有研究表明,18β-GA能阻断血管平滑肌细胞间的缝隙连接[13-14],我们应用18β-GA干预后, SHR脑基底动脉血管舒张率下调幅度明显降低,提示SHR收缩压升高与缝隙链接介导的血管舒张功能降低呈正相关,缝隙连接介导的血管舒张功能降低导致SHR收缩压升高;免疫组织化学结果显示SHR脑基底动脉血管Cx40分布密度降低,提示缝隙连接介导的血管舒张功能降低与Cx40分布密度呈负相关。Western blot结果显示SHR脑基底动脉血管Cx40磷酸化表达水平上调,Cx40表达水平下调,提示缝隙连接介导的血管舒张功能降低与Cx40磷酸化呈正相关。10~300 μmol/L SNP介导的Wistar大鼠和SHR血管舒张幅度较给予100 μmol/L 18β-GA孵育前明显下调,但Wistar大鼠和SHR差异无统计学意义,这可能与高浓度(10~300 μmol/L) SNP通过释放NO,激活G蛋白偶联受体,通过多种途径发挥舒张作用相关[15]。
总之,通过本次实验结果我们推测:SHR脑基底动脉血管组成缝隙连接的Cx40磷酸化水平上调,引起缝隙连接介导的血管舒张功能障碍,导致血管收缩,是高血压大鼠收缩压上升的重要原因之一。
