米诺环素对脊髓损伤大鼠凋亡机制探索和神经红蛋白表达的影响
2019-05-08陈萌马卫军马泉刘胜王爱乐
陈萌,马卫军,马泉,刘胜,王爱乐
脊髓损伤是一种致残率高、预后较差的疾病,主要的病理改变是缺血、缺氧诱导的继发性病理损伤。脊髓继发性损伤的重要病理机制是神经细胞凋亡导致的神经元大量丢失,如何有效抑制这部分神经细胞的凋亡是治疗脊髓损伤的关键[1-3]。米诺环素是四环素族药物的衍生物,是一种安全有效的神经保护剂,具有分子质量小和易于透过血脑屏障的特点,长期口服无明显的不良反应且安全有效[4]。2003年Wells等[5]首先将其应用于脊髓损伤的动物研究中,发现其可以显著减少创伤后的组织坏死,保护脊髓白质和脊髓前角运动神经元。本课题组前期研究发现米诺环素可以提高脊髓损伤大鼠后肢运动功能评分[6-7],但其主要作用机制和对细胞凋亡的影响尚不清楚。因此,本实验将米诺环素预防性地应用于脊髓横断大鼠,旨在观察其对脊髓横断大鼠Bcl-2、Bax、Caspase-3 和Ngb 蛋白表达及对神经细胞凋亡的影响,为进一步预防和治疗脊髓损伤提供相关的理论依据。
1 材料与方法
1.1 动物分组与处理 健康雄性Wistar 大鼠36 只,体质量200~250 g,由河北医科大学实验动物中心提供。大鼠随机分为假手术组、脊髓损伤组、米诺环素干预组,每组12只。米诺环素预处理组大鼠术前腹腔注射米诺环素(90 mg/kg),1 次/d,连续5 d;脊髓损伤组和假手术组大鼠腹腔注射等量的生理盐水。5 d后脊髓损伤组和米诺环素预处理组大鼠制备胸3~4节段交界处的脊髓全横断损伤模型。
1.2 药物、试剂及仪器 米诺环素胶囊(惠氏制药有限公司生产,100 mg/粒,批号:1001012),使用前溶于5 mL生理盐水中,pH=5.7。一抗分别为兔抗Bcl-2 多克隆抗体(Gene Tex,美国)、兔抗Bax 单克隆抗体(AR Biosciences,美国)、兔抗Caspase-3多克隆抗体(Abcam,美国),浓缩型DAB显色试剂盒和免疫组化试剂盒(北京中杉金桥公司);鼠抗Ngb多克隆抗体(Santa Cruz,美国);荧光二抗Alexa Fluor®594-羊抗鼠IgG(Invitrogen,美国);Hoechst 33342(Sigma,美国);倒置荧光显微镜、石蜡切片机(Leica,德国)。
1.3 动物模型制备及给药 脊髓损伤组和米诺环素干预组用4%水合氯醛(10 mL/kg)腹腔注射麻醉大鼠。在无菌操作下,以第3 胸椎棘突为中心行背部纵行切口。于第3 胸椎椎骨节段行椎板切开术。在第3~4 胸椎节段脊髓交界处剪开硬脊膜和软脊膜,用手术刀切断脊髓,造成脊髓完全横断性损伤;术中注意保留脊髓后静脉、两侧的脊髓后动脉和脊髓前动脉,保证脊髓下段的血液供应[6-7]。建模成功大鼠肌张力消失同时出现损伤平面以下各种反射消失。假手术组与脊髓损伤组手术步骤一致,但暴露脊髓后不进行横断,仅行椎板切除术。
1.4 病理学取材及观察 术后第22 天,所有大鼠全身灌流固定后取损伤区脊髓及其上下部分。其中18例标本(每组6例)进行梯度乙醇脱水,常规石蜡包埋,5 µm 连续横切片。HE染色观察脊髓组织病理形态学变化。
1.5 Western blot检测脊髓组织Bcl-2、Bax和Caspase-3蛋白表达 术后第22 天,处死剩余大鼠,快速取出胸3~4 节段脊髓组织约100 mg,放入1.5 mL 离心管,在冰上将组织剪碎。加入蛋白裂解液1 mL 匀浆,12 000 r/min 离心15 min,取上清。蛋白定量后按照4∶1 加入5×SDS buffer,95 ℃煮沸5 min变性,迅速冰浴,-80 ℃保存。每孔上样30µg蛋白行十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);PVDF转膜(转膜条件:电流100 mA,湿转30 min)。5%脱脂奶粉封闭,分别加入一抗兔抗Bcl-2 多克隆抗体(1∶1 000)、兔抗Bax 单克隆抗体(1∶2 000)、兔抗Caspase-3多克隆抗体(1∶1 000)或β-actin 抗体于4 ℃过夜;洗膜后加入二抗,室温孵育1 h;洗膜,发光,显色剂显影,X 射线胶片定影。扫描后应用Image Pro Plus 6.0 软件分析目的条带的灰度值,以目的条带和βactin条带的积分光密度(IOD)比值作为目的蛋白的相对表达水平。
1.6 免疫组化染色观察Bcl-2、Bax 和Caspase-3的表达 术后第22天,所有大鼠全身灌流固定后取损伤区脊髓及其上下部分。每组取6例标本进行梯度乙醇脱水,常规石蜡包埋后5µm连续切片。柠檬酸钠溶液进行热修复,3%H2O2封闭,加山羊血清室温孵育,分别滴加一抗兔抗Bcl-2多克隆抗体(1∶200)、兔抗Bax单克隆抗体(1∶250)、兔抗Caspase-3多克隆抗体(1∶500)4 ℃过夜,阴性对照以PBS代替一抗。PBS冲洗后滴加二抗,37 ℃孵育10 min。滴加辣根酶标记链霉卵蛋白工作液37 ℃孵育10 min。DAB显色,常规苏木素复染。每张切片随机选取5个不重复视野,计算阳性细胞数,取平均值。
1.7 Hoechst 染色法检测细胞凋亡 将上述组织切片经过二甲苯Ⅰ、Ⅱ脱蜡、梯度乙醇脱水,PBS清洗2次,每次3 min,吸尽液体;加入0.5 mL Hoechst 33342 工作液,于摇床上避光染色5 min;PBS 摇洗2遍,去染液,每次3 min,50%甘油缓冲液封片。倒置荧光显微镜下观察,细胞核明显固缩,呈碎块状致密浓染的为凋亡细胞,正常细胞核呈现蓝色。在200倍镜下每组取5个视野计数凋亡细胞数,取平均数。
1.8 免疫荧光检测脊髓组织中Ngb 荧光强度 将石蜡切片常规脱蜡、脱水,PBS 摇洗,用0.25%Trion X 100室温处理30 min,PBS 摇洗3 次,将切片放入柠檬酸缓冲液(95~98 ℃)中20 min 进行抗原修复,待恢复至室温后取出切片,PBS浸泡5 min。滴加10%山羊血清室温封闭切片60 min。滴加30µL鼠抗Ngb IgG 多克隆抗体(1∶100),4 ℃孵育过夜。次日取出,室温放置30 min 后用PBS 摇洗。避光滴加山羊抗鼠-594 IgG荧光二抗30µL(1∶200),孵育60 min,PBS摇洗3次。封片剂封片,盖玻片四周涂指甲油封固,4 ℃避光保存。在高倍视野下随机选取5 个互不重叠的区域拍摄照片,利用Image Pro Plus 6.0分析各组图像中Ngb的免疫荧光强度。
1.9 统计学方法 采用SPSS17.0 统计软件分析,符合正态分布的计量数据以均数±标准差(±s)表示。2组间均数的比较采用独立样本t 检验;多样本均数的比较采用单因素方差分析,组间两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 病理形态学观察及分析 假手术组脊髓组织结构正常,脊髓损伤组脊髓组织正常结构消失,灰质可见有较大空腔,胶质细胞增生明显,白质区出现数量不等的微囊;米诺环素干预组脊髓组织结构较清晰,空腔体积减小,仅轻度胶质细胞增生。米诺环素干预微囊数量和空腔体积均较脊髓损伤组减少,差异有统计学意义(P<0.05),见表1、图1。
Tab.1 Analysis of optical measurement three weeks after operation表1 术后3周光镜下计量分析(n=6,±s)

Tab.1 Analysis of optical measurement three weeks after operation表1 术后3周光镜下计量分析(n=6,±s)
**P<0.05
组别脊髓损伤组米诺环素干预组t微囊(个/视野)33.50±1.87 18.00±2.53 12.067**空腔(像素点)148.67±14.81 57.50±6.54 13.792**

Fig.1 HE staining of spinal cord tissues in three groups(×200)图1 各组大鼠脊髓组织HE染色(×200)
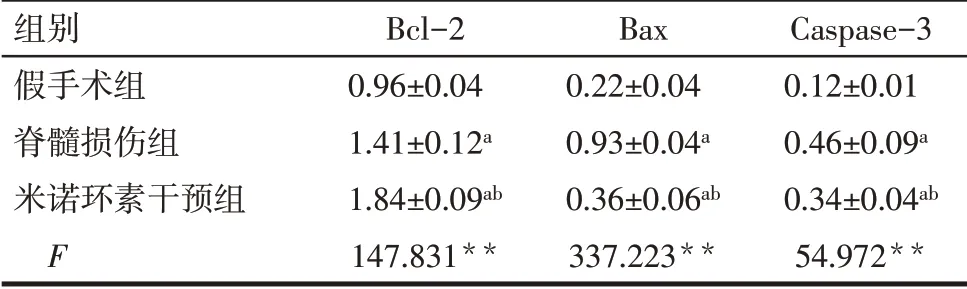
2.2 Western blot结果 与假手术组比较,脊髓损伤组脊髓组织Bcl-2、Bax、Caspase-3表达明显升高;与脊髓损伤组比较,米诺环素干预组大鼠脊髓组织Bcl-2表达明显升高(P<0.05),Bax、Caspase-3表达显著降低(P<0.05),见图2、表2。
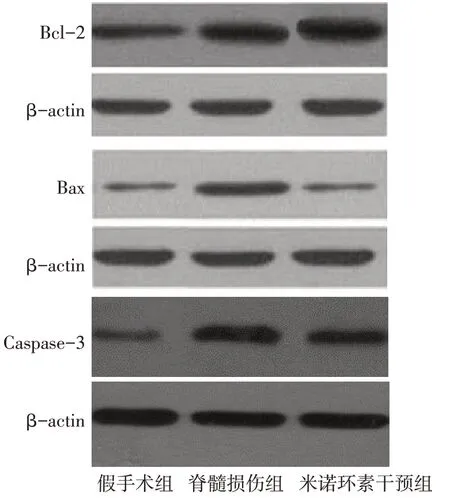
Fig.2 Western blot analysis of Bcl-2,Bax and Caspase-3 in three groups图2 Western blot 检测各组Bcl-2、Bax和Caspase-3蛋白的表达
Tab.2 The relative expression of Bcl-2,Bax and Caspase-3 proteins in spinal cord tissues of three groups表2 各组大鼠脊髓组织Bcl-2、Bax和Caspase-3蛋白相对表达量 (n=6,±s)
Tab.2 The relative expression of Bcl-2,Bax and Caspase-3 proteins in spinal cord tissues of three groups表2 各组大鼠脊髓组织Bcl-2、Bax和Caspase-3蛋白相对表达量 (n=6,±s)
**P<0.01;a与假手术组比较,b与脊髓损伤组比较,P<0.05
组别假手术组脊髓损伤组米诺环素干预组F Bcl-2 0.96±0.04 1.41±0.12a 1.84±0.09ab 147.831**Bax 0.22±0.04 0.93±0.04a 0.36±0.06ab 337.223**Caspase-3 0.12±0.01 0.46±0.09a 0.34±0.04ab 54.972**
2.3 免疫组化结果 脊髓灰质中Bcl-2、Bax 和Caspase-3 的免疫反应阳性物质在神经元和神经胶质细胞中均有表达。Bcl-2主要分布在胞质中,着黄色;Bax分布在神经元胞膜和胞质中,呈黄色或棕黄色;Caspase-3 分布在脊髓前角运动神经元胞质、胞核和突起中,呈黄色或棕黄色。与假手术组相比,脊髓损伤组Bcl-2、Bax 和Caspase-3 阳性细胞均明显增多且着色较深;而与脊髓损伤组相比,米诺环素干预组Bcl-2阳性细胞数较脊髓损伤组增加更为明显(P<0.05),而Bax 阳性细胞和Caspase-3 阳性细胞较脊髓损伤组有所减少(P<0.05)。见图3、表3。
2.4 细胞凋亡检测结果 荧光显微镜下可见假手术组几乎没有凋亡细胞,脊髓损伤组凋亡细胞数明显高于假手术组,米诺环素干预组凋亡细胞数较脊髓损伤组有所减少(P<0.05)。见图4、表4。
2.5 3组Ngb免疫荧光染色结果 在大鼠脊髓组织中Ngb阳性细胞表达红色荧光。假手术组Ngb呈少量的胞质表达,荧光强度较低;脊髓损伤组Ngb的表达有所增强,荧光强度较假手术组增加;而米诺环素干预组Ngb的荧光强度较脊髓损伤组显著增强。见图5、表4。
Tab.3 Comparison of Bcl-2,Bax and Caspase-3 positive cells in spinal cord tissue between three groups表3 各组大鼠脊髓组织Bcl-2、Bax和Caspase-3阳性细胞的比较(n=6,个/视野,±s)

Tab.3 Comparison of Bcl-2,Bax and Caspase-3 positive cells in spinal cord tissue between three groups表3 各组大鼠脊髓组织Bcl-2、Bax和Caspase-3阳性细胞的比较(n=6,个/视野,±s)
**P<0.01;a与假手术组比较,b与脊髓损伤组比较,P<0.05
组别假手术组脊髓损伤组米诺环素干预组F Bcl-2阳性细胞5.00±0.63 32.83±3.00a 59.50±1.76ab 1 038.977**Bax阳性细胞1.00±0.63 76.33±2.42a 53.00±2.10ab 2 509.750**Caspase-3阳性细胞2.33±1.21 50.33±3.14a 32.83±2.32ab 636.018**
Tab.4 Comparison of the number of apoptotic cells and the fluorescence intensity of Ngb positive cells between three groups表4 各组大鼠凋亡细胞个数及Ngb阳性细胞荧光强度的比较 (n=6,±s)

Tab.4 Comparison of the number of apoptotic cells and the fluorescence intensity of Ngb positive cells between three groups表4 各组大鼠凋亡细胞个数及Ngb阳性细胞荧光强度的比较 (n=6,±s)
**P<0.01;a与假手术组比较,b与脊髓损伤组比较,P<0.05
组别假手术组脊髓损伤组米诺环素干预组F凋亡细胞数(个/视野)0.50±0.55 19.33±2.16a 14.83±2.04ab 190.639**Ngb免疫阳性细胞荧光强度0.60±0.03 1.10±0.05a 1.31±0.06ab 315.291**
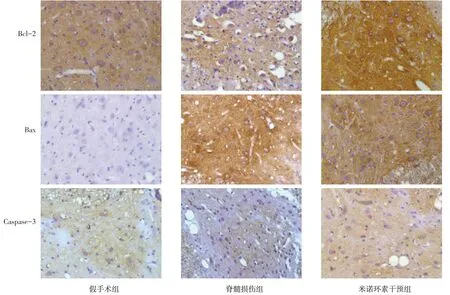
Fig.3 Immunohistochemical results of Bcl-2,Bax and Caspase-3 in three groups of rats(×400)图3 各组大鼠Bcl-2、Bax和Caspase-3免疫组化结果(×400)

Fig.4 Results of apoptotic staining in three groups of rats(Immunofluorescence stainning,×200)图4 各组大鼠细胞凋亡染色结果(免疫荧光染色,×200)
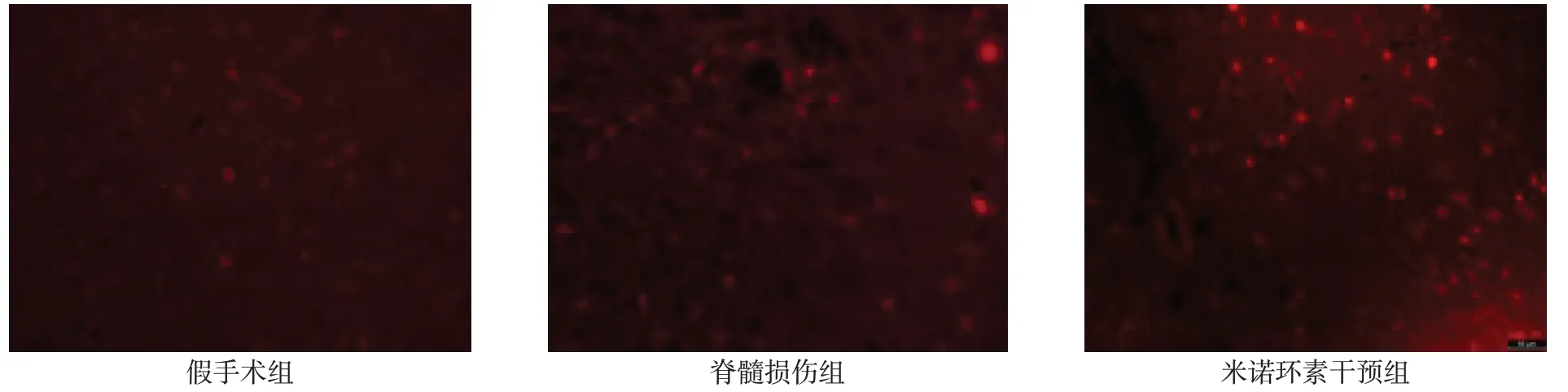
Fig.5 Results of immunofluorescence staining of Ngb protein in three groups(×400)图5 各组Ngb免疫荧光染色结果(×400)
3 讨论
脊髓损伤是一种高致残率的严重创伤,包括原发性损伤和继发性改变。脊髓功能丧失主要是由继发改变引起的,在损伤急性期通过减轻或消除继发性病理变化、保护残存的轴突和神经元不再遭受二次损伤,是目前关于脊髓损伤药物治疗研究的重点。原发性损伤为不可逆改变,故治疗脊髓损伤主要应防止脊髓的继发性损伤。脊髓继发性损伤的主要病理变化是神经细胞死亡,发生在脊髓损伤后急性期,以细胞肿胀破裂为主要形式;细胞凋亡是脊髓损伤后神经细胞死亡的主要方式,主要是由内源性内切酶的激活而导致的程序性细胞死亡,是由多基因调控的细胞主动死亡过程。脊髓损伤主要是由损伤后水肿的发展,激发一系列的分子和细胞机制,引发炎症反应等,最终导致细胞的凋亡和坏死[9]。脊髓损伤后给予米诺环素可以调节半胱天冬酶的活性,抑制Caspase-1 和Caspase-3 的激活,减少细胞凋亡[10]。Festoff等[11]也报道米诺环素对脊髓损伤的治疗作用,研究结果显示米诺环素可以调节小胶质细胞的活性,减少神经细胞凋亡。
有研究表明,Bcl-2、Bax 蛋白和Caspase-3 在脊髓损伤后神经细胞的凋亡中具有非常重要的参考价值[12]。Bcl-2是一种抗凋亡蛋白,能够抑制或有效阻止脊髓损伤后各种途径引起的细胞凋亡,促进损伤神经组织的修复[13]。Bax蛋白位于细胞质的线粒体内,脊髓损伤后可刺激Bax 蛋白使线粒体膜的通透性发生变化,诱导神经细胞凋亡。Bcl-2和Bax蛋白的表达水平直接影响脊髓神经细胞的凋亡,且凋亡的程度和Bcl-2/Bax呈正相关[14]。Caspase-3是凋亡的“分子开关”,控制着凋亡的启动,其活性一定程度上可反应脊髓损伤部位细胞凋亡的状况[15]。因此,本实验通过检测Bcl-2、Bax 和Caspase-3 的表达情况,观察米诺环素干预对损伤脊髓组织凋亡蛋白的影响。研究结果发现,米诺环素干预组大鼠脊髓组织Bcl-2蛋白的表达明显高于脊髓损伤组,同时Bax蛋白和Caspase-3 蛋白的表达在对应时间明显低于脊髓损伤组。表明预防性应用米诺环素可使脊髓损伤大鼠Bcl-2 蛋白表达上调,Bax 和Caspase-3 的蛋白表达下调,因而有效抑制了神经细胞的凋亡。
Ngb 蛋白是Burmester 等[16]于2000年首次在中枢神经系统内发现的一种脊椎动物携氧球蛋白,有助于转运氧通过血脑屏障和血脊屏障,从而提高中枢神经系统氧的利用率。目前在中枢神经系统损伤及缺血的研究方面有较多报道。于如同等[17]研究了神经红蛋白在脊髓中的表达与分布情况,发现Ngb位于神经元的胞质中,主要集中在脊髓前角运动神经元。其功能可能在于促进氧向神经元线粒体的扩散,供给线粒体能量。因此,Ngb能增加神经细胞的氧供应,提高神经细胞的功能和存活率。孔令胜等[18]在研究神经干细胞移植对脊髓损伤后神经红蛋白的影响时发现脊髓损伤组大鼠脊髓在损伤后Ngb阳性神经元数目、光密度值较正常组增加,神经干细胞移植组大鼠Ngb免疫阳性的神经元染色强度逐渐增加,在损伤后第14 天达到最高值,表达高峰较脊髓损伤组明显延长,经胚胎干细胞移植后能明显上调Ngb的表达。
本研究发现,米诺环素干预脊髓横断损伤大鼠后,米诺环素干预组Ngb 的平均荧光强度较脊髓损伤组明显增强。Ngb 的免疫荧光结果同脊髓组织Hoechst 染色检测细胞凋亡的结果相对应。米诺环素干预组的凋亡细胞数较脊髓损伤组明显减少。因此,米诺环素能上调Ngb的表达,进而减少脊髓损伤后神经细胞的凋亡,具体的调控机制尚需进一步深入研究。临床上甲泼尼龙具有神经保护作用,其治疗脊髓损伤有最佳的时间窗[19]。而米诺环素应用于脊髓损伤是否有时间窗,需要进一步的实验研究,期望米诺环素能从多方位、多靶点对脊髓损伤患者进行有效的防治。
