CCl4诱导肝纤维化小鼠模型中肝脏巨噬细胞及淋巴细胞亚群变化的初步分析
2019-05-07唐颖悦李静雷晓红李春敏曾民德茅益民
唐颖悦 李静 雷晓红 李春敏 曾民德 茅益民
慢性肝脏炎症导致的肝纤维化、肝硬化在全球每年造成超过100万人死亡[1]。尽管肝星状细胞(HSC)激活是肝纤维化发生的中心环节,但在肝纤维化的发生和进程中有多种细胞参与,包括肝实质细胞、肝窦内皮细胞、巨噬细胞(库普弗细胞)、淋巴细胞等。如库普弗细胞分泌的TGFβ1、血小板衍生生长因子(PDGF)和肿瘤坏死因子(TNF-α)等是HSC激活的关键,其分泌的IL-4和IL-13可直接刺激MFB的胶原合成[2];T淋巴细胞主要亚群Th1细胞分泌的细胞因子(如IFN-γ和IL-12)能抑制肝纤维化,而Th2分泌的IL-13可促进胶原合成[3];NKT细胞分泌大量细胞因子包括IFNγ和IL-4,对肝纤维化的进展具有双向作用[4]。NK细胞可杀伤活化早期的HSC和衰老的肌纤维母细胞,显著抑制肝纤维化[5]。B细胞缺失可减少胶原的沉积并通过抗体不依赖途径缓解肝纤维化发展[6]。本研究通过多色流式技术观察CCl4诱导肝纤维化模型中各免疫细胞的变化,探讨其可能参与的调节机制。
材料与方法
一、 实验动物
雄性C57BL/6小鼠,10~12周龄,购于上海斯莱克动物实验中心。所有实验小鼠均饲养于上海睿太莫斯生物科技有限公司实验动物中心,SPF级独立通风笼,自由饮食。
二、 主要试剂及仪器
CCl4购于国药集团上海化学试剂有限公司;橄榄油购于上海生工生物工程有限公司;Percoll购于德国GE Healthcare(40501ES60);红细胞裂解液购于上海翊圣生物科技有限公司(40401ES60);RPMI1640购于美国Gibco;流式细胞抗体均购自美国Biolegend。流式细胞仪购自美国BD公司(BD LSRFortesssa X20);全自动脱水机、石蜡包埋机、脱蜡机均来自于德国Leica公司。
三、动物分组及模型建立
14只雄性C57BL/6小鼠随机分成2组,每组7只。在适应性喂养1周后开始诱导小鼠肝纤维化模型,实验组小鼠予腹腔注射20% CCl4溶液(1 mL/kg),每周2次,持续6周;对照组小鼠予腹腔注射橄榄油(1 mL/kg),实验期间自由饮水,饲养温度控制在(24±2)℃,湿度为(50±5)%,每天换水和垫料,每周称量体质量。在末次注射CCl448 h后对实验组和对照组小鼠进行安乐死,并收集外周血和肝脏样本。
四、HE、Masson染色,肝纤维化病理评分
肝组织4%多聚甲醛固定24 h,常规梯度酒精脱水,二甲苯透明,石蜡包埋并切片。HE染色:肝组织石蜡切片二甲苯脱蜡,酒精梯度浓度脱水,苏木素染色30 s、水洗30 s,1%盐酸酒精3 s、水洗30 s、1% 氨水30 s,伊红染色1 min,二甲苯透明和中性树胶封片。Masson染色:肝组织石蜡切片二甲苯脱蜡,酒精梯度浓度脱水,酸性丽春红品红染色1 min,放入0.2%冰醋酸3 s,1%磷钼酸10 s,0.2%冰醋酸3 s,0.2%冰醋酸1 s,梯度酒精脱水,二甲苯透明并中性树胶封片。按照Metavir分级标准将肝脏纤维化分为5期:F0为无肝纤维化;F1为轻度肝纤维化;F2为显著肝纤维化或明显肝纤维化;F3为进展期肝纤维化;F4为肝硬化。
五、流式细胞分析
小鼠肝脏冲洗干净,取出并研磨,将细胞进行离心、冲洗,用Percoll分离液分离,弃上清后加红细胞裂解液离心,用RPMI1640细胞培养液重悬调整计数细胞为106/mL,制成肝脏单细胞悬液备用。取肝脏单细胞悬液100 μL, 分别加入FITC anti-mouse CD3(17A2)、APC anti-mouse/human CD45R/B220(RA3-6B2)、PE/Cy7 anti-mouse NK-1.1(PK136)、APC anti-mouse CD206 (MMR)(C068C2)、Brilliant Violet 605TManti-mouse CD11c(N418)、Brilliant Violet 421TManti-mouse F4/80(BM8)、Zombie NIRTMFixable Viability Kit各1.5 μL 轻柔混合,4℃孵育30 min后加入 PBS 洗涤2次,上机检测,用FlowJo软件进行后期数据分析。
六、统计学方法
采用 SPSS 16.0进行统计学分析,采用Graph Pad Prism 7.0进行绘图,计量资料采用均数±标准差表示。两组间比较采用t检验,P<0.05为差异具有统计学意义。
结 果
一、构建CCl4诱导肝纤维化疾病模型
对照组小鼠肝脏表面呈红色,质地柔软且富有弹性(图1A),而实验组小鼠肝脏略小且质硬,表面呈灰黄色,散布大小结节(图1B)。HE染色可见对照组小鼠肝小叶结构和肝细胞形态正常,未见明显肝纤维化(图1C);而实验组小鼠肝小叶纤维明显增多,正常肝小叶减少,多数被假小叶替代,网状纤维(假小叶)内可见炎细胞弥漫性浸润,肝细胞排列紊乱且出现弥漫散在的脂肪变性(图1D)。Masson染色可见实验组小鼠肝脏纤维化沉积明显重于对照组,平均病理评分达到F3(图1E、1F)。
与对照组小鼠相比,实验组小鼠体质量明显下降(P<0.05),同时肝湿重相对下降,但差异无统计学意义(表1)。实验组小鼠外周血ALT及AST显著高于对照组(P<0.001),在血脂方面,实验组TG和LDL-C均显著上升(P<0.05),TC高于对照组,而HDL-C低于对照组,但差异无统计学意义(表1)。
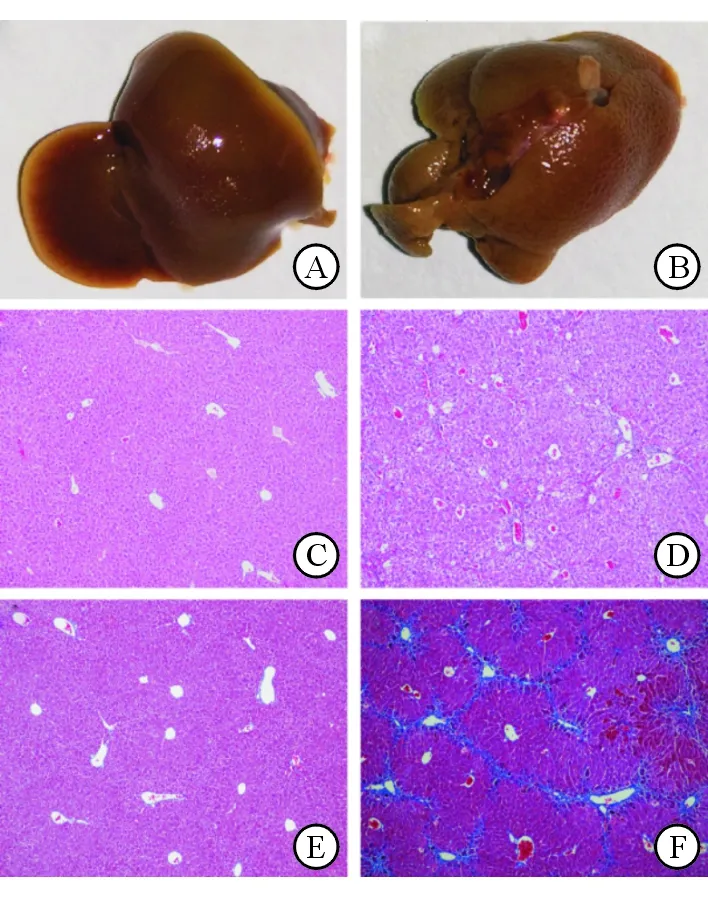
图1 对照组和实验组小鼠肝脏肉眼观、HE以及Masson染色图像(100)
二、 CCl4模型小鼠肝脏巨噬细胞亚群比例变化
图2A所示为多色流式细胞术分析巨噬细胞亚群的逻辑策略图。如图2B所示,实验组F4/80+巨噬细胞比例高于对照组,数据统计显示实验组巨噬细胞比例达到(13.33±1.91)%,而对照组仅为(8.17±2.00)%,(P<0.001)(图2C)。进一步分析巨噬细胞亚群的比例发现,实验组小鼠肝脏中存在大量M1型巨噬细胞,而对照组小鼠肝脏中M1型细胞比例则维持在一个较低的水平;两组中主要发挥抑制炎症作用的M2型巨噬细胞比例均较低(图2D)。统计结果表明,以CD11c+标记M1型细胞在实验组小鼠中达到了(24.19±3.07)%,明显高于对照组的(12.67±4.69)%,(P<0.01)(图2E);以CD206+标记M2型细胞比例在两组间则无明显变化(图2F)。提示在CCl4诱导肝纤维化小鼠疾病模型中,大量巨噬细胞浸润肝脏组织,且主要是以促炎作用为主的M1型巨噬细胞。
三、 CCl4模型小鼠肝脏淋巴细胞亚群比例变化
图3A所示为多色流式细胞术分析淋巴细胞亚群的逻辑策略图。如图3B、3C、3D所示,实验组小鼠肝脏CD3+T淋巴细胞比例(20.17±4.07)%与对照组(36.00±4.61)%相比明显下降(P<0.01),而CD45R+B淋巴细胞比例在两组间差异无统计学意义。同时,如图3E、3F、3G所示,实验组小鼠肝脏中NK-1.1+CD3+NKT细胞比例较对照组明显降低;而两组间NK-1.1+NK细胞比例差异无统计学意义。由此我们认为在肝纤维化疾病模型中肝脏局部定植的T细胞和NKT细胞的比例出现明显下降,而B细胞和NK细胞则没有发生明显改变。
讨 论
肝脏免疫细胞参与肝纤维化的进展。Karlmark等[7]观察到长期CCl4刺激会导致肝内CD11b+F4/80+细胞比例明显升高。针对慢性肝损伤和纤维化患者的研究也发现,这些患者体内巨噬细胞数量明显增多[8]。本研究发现,慢性肝纤维化小鼠的肝脏组织中库普弗细胞比例明显升高,并且以M1型巨噬细胞为主,实验组M1型巨噬细胞的比例明显高于对照组,但是M2型巨噬细胞的比例在两组间并无显著差别。有研究指出,M1型巨噬细胞分泌促炎因子如IL-1β、INF-γ、MCP-1和TNF-α,加重肝脏损伤。肝损伤后大量库普弗细胞活化可通过NF-κB信号通路启动TGF-β、TNF-α等细胞因子的合成和分泌,进而激活HSC,加快肝纤维化发展[9]。巨噬细胞的分化还会影响肝纤维化环境下T细胞亚群的构成比,主要影响Th1介导的免疫反应。与此同时,HSC活化后分泌趋化因子如CCL3, CCl4, CXCL1, CXCL2或者CXCL10,可通过TLR4依赖的信号途径促进单核巨噬细胞的向肝脏组织的趋化作用。
肝纤维化晚期会出现T淋巴细胞和NKT细胞比例明显降低,这一变化将加速CCl4诱导的肝纤维化。

表1 对照组和实验组小鼠一般情况、生化指标、肝纤维化评分比较(±s)
注:与对照组相比,*P<0.05,***P<0.001

图2 对照组和实验组小鼠肝脏巨噬细胞及其亚型检测结果
多项研究发现,肝硬化患者外周血中T淋巴细胞数量减少,疾病晚期表现更明显。因此,本研究分析了CCl4诱导慢性肝纤维化小鼠肝脏局部组织中T细胞、B细胞、NK细胞和NKT细胞的分布情况。与对照组相比,实验组小鼠肝脏组织中,T细胞和NKT细胞比例均明显降低,这与患者中观察到的现象相似。但是,两组间B淋巴细胞和NK细胞比例并无显著变化。以上结果提示,在肝纤维化晚期T细胞和NKT细胞的比例降低,可能会加速体内免疫功能失衡,促进肝纤维化的发生和进展。
综上,在CCl4诱导慢性肝纤维化小鼠模型中,肝脏内以M1型细胞为主的库普弗细胞浸润明显,而局部浸润的NKT细胞和T细胞比例则明显减少,提示M1型巨噬细胞可能在肝纤维化的发生、发展中发挥重要作用,且可能成为肝纤维化治疗的潜在靶点。因此,后续可以针对M1型巨噬细胞在肝纤维化中的作用机制开展更深入的研究。

图3 对照组和实验组小鼠肝脏T、B、NK、NKT淋巴细胞检测结果
