弗氏链霉菌产硫酸新霉素高通量选育模型的建立及优化
2019-05-07余飞孙俊峰刘鹏飞刘艳王洲薛正莲
余飞,孙俊峰,刘鹏飞,刘艳,王洲,薛正莲
(安徽工程大学 生物与化学工程学院,微生物发酵安徽省工程技术研究中心,安徽 芜湖,241000)
硫酸新霉素(neomycin sulfate)是首个被发现的2-DOS氨基糖苷类抗生素[1-2],作为一种理想的干扰蛋白质合成的杀菌剂,硫酸新霉素在临床和兽医学中有着广泛的应用[3-5]。当今发酵工业中,诱变育种是提高菌种生产能力,使所需要的代谢产物过量积累的有效方法之一。而高通量筛选是诱变后能从大量突变株中快速筛选高产菌株的关键步骤。
目前在工业上微生物突变株的筛选工作中常用的是随机筛选或者理化性质筛选,然后再利用摇瓶发酵,逐个筛选[6-7]。传统的筛选方法工作量大、筛选效率低、成本大,而近些年发展起来的微孔板的高通量筛选技术以微孔板为载体,目前已广泛地应用在放线菌生物活性物质筛选、菌种的筛选以及新药的研发等方面[8-11],它兼具平行、微型及自动等特点;而与分光光度计[12-13]、高效液相色谱(HPLC)[14-15]和管碟法[16]等相比,酶标仪可以1次处理大量的样品,同时需要量少,可以节约试剂的使用;这些方法在筛选高产突变株的工作中都可以提高筛选效率,为高通量筛选硫酸新霉素高产菌株提供了较好的参考。
目前关于高通量筛选硫酸新霉素高产菌株的研究尚未见报道,因此,本研究采用新型常压室温等离子体(atmospheric and room temperature plasma, ARTP)育种方法[17-20]诱变硫酸新霉素产生菌弗氏链霉菌,建立多孔板发酵及酶标仪检测的高通量筛选模型(如图1所示),为后续高通量选育其他抗生素高产菌株提供实验依据和技术参考。
1 材料与方法
1.1 实验材料
弗氏链霉菌野生型(S.fradiaeGC6010)菌株及指示菌大肠杆菌均为实验室保藏;HTS-T008孔板摇床,上海甘薇生物技术有限公司;1510全波长酶标仪,赛默飞世尔(上海)仪器有限公司;ARTP诱变育种仪,清华大学无锡应用技术研究院生物育种研究中心;硫酸新霉素标准品(642 U/mg),安徽新宇药业股份有限公司。
斜面培养基(g/L):葡萄糖10,牛肉膏1,蛋白胨3,玉米浆3,NaCl 5,琼脂20,pH 7.3~7.8,115 ℃灭菌30 min,30 ℃ 培养7 d。
种子培养基(g/L):淀粉10,花生饼粉10,酵母粉20,(NH4)2SO41,葡萄糖30,玉米浆10,蛋白胨5,Na2HPO41,CaCO310,豆油2,pH 7.3~7.8,115 ℃灭菌30 min,2 mL/孔板、30 mL/250 mL摇瓶,35 ℃、260 r/min培养7 d。
发酵培养基(g/L):淀粉70,花生饼粉28,酵母粉6,(NH4)2SO46,葡萄糖20,玉米浆2.5,蛋白胨9,中温豆饼粉5,NaCl 4.5,高温淀粉酶0.3,Na2HPO40.4, CaCO34,豆油3,pH 6.8~7.3,115 ℃灭菌30 min,2 mL/孔板、 30 mL/250 mL摇瓶,35 ℃、260 r/min培养7 d。
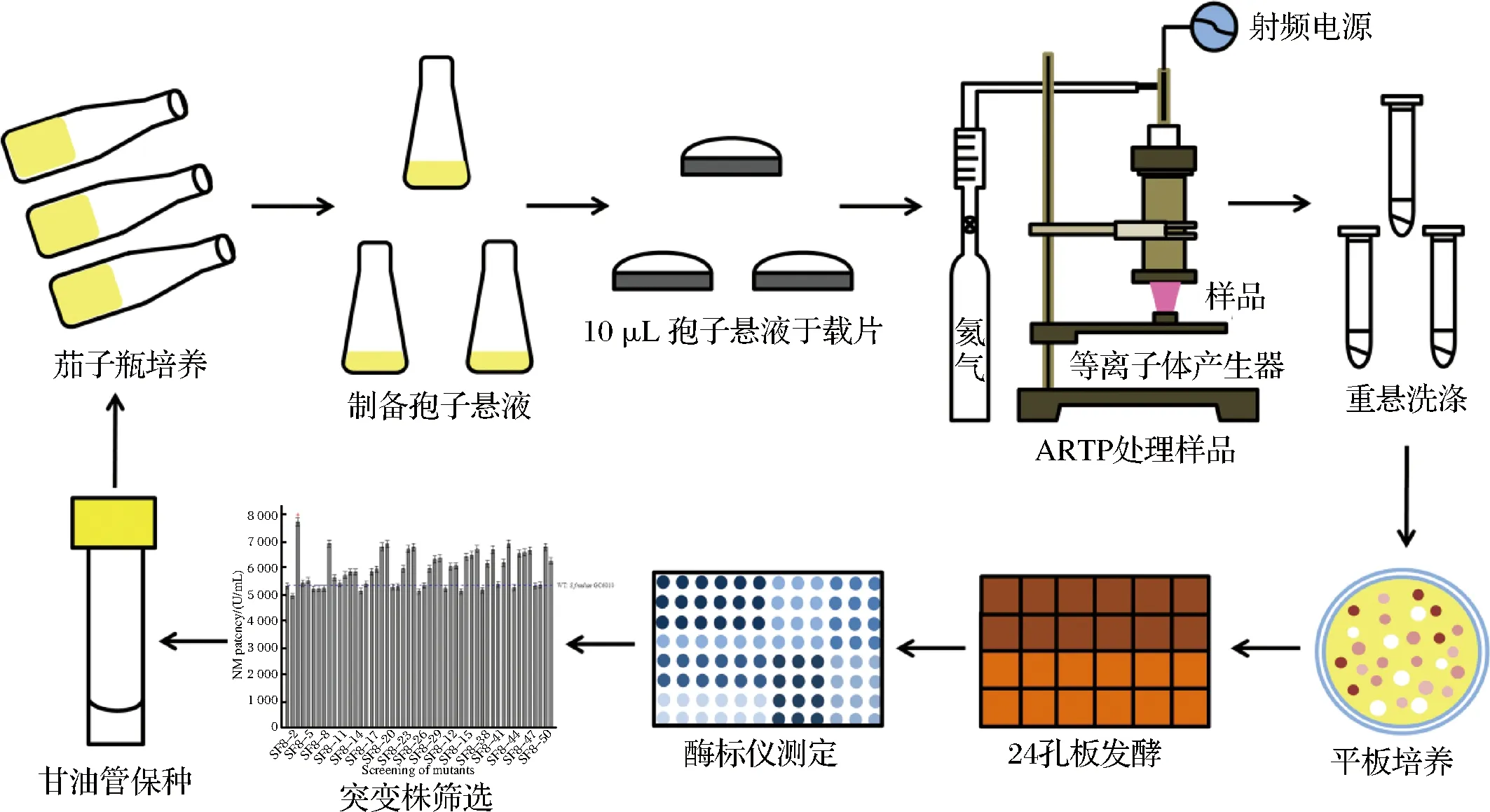
图1 ARTP诱变育种流程图Fig.1 Scheme of ARTP mutagenesis for microbial breeding
1.2 酶标仪测定硫酸新霉素方法的建立
1.2.1 硫酸新霉素测定原理及方法
实验原理:硫酸新霉素与曲利本蓝(TB)反应后,生成蓝色离子缔合物,并出现明显的显色峰,在一定波长下可测定待测溶液中硫酸新霉素效价[12]。
酶标仪:吸取发酵液200 μL于1.5 mL EP管中,加入1.0×10-4mol/L曲利本蓝溶液500 μL,pH 6.5的BR缓冲液100 μL,用蒸馏水定容至1 mL,摇匀,10 min后吸取反应液200 μL于酶标板中,以试剂空白为参比,在最大吸收波长处检测吸光度。
1.2.2 检测波长的选择
于1.5 mL EP管中,依次加入500 μL 1.0×10-4mol/L 的TB溶液,100 μL的25.68 U/mL的硫酸新霉素标准溶液,100 μL pH 6.5的BR缓冲溶液,用水稀释至1 mL,摇匀,以试剂空白为参比,10 min 后在酶标仪下进行全波长扫描,确定反应物的最大吸收峰波长。
1.2.3 TB溶液添加量对吸光度的影响及标准曲线的建立
取25.68 U/mL的硫酸新霉素标准溶液50、100、150、200、250、300、350、400 μL,分别加入1.0×10-4mol/L TB溶液100、200、300、400、500 μL,100 μL pH 6.5的BR缓冲溶液,用水稀释至1 mL,摇匀,以试剂空白为参比,10 min后在678 nm波长处检测吸光度,确定反应体系的TB溶液添加量并建立标准曲线。
1.2.4 精密度试验
取已知质量浓度的发酵液,分为2份,分别加入25.68 U/mL硫酸新霉素工作液75 μL和375 μL,制备待测溶液,按优化后的方法在678 nm波长下使用酶标仪检测吸光度值,计算硫酸新霉素效价,每组样品设置5个重复。
1.2.5 稳定性试验
吸取25.68 U/mL硫酸新霉素工作液200 μL,置1.5 mL EP管中,按优化后的方法,放置0、10、20、30、40、50、60 min,在678 nm波长处测定其吸光度。
1.2.6 加标回收试验
取已知质量浓度的发酵液,分为5份,分别加入25.68 U/mL硫酸新霉素工作液75、125、175、225、275、325、375 μL,制备待测溶液,按优化后的方法在678 nm波长下使用酶标仪检测吸光度值,计算回收率。
1.2.7 酶标仪与其他3种方法测定硫酸新霉素的拟合验证
按优化后的方法在678 nm下,分别使用酶标仪、分光光度计、HPLC和管碟法测定由ARTP诱变所获得的25株突变株经24孔板发酵后其中的硫酸新霉素效价,并利用Origin9.1软件对酶标仪与其他3种方法所测硫酸新霉素效价进行拟合曲线分析。
1.3 多孔板发酵
1.3.1 孔板类型的选择及优化
本实验随机挑选经ARTP诱变后的29株突变株,通过对其24、48孔板与摇瓶发酵效价之间相关性的对比,选择更适合高通量筛选的微孔板,并对所选择的孔板发酵条件进行正交优化。
1.3.2 微孔板孔间差异考察
采用S.fradiaeGC6010菌株的均一摇瓶发酵液上清,通过酶标仪进行检测,对检测的样本用Origin 9.1软件进行独立样本的t-Test,考察酶标板孔间差异;若差异不大,再用同一菌株的24孔板发酵上清去检测,考察24孔板孔间差异大小。
2 结果与分析
2.1 酶标仪测定硫酸新霉素方法的建立
2.1.1 检测波长的选择
由图2可见,硫酸新霉素与曲利本蓝反应形成的蓝色络合物在678 nm波长处有最大吸收峰,故选择678 nm为检测波长。

图2 硫酸新霉素紫外吸收图谱Fig.2 UV absorption spectra of NM
2.1.2 TB溶液添加量对吸光度的影响及标准曲线的建立
如图3-a与图3-b所示,当硫酸新霉素浓度在1.284~10.272 U/mL内,TB的添加量在100~400 μL/mL时,都不满足硫酸新霉素含量与吸光度呈线性关系,可能是因为使体系中硫酸新霉素完全形成蓝色络合物,TB必须达到过饱和。
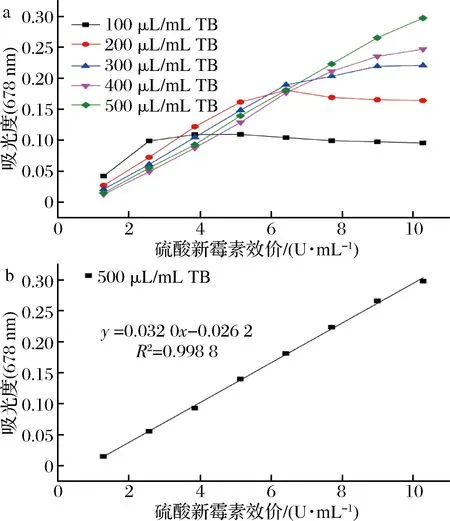
图3 TB溶液添加量对吸光度的影响及标准曲线的建立Fig.3 The influence of TB on absorbance and establishment of standard curve
而由于TB的添加量不够,不足以使反应进行完全;只有当TB的添加量达到500 μL时,吸光度与样品浓度呈良好的线性关系,线性方程为:Y=0.032 0X-0.026 2 (R2=0.998 8)。因此,本试验TB的添加量采用500 μL/mL。
2.1.3 精密度试验
为了尽可能减少实验误差,使得试验更准确,提高试验精密度在工业检测中是必不可少的。由表1可知,各组在低浓度和高浓度的RSD均小于0.5%,表明该方法测定硫酸新霉素效价精密度高。
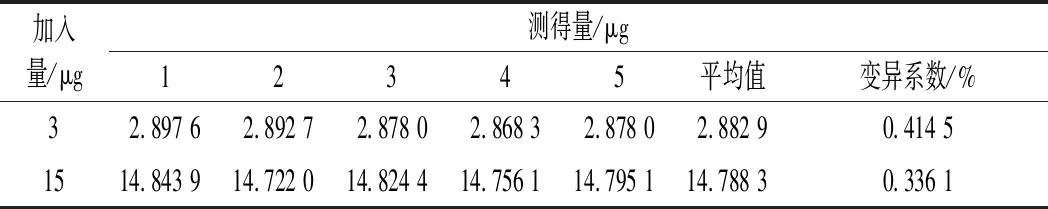
表1 精密度试验Table 1 Accuracy examinations
2.1.4 稳定性试验
从表2可知,体系中刚刚滴加完硫酸新霉素与TB反应后立即检测,蓝色络合物的形成并未达到饱和,吸光度偏小;反应10 min后,蓝色络合物几乎达到饱和,吸光度达到最大值。在实际过程中,检测诱变后大量突变株经孔板发酵后效价需要一定的操作时间,而从表2可知,硫酸新霉素工作液在10~60 min吸光度基本保持不变,稳定性良好,满足实际需求。

表2 硫酸新霉素工作液的稳定性试验结果Table 2 The stability test of NM working solution
2.1.5 加标回收试验
为了验证样品的前处理过程是否对样品的测定产生影响以及测量过程中是否有基体干扰,必须进行加标回收试验。由表3可知,平均回收率为98.468 4%,RSD为3.270 0%。结果表明,采用酶标仪测定硫酸新霉素加样回收率较高,前处理过程及水溶液基体对样品的测定影响几乎忽略不计。
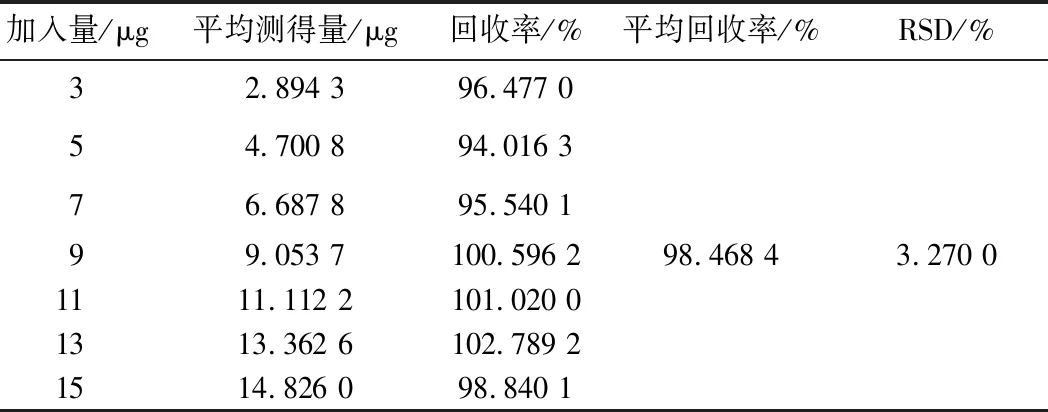
表3 加标回收率Table 3 Recoveries of spiked sample
2.1.6 酶标仪与其他3种方法测定硫酸新霉素的拟合验证
相关强度由相关系数的绝对值决定,相关系数的正负系数是相关方向。根据经验,统计学家提出了相关性强度的判断标准,将R2= 0.7作为1个较高的相关系数[21]。由图4可知,拟合曲线的R2=0.940 7、0.911 7和0.927 9,表明酶标仪与分光光度计、HPLC与管碟法测定24孔板发酵液中硫酸新霉素效价具有很好的正相关性,可以利用酶标仪快速、高效测定较多发酵样品中硫酸新霉素的效价。
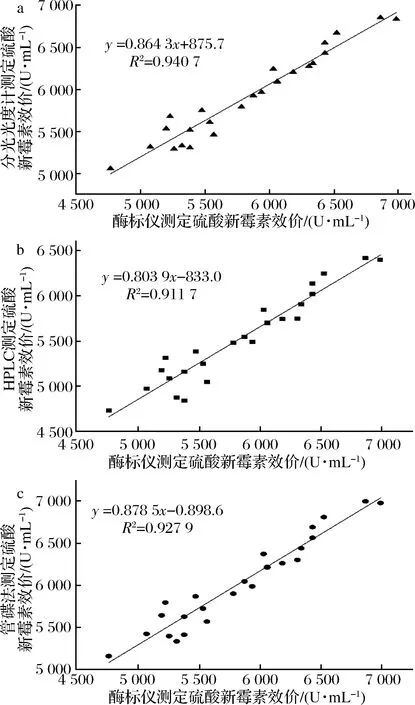
a-酶标仪与分光光度计法;b-酶标仪与HPLC法;c-酶标仪与管碟法图4 酶标仪与其他3种方法测定硫酸新霉素效价之间的相关性Fig.4 The relationship between microplate reader and other three methods for determination of NM potency
2.2 多孔板发酵
2.2.1 孔板类型的选择
如何从数量庞大的突变株中省时、省力地筛选出生产性能稳定的高产菌株,是菌株筛选工作的关键。本实验随机挑选经ARTP诱变后的29株突变株,通过对其24、48孔板与摇瓶发酵效价之间相关性的对比,选择更适合高通量筛选的微孔板,结果见图5。
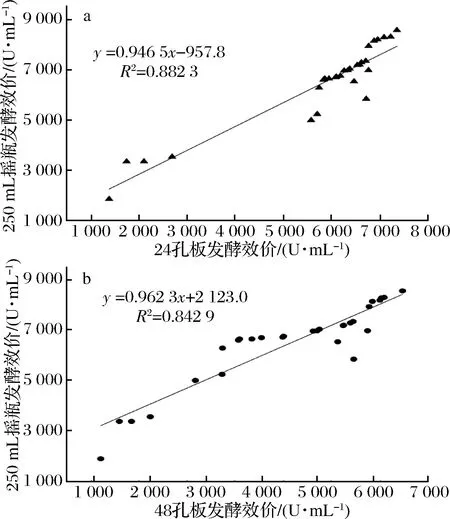
a-24孔板发酵;b-48孔板发酵图5 突变株24、48孔板效价与摇瓶效价之间的相关性Fig.5 The relationship between potency of different microplates and shake flask
由图5结果可知,在样本数为29时,摇瓶与24、48孔板发酵效价的相关性分别达到0.882 3、 0.842 9,相关性都较良好,但24孔板的发酵效价比48孔板更接近摇瓶,所以为提高硫酸新霉素产生菌选育的效率,选择24孔板作为硫酸新霉素高产突变体快速筛选的工具,后续的实验需要对24孔板发酵条件进行优化,提高24孔板发酵单位。
2.2.2 微孔板孔间差异考察
本试验均采用的是同一菌株,由表4可知,在P=0.05显著水平下,酶标板孔间差异不显著;由表5可知,在酶标板孔间差异不显著以及P=0.05显著水平下,24孔板孔间差异不显著。因此,在复筛过程中可排除系统误差。

表4 酶标板孔间差的t检验结果Table 4 The result of t-Test on difference between the holes of ELISA plate

表5 24孔板孔间差的t检验结果Table 5 The result of t-Test on difference between the holes of 24-well microplate
2.2.3 孔板发酵条件正交优化
根据弗氏链霉菌产硫酸新霉素发酵过程中对氧的需求量较大,而转速、装液量、接种量都对溶氧有一定的影响,基于前期单因素[22]预实验,本试验选定转速、装液量、接种量3种因素作为考察对象,选择3个水平,采用L9(34)正交实验设计方法[23-24]。因素水平见表6,24孔板发酵结果见表7。

表6 因素水平表Table 6 Factor level table
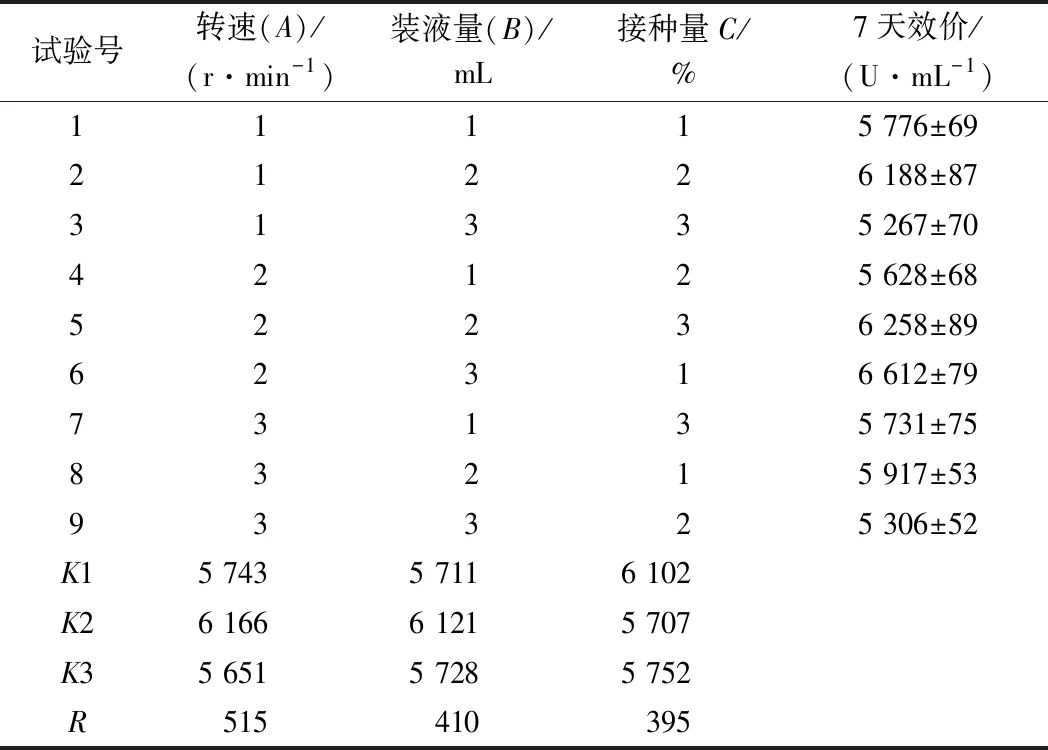
表7 24孔板发酵结果与分析Table 7 The result and analysis of 24-well microplate plate fermentation
由表7试验结果的极差分析得知,3个因素对弗氏链霉菌产硫酸新霉素发酵水平的影响主次顺序为A>B>C(即转速>装液量>接种量)。正交试验的最优组为试验6,而直观分析得出的最优组为A2B2C1,将试验组6、A2B2C1与原发酵条件对照组进行3次同期24孔板对比试验,得到硫酸新霉素发酵效价试验组A2B2C1>6>对照组,试验组A2B2C1平均效价为(6 825±77) U/mL,比对照组的(5 357±68) U/mL 提高了27.40%,由此可见,该试验方案稳定可行,最后得出24孔板最优结果为:接种量为8%,转速为220 r/min,装液量为2 mL。
3 讨论
目前文献报道关于硫酸新霉素的检测方法主要包括:(1)高效液相色谱法。在抗生素的含量与杂质的测定中,该方法灵敏度高、稳定性好、测定结果准确、使用范围广,在食品残留硫酸新霉素的检测中,这种方法检测效果良好,也适合在科研中有高准确度测定要求中使用;(2)微生物法。在灵敏度及多样品处理时表现较好,可用于硫酸新霉素产生菌菌种选育,但是这种测定方法的影响因素多,测定耗时长,故在工业生产中使用较少;(3)分光光度计法。在硫酸新霉素产量的测定中,简单、准确,适合工业中使用。但以上方法大多成本高、周期长、操作复杂,不宜用于大批量样品的检测。而酶标仪满足吸光物质浓度在一定波长下与吸光度成线性相关的规律,是实验室常用的设备[25],适用于物质的检测定量分析,且能够一次性快速检测大量的样品,在硫酸新霉素高产菌株的选育中具有高效性。
对于菌种的选育工作来说,高产突变株的筛选是一项重要的工作,筛选方法的选择对于筛选的效率有着重要的影响。而近些年来基于微孔板的高通量筛选已广泛应用于各个方面,同一块微孔板可以提供大量有相同的流体动力学特性和相同形状的微型生物反应器,这使得在试管、摇瓶上的菌体培养可以在微型化的孔板上进行。JOHN等通过对谷氨酸棒状杆菌的96微孔板发酵培养测得该培养环境中的氧气传递速率,并发现了在微孔板、摇瓶以及发酵罐培养的生长参数具有良好的一致性[26]。同时,由于微孔板体积小、装液量少,因此筛选大量突变株时耗费的培养基及样品量也少,同时检测时需要的试剂量也减少,这极大节省了筛选的成本。
本文基于多孔板发酵及酶标仪检测高通量选育模型,成功建立酶标仪测定发酵液中硫酸新霉素的方法,并对24孔板发酵条件进行单因素和正交优化,使优化后硫酸新霉素的效价较原发酵条件提高了27.40%。
