高核苷酸酵母水解物对脂多糖诱导RAW264.7细胞免疫调节的影响
2019-05-07潘聪李占东苑鹏张大力段盛林夏凯周文萱赵可心于伟厚
潘聪,李占东,苑鹏,张大力,段盛林,夏凯,周文萱,赵可心,于伟厚
1(吉林农业大学 食品科学与工程学院,吉林 长春,130118) 2(中国食品发酵工业研究院有限公司,北京,100015) 3(大连双迪科技股份有限公司,大连,116635)4(功能主食创制与慢病营养干预北京市重点实验室,北京,100015) 5(吉林工程技术师范学院 食品工程学院,吉林 长春,130052)
我国已逐渐步入老龄化社会,伴随着年龄的增长,人体的基础代谢和消化能力会逐渐下降,最终导致免疫力下降,睡眠障碍等各种常见的健康问题。营养补充不仅可以为人体提供热量、蛋白质等多种营养物质,还直接参与机体代谢,是人体免疫功能的物质基础[1-2]。免疫营养不仅可以防止营养缺乏,还能通过特定方式来刺激免疫细胞,增强机体的免疫应答,通过调控细胞因子的产生和释放,减轻过度的炎症反应[3-4]。
炎症是伴随很多疾病状态的一种共有的病理现象,如糖尿病、高血脂等疾病均与炎症反应有一定的关联。巨噬细胞是主要的炎症细胞,当其受到外界抗原(如LPS)刺激时会释放白介素-6、肿瘤坏死因子-α等一系列炎性细胞因子,从而促进炎症反应和造成组织损伤[5]。炎症是机体对感染、组织损伤及伤害性刺激等做出的保护性反应[6]。已发现炎症反应与核转录因子NF-κB、MARK、p38信号传导及转录激活因子STAT-3等信号通路相关,通过炎症信号通路中的关键分子筛选抗炎药物是研究的重要手段[7]。
酵母水解物(yeast hydrolyzate,YH)也称复合酵母,是采用纯培养食用酵母(Saccharomycescerevisiae)利用内源酶及外源酶水解,充分释放核酸、小肽等功能成分酶解自溶并经分离提取而获得的氨基酸、肽、多肽等酵母细胞中的可溶性成分。高核苷酸酵母水解物(high nucleotide yeast hydrolyzate,HNYH)富含核酸、核苷酸(AMP、CMP、GMP、UMP、IMP)、小肽、消化酶、游离氨基酸和丰富的B族维生素及酵母细胞壁[8-9]。核苷酸具有多种生物学活性,在脂类、糖类、能量代谢及蛋白质生物合成中起着重要的作用[10]。据报道,酵母核苷酸具有抗氧化,增强机体免疫力,维持机体胃肠道功能等功能,促进机体损伤修复,降低细胞凋亡,抗炎等功能活性。当经过胃肠道时,小分子肽、氨基酸可直接被吸收。核苷酸作为核酸的组成单位,几乎参与了体内所有的代谢过程,它是体内许多酶和辅酶的重要组成成分,在细胞物质能量代谢和功能调节中起重要作用[11-14]。
高核苷酸酵母水解物是一种新型、绿色、富含多种功能性成分的食品原料,具有很大的研究价值,因此,本研究通过脂多糖(lipopolysaccharide,LPS)诱导小鼠巨噬细胞系RAW264.7炎症模型,初步探讨了高核苷酸酵母水解物的抗炎作用,提高免疫力的功能活性,为高核苷酸酵母水解物的产品开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
高核苷酸酵母水解物,大连珍奥生物技术有限公司提供,蛋白含量61.95%,NaCl 0.2%,总核苷酸含量13.56%,其中AMP 0.049%、CMP 2.17%、GMP 3.39%、UMP 3.54%、IMP 4.42%;小鼠巨噬细胞株(RAW264.7),由中国食品发酵工业研究院保存;DMEM(dulbecco’s modified eagle medium)培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、平衡盐缓冲液(hank’s balanced salt solution,HBSS)、DMEM无糖培养基、胎牛血清(fetal calf serum,FBS),美国Gibco;噻唑兰(3-[4,5-dimethylthiazol-2-yl]-2,5-diphenylterazolium bromide,MTT),脂多糖(lipopolysaccharides,LPS),美国Sigma化学公司;NO试剂盒、肿瘤坏死因子-α试剂盒、白细胞介素-6试剂盒、白细胞介素-1β试剂盒、细胞核蛋白和浆蛋白抽提试剂盒、山羊抗鼠IgG/HRP二抗、山羊抗兔IgG/HRP二抗、鼠抗β-actin单克隆抗体,碧云天生物技术有限公司;β-actin、iNOS、TNF-α、IL-1β和IL-6引物合成,英潍捷基贸易有限公司;兔抗iNOS单克隆抗体、兔抗NF-κBp65单克隆抗体,Cell Signaling Technology公司;所有有机溶剂均为国产分析纯。
1.2 仪器与设备
奥林巴斯CKX41型生物显微镜,OLympus公司;CO2培养箱,松下公司;Spectra Max i3酶标仪,MD公司;pH计,上海雷磁仪器厂;GL-20G-Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;凝胶成像仪,北京五洲东方科技发展有限公司;WB显影仪,上海勤翔科学仪器有限公司;Bio-Rad CFX Maestro RT-PCR仪器,伯乐有限公司。
1.3 实验方法
称取高核苷酸酵母水解物溶于超纯水中,4 000 r/min,离心10 min取上清,0.22 μm滤膜除菌后待用。
1.3.1 RAW264.7细胞的培养
RAW264.7细胞于含有体积分数10%胎牛血清、100 μL/mL青霉素和100 μL/mL链霉素的DMEM培养基中培养(下文简称DMEM10),在37 ℃、5% CO2培养条件下常规培养。选取对数生长期细胞进行实验。对照组,DMEM10正常培养;模型组,DMEM10+LPS(1 μg/mL)共培养;样品组,DMEM10+LPS(1 μg/mL)+不同质量浓度高核苷酸酵母水解物共培养[15]。
1.3.2 MTT法测定RAW264.7细胞存活率
取对数生长期的RAW264.7细胞接种于96孔板中,每孔接种1×105个细胞。37 ℃培养24 h后弃去培养液,用PBS清洗1次,在培养基中分别加入质量浓度20、40、60、80、100、150、200和250 μg/mL的高核苷酸酵母水解物,以无检测物的相同培养基孵育细胞为对照,培养24 h后弃去培养液,加入质量浓度0.5 mg/mL MTT-DMEM10于37 ℃避光孵育2 h,小心吸弃培养液,再加入100 μL二甲基亚砜(dimethyl sulfoxide,DMSO),静置待完全溶解出MTT紫色结晶产物。使用酶标仪在490 nm处测定吸光度值。以对照组细胞的细胞存活率为100 %计算其余组别细胞存活率[16]。
1.3.3 HNYH对RAW264.7细胞吞噬中性红作用的影响
取对数生长期的RAW264.7细胞接种于96孔板中,每孔接种1×105个细胞,设对照组、模型组、样品组(高核苷酸酵母水解物质量浓度为20、40、60、80、100、150 μg/mL)培养24 h,每孔加入100 μL 0.075%中性红生理盐水溶液,培养1 h,弃去上清,用无血清的RPMI-1640洗涤2次,向各孔加入100 μL细胞溶解液(0.1 mol/L冰醋酸与无水乙醇1∶1等体积混合),室温静置过夜,待细胞全部溶解后,570 nm测吸光值[17]。
1.3.4 HNYH对RAW264.7细胞释放NO能力的影响
RAW264.7细胞按照1.3.3分组和处理方法,处理24 h后,吸取50 μL上清液于96孔板中,依次加入NO试剂盒中试剂A,B 2种反应液各50 μL,于540 nm处测OD值。
1.3.5 HNYH对RAW264.7细胞释放炎症因子的影响
将对数生长期的巨噬细胞按每孔浓度为1×105个细胞数接种于96孔板中,设对照组、模型组,样品组(高核苷酸酵母水解物质量浓度为10、50、100、150 μg/mL),且每组3个复孔,放置于细胞培养箱培养,24 h后采用碧云天试剂盒分别测定细胞IL-6,IL-1β和TNF-α的释放量[18]。
1.3.6 HNYH对LPS刺激RAW264.7细胞iNOS,TNF-α,IL-1β和IL-6mRNA的影响
RAW264.7细胞悬液接种6孔板,细胞数为1×106个/mL,每孔2 mL,分别设正常组、模型组、样品组(高核苷酸酵母水解物浓度为10、50、100、150 μg/mL),细胞培养24 h后,收集各组巨噬细胞,按照全式金试剂盒说明书提取细胞总RNA,用紫外分光光度计对RNA进行定量分析,测定RNA纯度及浓度。PCR反应条件为45 ℃ 5 min;94 ℃ 30 s,94 ℃ 5 s,60 ℃ 1 min,循环40次;PCR扩增完毕后,琼脂糖凝胶电泳检测mRNA表达情况,Bio-Rad公司图像分析成像仪进行半定量分析。引物序列及产物大小见表1[5]。

表1 实验用各目标基因特异性引物序列
1.3.7 Western blot检测NF-κB及iNOS蛋白的表达
RAW264.7细胞按照1.3.6分组和处理方法,常规培养24 h后,收集各组细胞,置于冰上,使用细胞核蛋白抽提试剂盒提取核蛋白,检测细胞核内NF-κBp65蛋白表达情况,Bradford法测定蛋白浓度。每孔上样30 μg蛋白,10% SDS-PAGE分离样品,转膜,5%脱脂奶粉封闭2 h,将膜置于1∶1 000稀释的一抗稀释液中,4 ℃过夜,TBST洗膜3次,将膜浸入以1∶1 000稀释的二抗稀释液中,室温摇床孵育1 h,TBST洗膜3次。ECL显色液显色,曝光,利用Image J软件进行灰度值分析。
1.3.8 统计学处理

2 结果与分析
2.1 HNYH对RAW264.7细胞活力的影响
由表2可知,高核苷酸酵母水解物在质量浓度20~150 μg/mL处理细胞的存活率都在95%左右,观察到细胞形态良好,没有显著差异,未观察到细胞毒性作用。质量浓度在200 μg/mL以上时高核苷酸酵母水解物对RAW264.7细胞生长有明显的抑制作用,所以在后续的实验中选择150 μg/mL为最大质量浓度。

表2 不同质量浓度高核苷酸酵母水解物对RAW264.7细胞活力的影响

2.2 HNYH对巨噬细胞吞噬能力的影响
吞噬作用是巨噬细胞发挥其免疫功能的重要方式之一,由图1可以看出,与对照组相比,模型组的细胞吞噬能力显著升高,与模型组相比,样品组质量浓度在100~150 μg/mL时,能明显地增强RAW264.7细胞的吞噬能力(P<0.05)。说明高核苷酸酵母水解物能够提高巨噬细胞的免疫活性[19]。


图1 HNYH对RAW264.7细胞吞噬中性红的影响
2.3 HNYH对LPS诱导的RAW264.7细胞NO生成量的影响
在体内,NO是通过一氧化氮合酶(NOS)催化L-精氨酸(L-Arg)产生的。iNOS主要是在炎症和免疫刺激下表达,进而催化NO持续生成,过多的NO则会促使炎症性疾病的发生和发展[5]。将1 μg/mL LPS作用于巨噬细胞RAW264.7后24 h,如图2所示,产生的NO量显著高于正常对照组,差异具有统计学意义(P<0.05),在一定浓度范围内,高核苷酸酵母水解物作用巨噬细胞后,NO的生成量随高核苷酸酵母水解物浓度的增加而降低,NO标准曲线,线性回归方程为:y=0.014 9x+0.019 8,R2=0.998 7。

图2 HNYH对LPS诱导的RAW264.7细胞内NO含量的影响
Fig.2 Effects of HNYH on the content of NO in LPS- induced RAW264.7 cells
2.4 HNYH对LPS诱导RAW264.7细胞炎症因子IL-1β、IL-6和TNF-α分泌的影响
结果如图3、图4和图5所示。
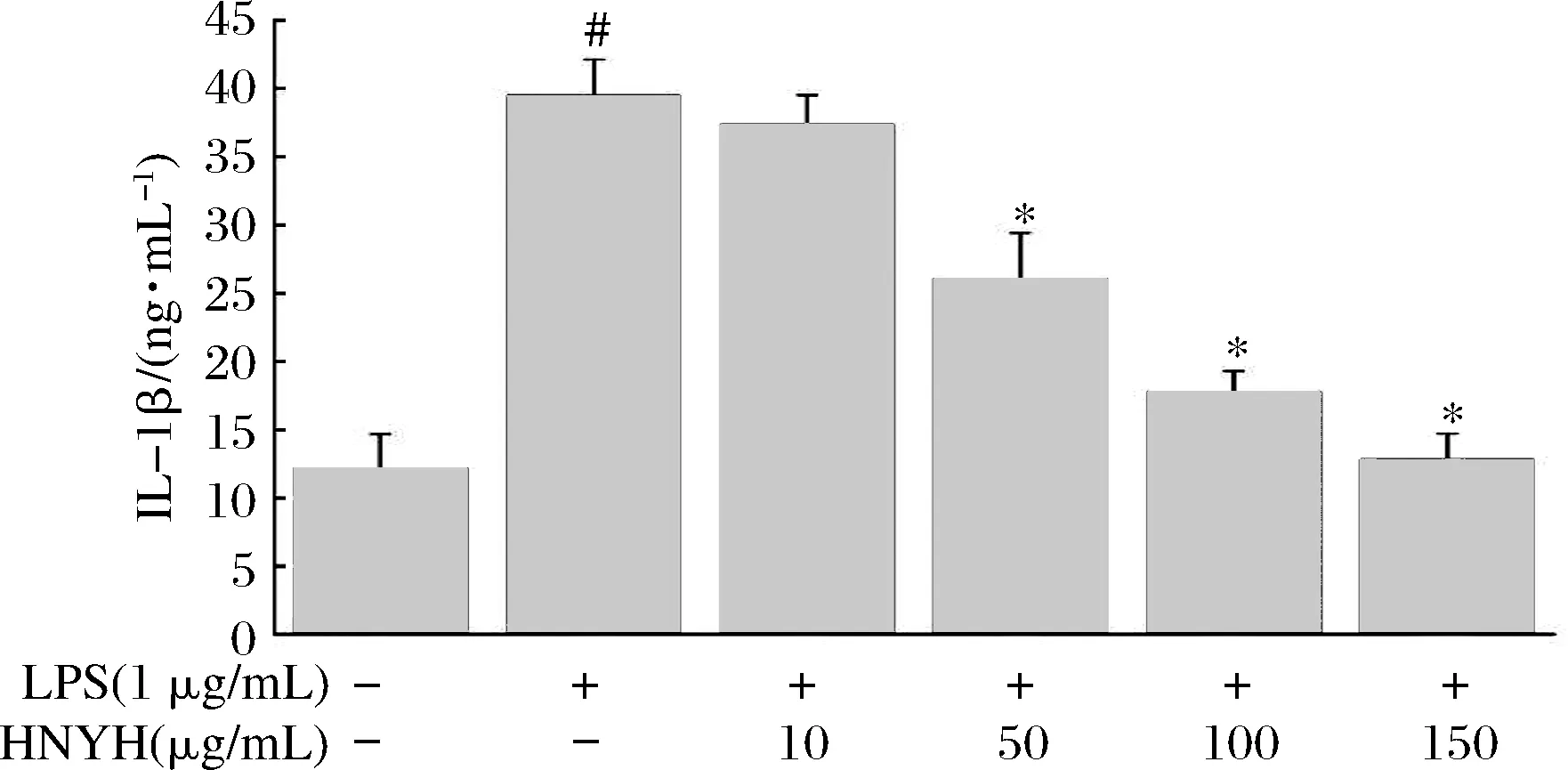
图3 HNYH对LPS诱导RAW264.7 细胞IL-1β的影响
Fig.3 Effects of HNYH on the content of IL-1β in LPS-induced RAW264.7 cells
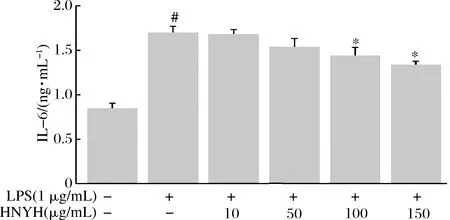
图4 HNYH对LPS诱导RAW264.7 细胞IL-6的影响
Fig.4 Effects of HNYH on the content of IL-6 in LPS-induced RAW264.7 cells

图5 HNYH对LPS诱导RAW264.7 细胞TNF-α的影响
Fig.5 Effects of HNYH on the content of TNF-α in LPS-induced RAW264.7 cells
正常组细胞上清液中IL-1β、IL-6、TNF-α分泌较少,给予1 μg/mL LPS刺激24 h后,IL-1β、IL-6和TNF-α分泌均显著增加(P<0.05),与模型组相比,高核苷酸酵母水解物组中IL-1β、IL-6和TNF-α的分泌则受到明显抑制(P<0.05),并呈现一定的剂量依赖关系。根据实验结果推测HNYH通过调节多种炎症因子的分泌来缓解LPS诱导的RAW264.7细胞炎症。
2.5 HNYH对LPS诱导的RAW264.7细胞iNOS、IL-6、IL-1β和TNF-α mRNA表达的影响
RT-PCR实验结果分析如图6显示,与对照组相比,模型组的iNOS、IL-6、IL-1β和TNF-α mRNA均显著升高(P<0.05),与模型组相比,不同质量浓度的高核苷酸酵母水解物组能够显著降低iNOS、IL-6、IL-1β、TNF-α mRNA表达。

图6 HNYH对LPS刺激RAW264.7细胞iNOS,TNF-α,IL-6,IL-1β mRNA的影响
Fig.6 The effect of iNOS,TNF-α,IL-6 and IL-1β mRNA expressionafter the intervention of total saponins of Panax japonicus on RAW264.7 cells stimulated by LPS
2.6 HNYH对LPS诱导的RAW264.7细胞iNOS和细胞核转录因子NF-κB p65蛋白表达的影响
蛋白免疫印迹实验(Western Blot)结果如图7所示,模型组细胞核内NF-κBp65蛋白的表达明显高于对照组(P<0.05);HNYH各组剂量依赖性地抑制由LPS所诱导的NF-κBp65蛋白的表达,与模型组比较,存在显著性差异(P<0.05)。

图7 HNYH对LPS刺激RAW264.7细胞NF-κBp65的影响
Fig.7 Effect of HNYH on NF-κBp65 stimulated by LPS in RAW264.7 cells
Western Blot检测结果如图8所示,对照组中,iNOS蛋白表达较低,而经LPS刺激后,RAW264.7细胞分泌的iNOS蛋白表达显著上调(P<0.05)。

图8 HNYH对LPS刺激RAW264.7细胞iNOS蛋白的影响
Fig.8 Effect of HNYH on iNOS stimulated by LPS in RAW264.7 cells
与模型组比较,高核苷酸酵母水解物(150、100、50、10 μg/L)呈浓度依赖性下调iNOS蛋白表达(P<0.05),从而抑制了NO的生成,来减轻炎症反应。说明了HNYH组通过降低RAW264.7细胞中iNOS蛋白表达,从而减少NO炎症介质的产生。
3 讨论
炎症是伴随各种疾病的一种常见病理现象,巨噬细胞是主要的炎性细胞,同时也是免疫反应的效应细胞,在机体免疫系统中起着重要的作用。研究发现,LPS作为一种炎症诱导剂可以通过与细胞膜表面受体TLR4的结合,来激活丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路,介导单核巨噬细胞的激活,诱导多种细胞因子如NO、IL-1β、IL-6、TNF-α等的合成和释放[20-22]。
体内NO是由一氧化氮合酶(iNOS)催化L-精氨酸(L-Arg)产生[5]。一氧化氮合酶是NO合成所必须的酶,分为原生型一氧化氮合酶(cNOS)和诱导型一氧化氮合酶(iNOS)[23],iNOS主要是在炎症和免疫刺激下表达,进而催化NO持续生成,过量的NO则会促进炎症性疾病的发生和发展[24-25]。因此,抑制NO的释放或iNOS表达可能是缓解炎症反应的重要靶点[26-27]。NO合成酶iNOS的表达直接决定NO分泌量,是检测炎症重要指标。目前,调节诱导型合成酶iNOS的表达和NO的合成被认为是治疗炎症疾病的重要途径。NO及iNOS mRNA表达水平的降低与中和炎症反应密切相关,iNOS是介导炎症分子机制中一个重要分子机制[7]。LPS诱导的iNOS的表达受NF-κB调控。NF-κB受刺激因子诱导激活从细胞质转移至核内,诱导多种基因的表达和多种细胞因子的释放。
在炎症反应的各阶段,NF-κB作为核转录因子起着重要的调控作用,其主要的诱导型亚基是p60/p65[28]。静息状态时,NF-κB和IκB形成的复合体存在于细胞质中。在通过LPS刺激后,IκB被活化的激酶复合体(IκBkinase,IKK)磷酸化,NF-κB与IκB解离,游离的NF-κBp65迅速转移到细胞核并与κB结合位点结合,从而启动炎性介质及促炎症细胞因子的转录与表达[29-31]。
综上所述,通过LPS诱导的RAW264.7细胞体外细胞炎症模型中,模型组的炎症因子iNOS、TNF-α、IL-6和IL-1β表达明显上升,核NF-κB p65 和iNOS蛋白表达明显上调,说明NO、TNF-α、IL-6和IL-1β释放,NF-κB信号通路被激活,证明细胞炎症模型构建成功,与模型组相比高核苷酸酵母水解物组中NO、IL-1β、IL-6和TNF-α的分泌则受到明显抑制,并呈现一定的剂量依赖关系。高质量浓度HNYH能显著抑制NO、IL-1β、IL-6、TNF-α的释放,然后又采用RT-PCR法检测细胞中iNOS、TNF-α、IL-6和IL-1β mRNA表达,各剂量组(10、50、100、150、μg/mL)均能抑制iNOS、TNF-α、IL-6和IL-1β mRNA表达。可知HNYH通过调控炎症因子基因的表达进而抑制炎症因子的过度释放,起到抗炎作用。
Western Blot检测证实了HNYH能够调控激活RAW264.7细胞核因子NF-κB通路,通过抑制iNOS表达,进一步抑制NO和炎性因子TNF-α、IL-1β和IL-6的产生,降低iNOS、TNF-α、IL-6和IL-1β mRNA表达,具体作用机制仍需进一步深入研究。炎症反应和慢性病总是有着密不可分的联系,HNYH作为一种天然的具有抗氧化、增强免疫力等功能性营养食品添加剂,本研究可能为食疗干预慢性病提供一定的基础理论依据。
