密度泛函理论研究吲哚并咔唑同分异构体结构,芳香性和光谱性质
2019-04-28郭雅晶周瑶瑶李秀燕
郭雅晶, 周瑶瑶, 李秀燕
(1. 太原师范学院物理系,晋中 030619; 2. 太原理工大学物理与光电工程学院,太原 030024)
1 引 言
吲哚并咔唑化合物存在于许多纯天然产品和人工合成材料中[1]. 由于吲哚环的稠合是在不同的位置上并且以不同的方式稠合,所以这类化合物具有五种基本骨架结构(即五种同分异构体):吲哚并[2,3-a]咔唑,吲哚并[2,3-b]咔唑,吲哚并[2,3-c]咔唑,吲哚并[3,2-a]咔唑,吲哚并[3,2-b]咔唑[1]. 这五个分子通过共享C-C键和不同方位及方位角上的N个原子来得以区分,并且这些分子已被很多研究者通过实验来测试[2]. 1977年,欧姆拉研究小组捕获了第一个吲哚[2,3-a]咔唑生物碱,该生物碱被命名为星形链霉菌属的星形孢菌素[2]. 在后来的研究中,许多研究人员从土壤和海洋微生物中分离出大量吲哚卡唑化合物[3,4]. 到目前为止,这种化合物已被分离出来的数量已超过130种[5]. 吲哚并[2,3-a]咔唑具有大环分子的基本结构,还具有阴离子识别作用,因此可作为化学传感器使用[6]. 此外,由于吲哚并[2,3-a]咔唑具有丰富的电效应,而且在芳香族化合物聚集的超分子化学中具有自组装的特性[7]. 吲哚并[3,2-b]咔唑具有相对较宽的带隙和较低的最高占据分子轨道(HOMO),这使得它在空气中具有比戊烯较强的氧化稳定性[8,9],从而在有空气的环境条件下实现了低成本的制造. 此外,吲哚并[3,2-b]咔唑共聚物被报道为潜在的光伏材料[10,11].
这些化合物通常具有较宽的带隙和较低的高占据分子轨道(HOMO). 这些分子的共轭平面结构有助于载流子传输,再加之其大平面刚性结构使这些化合物具有良好的热稳定性. 吲哚并咔唑化合物由于其良好的发光性能和潜在的应用前景被视为研究热点;随着其生物活性逐渐受到研究者关注,这些化合物作为分子材料在材料应用研究方面也逐渐成为热点,并显示出巨大的潜在应用前景[12-14]. 基于这类分子骨架的特殊性,通过应用理论计算方法研究了五种吲哚并咔唑异构体的电子结构、芳香性和光谱性质. 据研究所知,吲哚并咔唑异构体的芳香性和重组能尚未得到研究. 下文计算结果表明,这五个同分异构体适用于P型传输材料,每个分子的三个苯环均具有共轭效应.
2 计算细节
所有计算均使用高斯09软件包进行[15]. 利用Becker的混合三参数泛函在Lee, Yang和Parr相关泛函(B3LYP)[16]水平上与6-31G(d,p)基组的密度泛函理论(DFT)研究了吲哚并[2,3-a]咔唑、吲哚并[2,3-b]咔唑、吲哚并[2,3-c]咔唑、吲哚并[3,2-a]咔唑和吲哚并[3,2-b]咔唑这五种分子的结构. 还考虑了不同的自旋多重性和初始结构,为了证实吲哚并咔唑异构体团簇结构的稳定性,还分析了振动频率. 谐波振动频率分析也在相同的理论水平上进行,以找出势能面上的最小值. 这里考虑的所有分子都具有零数量的虚频率(NIMAG=0). 分子轨道(MO)图像通过GAUSSVIEW 5.0[17]软件生成. 此外,还研究了电离势(垂直和绝热)和电子脱离能(垂直和绝热). 团簇芳香性通过离域分子轨道、非独立核化学位移(NICSs)[18]、共振能量等来评估. 为了表示σ或π芳香性的性质,在B3LYP/6-31G(d,p)基组水平上,使用GIAO[19]计算了环中心或笼中心[NICS(0)]和环平面上1Å[NICS(1)]处的NICS值. 共振能量使用B3LYP方法和6-31G(d,p)基组来细化. 通过B3LYP/6-31G(d,p)计算,获得了吲哚并[2,3-a]咔唑、吲哚并[2,3-b]咔唑、吲哚并[2,3-c]咔唑、吲哚并[3,2-a]咔唑和吲哚并[3,2-b]咔唑的最高占据轨道(HOMO)和最低未被占据轨道(LUMO)能量间隙.
为了研究溶剂对所研究复合物的选定性质的影响,因此选择极化连续介质模型(PCM)中的自洽反应场(SCRF)进行理论计算[20,21]. 因此,在B3LYP/6-31G(d,p)[22]理论水平上,采用含时密度泛函理论(TD-DFT)方法进行了吸收光谱和发射光谱的计算,并通过使用可极化连续体模型(PCM)方法,在二氯甲烷溶剂中求解了20个激发态的光谱.
3 结果和讨论
3.1 几何结构
构建了吲哚并[2,3-a]咔唑、吲哚并[2,3-b]咔唑、吲哚并[2,3-c]咔唑、吲哚并[3,2-a]咔唑和吲哚并[3,2-b]咔唑的多种可能结构,此外还考虑了这些分子的不同自旋态,最后经过B3LYP/6-31g(d,p)优化以及计算频率,确定了最低能量稳定结构. 这五个同分异构体分子的最低能量稳定结构如图1所示,并且在同基组水平下计算了吲哚并咔唑异构体的主要键长、键角和扭转角,见表1. 结果表明,吲哚并[3,2-a]咔唑的C-N键长和C-C键长与Zhao G[23]的结果一致;然而,吲哚并[2,3-a]咔唑的C-N键长度分别为1.388和1.390Å,此结果略长于Zhao G(分别为1.38和1.39Å),这是由于两者所选取的高斯软件版本不同.

图1 吲哚并咔唑同分异构体结构Fig. 1 Structures of indolocarbazole isomers.
表1 吲哚并咔唑同分异构体的主要键长(Å),键角(°)和扭转角(°)
Table 1 The main bond lengths(Å), bond angles(°) and torsion angles(°) of indolocarbazole isomers
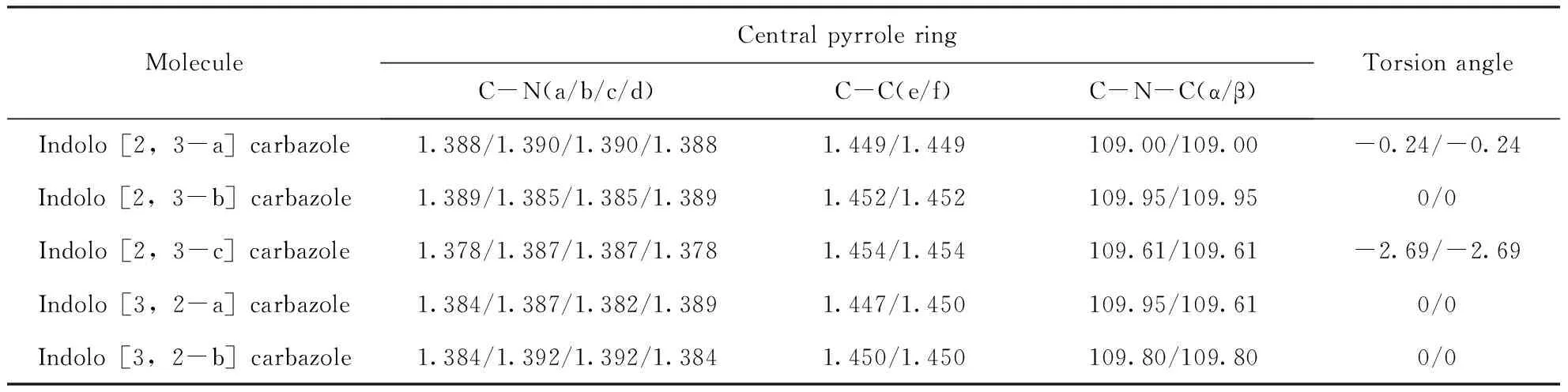
MoleculeCentral pyrrole ringC-N(a/b/c/d)C-C(e/f)C-N-C(α/β)Torsion angleIndolo[2,3-a]carbazole1.388/1.390/1.390/1.3881.449/1.449109.00/109.00-0.24/-0.24Indolo[2,3-b]carbazole1.389/1.385/1.385/1.3891.452/1.452109.95/109.950/0Indolo[2,3-c]carbazole1.378/1.387/1.387/1.3781.454/1.454109.61/109.61-2.69/-2.69Indolo[3,2-a]carbazole1.384/1.387/1.382/1.3891.447/1.450109.95/109.610/0Indolo[3,2-b]carbazole1.384/1.392/1.392/1.3841.450/1.450109.80/109.800/0
表2给出了B3LYP/6-31g(d,p)计算所得的基态参数,即基态对称性、最低频率、结合能、平均结合能、温度、压力、零点能、最高占据能HOMO、最低未被占据能LUMO和能隙. 吲哚并咔唑异构体的点群(基态对称性)参数分别为C2、C2V、C2、CS和C2h,使用该水平基组计算的最低频率都是正数,这意味着它们位于势能面的局部最小值. 基态结构下结合能与平均结合能的计算结果均为负数,表2中的基态参数进一步说明B3LYP/6-31g(d,p)下优化后的吲哚并咔唑异构体是基态稳定结构. 该计算中设定优化环境温度为298.15 K,压力为1 atm,此外,能量间隙是指最高占据轨道(HOMO)能量值与最低未被占据轨道(LUMO)能量值之差的绝对值. HOMO、LUMO和能隙的结果与Govindaswamy Ranganathan Ramkumaar[24,25]的结果一致. 这更进一步说明,所选取的理论计算方法及基组水平是合理的. 吲哚并[3,2-b]咔唑的HOMO、LUMO和能隙值分别为-4.932、-1.015和3.917 eV,与其他吲哚并咔唑异构体相比其能隙最小,这是由于它的苯基和核心组间HOMO (LUMO)的能量差异越大,导致干扰相互作用越小,因此吲哚并[3,2-b]咔唑中苯基对HOMO (LUMO)的贡献越小.

表2 吲哚并咔唑同分异构体基态参数
3.2 重组能
图2列出了所有前线分子轨道(图中横坐标下的1,2,3,4,5分别对应吲哚并[2,3-a]咔唑,吲哚并[2,3-b]咔唑,吲哚并[2,3-c]咔唑,吲哚并[3,2-a]咔唑和吲哚并[3,2-b]咔唑分子). 如图2所示,五个分子的HOMO和LUMO能级π轨道特征以及离域的程度均在所有异构体的原子核,与此同时HOMO轨道主要执行π键轨道而LUMO轨道主要执行π*反键轨道. 除了吲哚并[3,2-a]咔唑外,其他异构体的N原子上的p轨道不会与苯环平面形式有效p-π共轭,与此同时在LUMO轨道上N原子的p轨道几乎没有贡献. 吲哚并[3,2-a]咔唑的N原子之一是在HOMO轨道上形成有效的p-π共轭,尽管来自N原子的p轨道组成比例在LUMO轨道上降低,但仍然高于其他四个分子.

图2 吲哚并咔唑同分异构体的最高占据轨道和最低未被占据轨道能级Fig.2 The HOMO and LUMO orbital energy levels of indolocarbazole isomers.
表3给出了这五个同分异构体的电离势(IP,eV)、电子亲和能(EA,eV)、空穴/电子提取势(HEP/EEP,eV)和空穴/电子重组能量(λh/λe,eV). 从表2和表3可以看出,共轭键的电离势和电子亲和能的变化与HOMO和LUMO能级的变化一致,相同共轭键的化合物的HOMO能级显著降低,同时LUMO能级几乎不变;反映在电离势和电子亲和能上,电离势显著增加,电子亲和能基本相等. 另一方面,如图2中所示,吲哚并咔唑异构体的HOMO能级大小顺序为5>3>2>4>1,并伴随有电离势随其顺序逐渐增加;异构体的LUMO能级大小顺序为4>2>1>3>5,电子亲和能值随其顺序逐渐增加. 从表3中可以看出,这些分子团簇的空穴/电子重组能量值λh和λe大小顺序为:4>2>1>3>5. 吲哚并[3,2-b]咔唑的空穴/电子重组能值最小,说明吲哚并[3,2-b]咔唑的空穴迁移率和电子迁移率在吲哚并咔唑异构体中最好. 此外,吲哚并[3,2-b]咔唑的空穴重组和电子重组能更接近,所以空穴迁移率相当于电子迁移率,有利于载体平衡传输和传输效率. 载流子的传输与前线分子轨道的分布密切相关,通常LUMO (HOMO)能级的离域化程度越大,越有利于电子(空穴)的传输[26]. 刘莲梅科研小组[26]确认p型输运材料IPA在5.680~6.786 eV范围内,n型输运材料EAA在2.411~3.141 eV范围内,IPA和EAA材料的双极性传递应在5.905~7.026 eV和2.797~3.479 eV范围内,从表3可以看出,这五个分子均属于p型输运材料.
表3 吲哚并咔唑同分异构体的电离势(IP, eV)、电子亲和能(EA, eV)、空穴/电子提取势(HEP/EEP, eV)和空穴/电子重组能量(λh/λe, eV)
Table 3 Ionization potentials(IP, eV), electronic affinities(EA, eV), hole/electron extraction potentials(HEP/EEP, eV) and hole/electron reorganization energies(λh/λe, eV) of indolocarbazole isomers
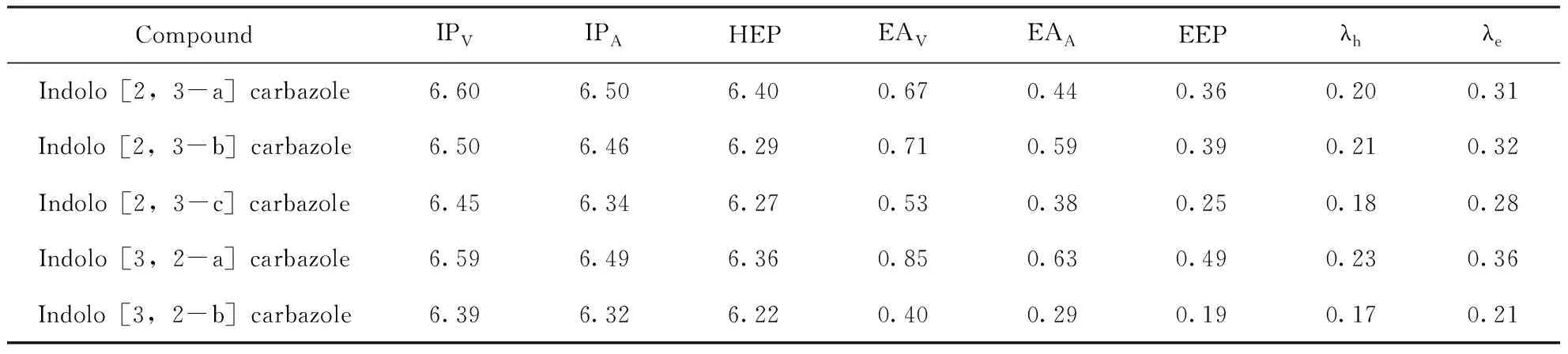
CompoundIPVIPAHEPEAVEAAEEPλhλeIndolo[2,3-a]carbazole6.606.506.400.670.440.360.200.31Indolo[2,3-b]carbazole6.506.466.290.710.590.390.210.32Indolo[2,3-c]carbazole6.456.346.270.530.380.250.180.28Indolo[3,2-a]carbazole6.596.496.360.850.630.490.230.36Indolo[3,2-b]carbazole6.396.326.220.400.290.190.170.21
3.3 芳香性
采用GIAO-B3LYP/6-31g(d, p)法计算吲哚并咔唑异构体的核独立化学位移值(NICS)来表征这些分子的芳香性. 将当前NICS的参考点设置在两个位置,如表4中,NICS(0.00nm)位于吲哚并咔唑异构体每个环的几何中心,NICS(0.10nm)位于几何中心垂直距离0.10nm处;分别在每个位置放置一个鬼(ghost)原子,并计算相应的NICS值. 结合图1与表4得出,所有吲哚并咔唑异构体中的每个环均具有芳香性. 如表4所示,随着鬼原子垂直距离的增大,所有分子的环2、环3、环4的芳香性减小;相反,环1和环5的芳香性随着鬼原子垂直距离的增加而增加. 对于芳香性体系,通常屏蔽值是正的,而NICS是负的,主要是因为共轭环引起的外部磁场对环电流感应磁场有一定程度的抵消(屏蔽)作用. NICS(0.10 nm)主要测量的是π芳香性. 由以上结论可知,每个分子的三个苯环都具有共轭效应.
3.4 吸收和发射谱
用高斯曲线拟合的吲哚并咔唑同分异构体的吸收和发射光谱如图3和图4所示. 这五个分子的吸收光谱曲线特征(图3)都具有两个显著的吸收峰和一个较差的吸收峰. 最低能量的吸收峰(>290 nm)主要是由于每个环上的每个分子的π-π*键过渡引起的,而较高能量的吸收峰(200-290 nm)主要是由于N原子杂环和苯环之间的π-π*键过渡引起的. 吲哚并咔唑异构体的垂直激发能和拟合的吸收峰列于表5中,结果表明,吲哚并[2,3-a]咔唑和吲哚并[3,2-a]咔唑的激发能与实验吸收波长吻合较好[27],从实验中分子体系的中心苯环对甲基取代基的影响来看,存在着细微的差异. 上述结果表明,基于这些分子的仿真方法能够得到较好的结果.
虽然同分异构体的吸收光谱差异较小,但发射光谱(图4)结果有明显差异. 表6列出了吲哚并[2,3-a]咔唑和吲哚并[3,2-a]咔唑的同分异构体转移特征、理论计算值及相关实验值[27]. 将表5和表6对比可得:吲哚并[2,3-a]咔唑的最低发射能主要来自电子LUMO→HOMO跃迁,而其最低吸收能主要来自电子LUMO→HOMO-1跃迁;按照对称性,吲哚并[2,3-a]咔唑中来自电子LUMO→HOMO跃迁产生的最低发射能主要对应于其电子LUMO→HOMO-1跃迁产生的最低吸收能量,剩余其他分子的电子跃迁产生的最低发射能也来自电子跃迁产生的最低吸收能. 比较振子强度发现,三个近似线性分子(吲哚并[2,3-a]咔唑,吲哚并[2,3-b]咔唑和吲哚并[3,2-b]咔唑)的电荷转移跃迁振子强度更大,吲哚并[2,3-c]咔唑和吲哚并[3,2-a]咔唑可以由于其构型特征而保持高能发射. 比较结果表明,吲哚并[2,3-b]咔唑在这些分子中的振子强度最大.
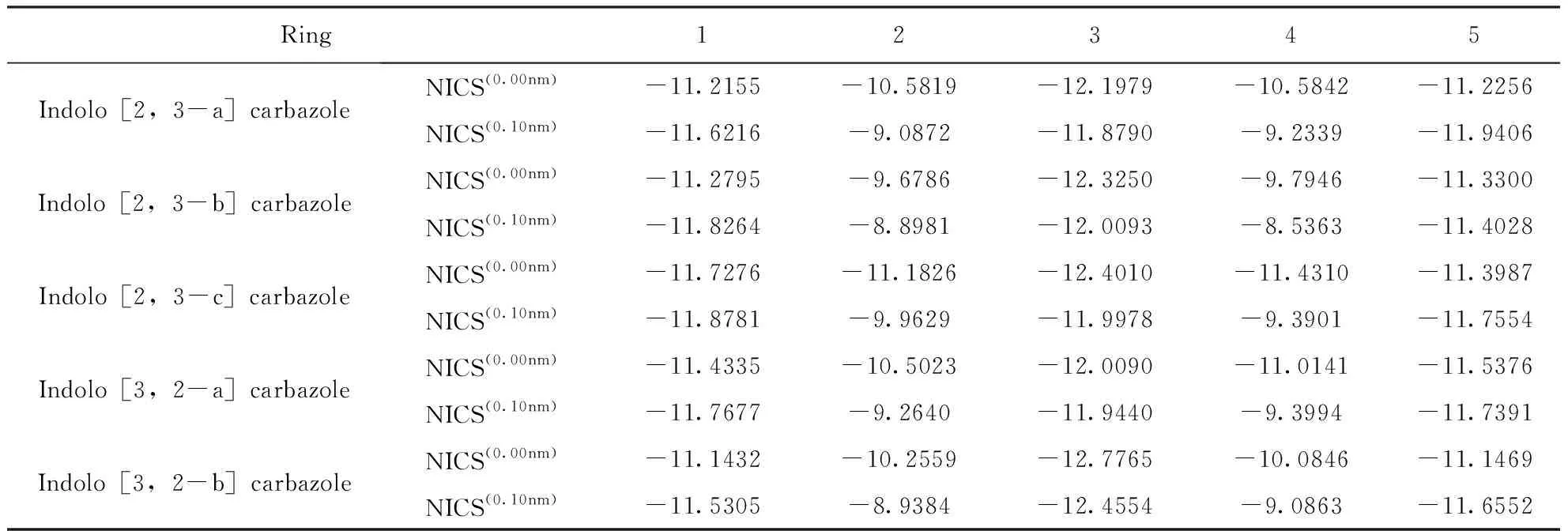
表4 吲哚并咔唑同分异构体基态下的核独立化学位移值NICS(ppm)
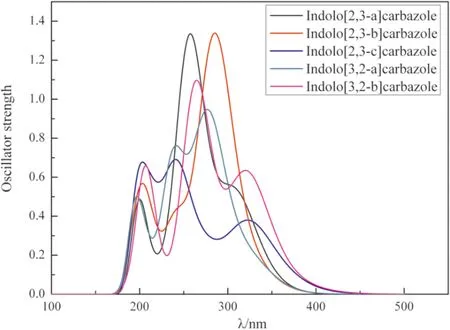
图3 吲哚并咔唑同分异构体在CH2Cl2溶剂下的吸收光谱Fig. 3 Absorption spectra of indolocarbazole isomers in CH2Cl2 solution.
4 结 论
基于密度泛函理论(B3LYP)在6-31g(d,p)水平上,研究了优化后的性能(基态结构参数、结合能、能隙、芳香性、重组能). 结果表明,吲哚并咔唑异构体(吲哚并[2,3-a]咔唑,吲哚并[2,3-b]咔唑,吲哚并[2,3-c]咔唑,吲哚并[3,2-a]咔唑和吲哚并[3,2-b]咔唑)基态结构对称性分别为C2、C2V、C2、CS和C2h.
表5 用TD-DFT计算得到吲哚并咔唑异构体在CH2Cl2溶剂中的吸收特性
Table 5 Absorption properties of indolocarbazole isomers in CH2Cl2solution obtained with the TD-DFT calculations

IsomerTransitionEver/nmOscillatorstrengthλexp/nm[27]Indolo[2,3-a]carbazole1A→1BHOMO-1→LUMO(89%)308.040.59043231A→1BHOMO→LUMO+2(84%)256.151.34542591A→1BHOMO-3→LUMO+1(46%)HOMO-2→LUMO+3(50%)199.680.4957Indolo[2,3-b]carbazole1A1→1B2HOMO→LUMO+1(73%)285.521.35631A1→1B2HOMO-1→LUMO+2(82%)243.670.45541A1→1B2HOMO-2→LUMO+2(47%) HOMO→LUMO+5(43%)202.780.5845Indolo[2,3-c]carbazole1A→1BHOMO-1→LUMO(95%)323.420.39011A→1BHOMO→LUMO+2(94%)246.950.70091A→1AHOMO-2→LUMO+2(57%)198.400.6997Indolo[3,2-a]carbazole1A’→1A’HOMO-1→LUMO+1(68%)277.540.95382821A’→1A’HOMO-3→LUMO(29%)HOMO-2→LUMO+1(32%)247.140.75301A’→1A’HOMO-2→LUMO+3(33%)HOMO-1→LUMO+5(43%)194.380.5018Indolo[3,2-b]carbazole1BU→1BUHOMO-1→LUMO(94%)321.500.65381BU→1BUHOMO→LUMO+2(93%)264.831.10481BU→1BUHOMO-1→LUMO+4(58%)208.960.6807

图4 吲哚并咔唑同分异构体在CH2Cl2溶剂下的发射光谱Fig. 4 Emission spectra of indolocarbazole isomers in CH2Cl2 solution.
表6 用TD-DFT计算得到吲哚并咔唑异构体在CH2Cl2溶剂中的发射特性
Table 6 Emission properties of indolocarbazole isomers in CH2Cl2solution according to the TD-DFT calculations

IsomerTransitionEver/nmOscillatorstrengthλexp/nm[27]Indolo[2,3-a]carbazole1A→1ALUMO→HOMO(100%)365.900.09073911B→1ALUMO→HOMO-1(93%)323.250.87221B→1ALUMO+1→HOMO(89%)289.030.3871Indolo[2,3-b]carbazole1A1→1A1LUMO→HOMO(100%)351.260.03901B2→1A1LUMO→HOMO-1(85%)335.950.33691B2→1A1LUMO+1→HOMO(84%)300.521.7595Indolo[2,3-c]carbazole1A→1ALUMO→HOMO(100%)395.210.15041B→1ALUMO→HOMO-1(100%)335.910.58031B→1ALUMO+1→HOMO(100%)301.090.2030Indolo[3,2-a]carbazole1A’→1A’LUMO→HOMO(95%)348.550.38213701A’→1A’LUMO→HOMO-1(90%)320.500.13423551A’→1A’LUMO+1→HOMO(88%)294.770.3499Indolo[3,2-b]carbazole1BU→1BULUMO→HOMO(100%)392.420.09141BU→1BULUMO→HOMO-1(98%)335.971.1132
这五个分子均是p型输运材料. 由以上结论可知,每个分子的三个苯环具有共轭效应. 通过与实验结果的比较,得到了更精确的理论计算结果,与实验结果吻合较好. 由于几何结构的不同,五种吲哚并咔唑异构体在性质上存在明显差异. 线性分子(吲哚并[2,3-a]咔唑,吲哚并[2,3-b]咔唑和吲哚并[3,2-b]咔唑)有助于提高环间电荷转移跃迁的振子强度.
