低温对CANON型序批式生物膜反应器脱氮的影响
2019-04-28朱振华丁亚男吴少贤李苏青刘晓霞
王 振,朱振华,丁亚男,吴少贤,李苏青,刘晓霞
低温对CANON型序批式生物膜反应器脱氮的影响
王 振1*,朱振华2,丁亚男1,吴少贤1,李苏青1,刘晓霞3
(1.安徽农业大学资源与环境学院,农田生态保育与污染防控安徽省重点实验室,安徽 合肥 230036;2.德州职业技术学院,山东 德州 253034;3.浙江省农业技术推广中心,浙江 杭州 310020)
探究了4种低温水平下基于亚硝化的全程自养脱氮(CANON)型序批式生物膜反应器(SBBR)的运行效果及其氮素转化机制.结果表明,当CANON型SBBR在不同的低温水平下稳定运行后,其脱氮微生物优势菌群发生了不同程度的变化,随之改变了系统的氮素转化途径及其脱氮性能.当温度>15℃时,SBBR中AOB和anammox菌的丰度与活性未受到明显抑制,CANON作用始终是系统脱氮的主要途径,SBBR对TN的平均去除率亦较为理想;而当温度<15℃时,anammox菌的丰度与活性在10,5℃下分别出现不同程度的降低,进而改变了SBBR的氮素转化途径,使其脱氮性能出现不同程度的恶化.在10℃时,NOB的增殖及其活性的提高使硝化/反硝化作用取代CANON作用成为SBBR脱氮的主要途径,此时系统对TN的去除率骤降至(16.87±4.79)%;在5℃时,反硝化过程中第1步还原反应的停滞与反硝化菌对NO2--N利用率的提高使SBBR中氮素的去除依赖于CANON作用和短程硝化/反硝化作用的协同,系统对TN的去除率为(54.83±3.68)%.
序批式生物膜反应器(SBBR);低温;基于亚硝化的全程自养脱氮(CANON);厌氧氨氧化;氮素转化
基于亚硝化的全程自养脱氮(CANON)工艺是近年发展起来的一种新型脱氮工艺.该工艺依赖于好氧氨氧化菌(AOB)和厌氧氨氧化(anammox)菌的协同关系,可在单级反应体系中同时实现短程硝化与anammox反应[1].相比于传统脱氮技术,CANON工艺可节省63%的耗氧量和将近100%的外加有机碳源[2],因而在污水生物脱氮过程中具有诸多优势.近年来,越来越多的研究尝试将该工艺用于城市生活污水的处理,以期为其中氮素的高效去除寻找新途径[3-4].然而,由于该类污水的水温相对较低且变化幅度较大(5~20℃)[5-6],CANON工艺需应对低温带来的挑战.
研究表明,当CANON工艺稳定运行时,反应装置的运行温度宜维持在30~35℃,以确保系统内短程硝化和anammox反应之间的动态平衡[7].然而,由于CANON系统中微生物种类的多样性及其相互间的复杂关系,当其在低温下运行时,现有相关研究得出的结论却并不统一.有研究指出,当温度低于25℃时,CANON系统中的短程硝化过程易遭破坏,anammox菌的活性亦会受到不同程度的抑制,由此会影响系统的脱氮性能及其稳定性[8-9].也有研究发现,温度的降低(30℃→12℃)虽会对anammox菌的活性产生抑制,甚至会引起亚硝酸盐氧化菌(NOB)的增殖,但CANON系统仍能正常运行,其中的脱氮微生物优势菌群并无显著变化[10-12].
本文以CANON型序批式生物膜反应器(SBBR)为试验装置,通过改变其运行温度,考察了不同低温水平下系统脱氮性能及其微生物特性的变化,建立了各低温水平下SBBR脱氮性能和微观生物学特征之间的定量响应关系,并对不同低温水平下系统中每种形态氮素的转化途径进行了解析,旨在揭示CANON工艺在不同低温条件下的脱氮机制,进而完善该工艺的调控策略,为其高效稳定运行及工程化应用提供参考.
1 材料与方法
1.1 试验装置与运行方式
试验装置为有效容积均为6.0L的4套SBBR (图1).各SBBR均每天运行4个周期,每个周期时长为360min,由进水期(15min)、间歇曝气期(270min)、沉淀期(30min)、排水期(15min)和闲置期(30min)5个阶段组成.各SBBR在每个周期内的进水和排水体积均为4.0L.在间歇曝气期间,SBBR采用15min曝气/15min搅拌的方式循环运行,充氧泵通过装置底部的曝气头向系统中曝气,曝气速率设置为0.50L/min.
前期研究中,笔者将各系统温度设为35℃,以生活污水为系统进水、短程硝化污泥和厌氧氨氧化污泥为种泥,采用上述运行方式强化了各SBBR中的CANON作用,使其对TN和NH4+-N的去除率均稳定在91.02%和94.16%左右.本研究将上述SBBR划分为4组(标记为S-A、S-B、S-C和S-D),根据城市生活污水的温度变化范围设置4种低温水平(20,15,10和5℃)运行.在经历了70d的适应期后,其脱氮性能相继趋于稳定,随后4组SBBR进入为期181d的试验阶段.
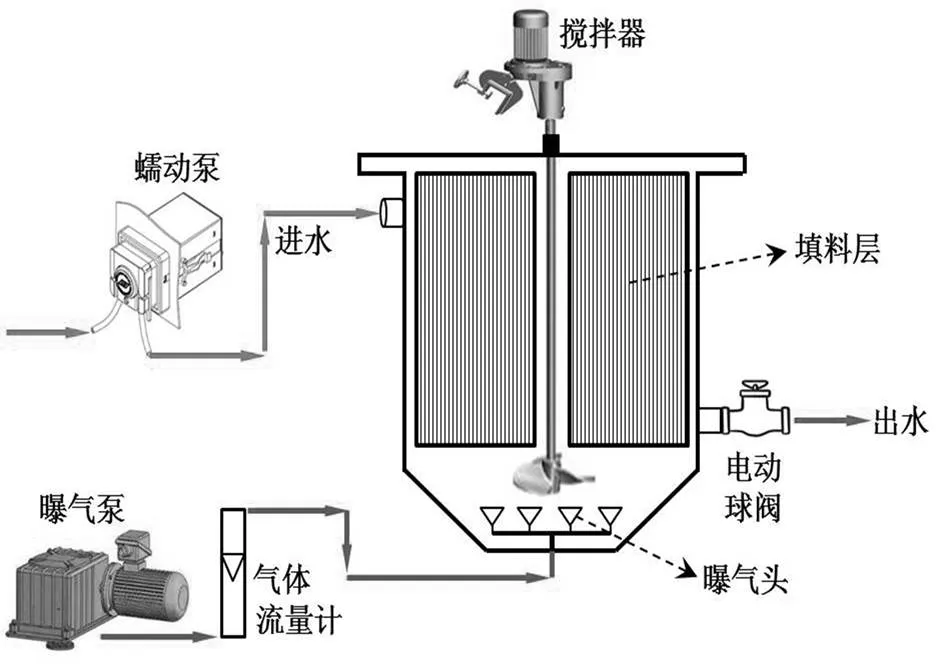
图1 SBBR试验装置
1.2 进水水质
试验用水为安徽农业大学园区内生活污水.原水经厌氧预处理后,取上清液作为各组SBBR进水.其中COD、NH4+-N、NO2--N、NO3--N、TN和TP浓度分别为(109.40±37.72),(41.45±1.80),(0.80±0.27), (0.72±0.18),(42.97±2.85),(8.64±2.39)mg/L,进水pH值为(7.74±0.58).
1.3 分析方法
1.3.1 水样采集及分析方法 每天采集各SBBR进出水水样进行分析,水样中COD、TN、NH4+-N、NO3--N和NO2--N的测定方法均参照《水和废水监测分析方法》(第四版)[13].
1.3.2 生物膜样品采集 各SBBR运行稳定后,定期(1次/15d)采集各系统中的生物膜样品以用于后续相关分析.
1.3.3 亚硝酸化活性、硝酸化活性、短程反硝化活性、反硝化活性与厌氧氨氧化比活性(SAA)的测定 各SBBR中生物膜样品的亚硝酸化活性、硝酸化活性、短程反硝化活性、反硝化活性和SAA分别利用序批式试验进行测定[14-15].其中,短程反硝化指NO2--N被还原为N2的生物化学过程[16].测定时,各项指标的试验周期为360min,试验温度同被测生物膜样品所在SBBR的运行温度.
1.3.4 功能基因定量分析 使用DNA试剂盒(D5625-01Omega USA)对各生物膜样品中的DNA进行提取纯化.提取后的DNA产物经紫外分光光度计测定核酸浓度和纯度,置于冰箱中-20℃保存.对DNA样品中的细菌16S rRNA以及生物脱氮过程中的关键功能基因(即、、、、、、和)进行荧光定量PCR测定.荧光定量PCR分析使用的仪器为Applied Biosystems StepOneTM,试验采用SYBR Green I 荧光染料法进行测试,扩增体系如下:10μL SYBR Green I PCR master mix (Applied Biosystems, USA)、8μL DEPC处理水(Applied Biosystems)、正反向引物各0.5μL、DNA模板1μL,共20μL.每种功能基因的引物种类及反应条件均参照文献[17]进行.
1.4 数据处理
采用SPSS 21.0对数据进行统计分析;采用单因素(one-way ANOVA)进行方差分析;利用逐步线性回归模型解析氮素转化速率与相关脱氮功能基因的定量响应关系;利用Origin 8.5作图.污染物的去除率以及不同形态氮素的转化速率均参照文献[18]中的方法进行计算.相关数据为平均值±标准差.
2 结果与分析
2.1 运行性能
如表1所示,4种低温水平下各系统出水中COD的平均浓度均<25.00mg/L,即试验范围内温度的变化并未影响SBBR对有机物的去除效果.鉴于进水经厌氧预处理后,其有机物含量偏低,试验期间各SBBR对COD的平均去除率维持在79.18%左右.4种低温水平亦未对各SBBR的除磷性能产生影响.然而,各系统对进水中TP的去除效果却均欠佳,平均去除率仅约为19.27%.主要归因于系统中厌氧/好氧(缺氧)交替环境的缺失以及进水中有机碳源的匮乏[19].
不同的低温水平可对SBBR的脱氮性能产生不同程度的影响(表1).S-A稳定运行后对TN和NH4+-N的去除率较前期研究并无显著变化,仍分别可达(90.55±2.36)%和(93.68±3.24)%,此时系统对TN的去除率已超过CANON体系中TN去除率的理论最大值(max≈89%)[1],出水中TN、NH4+-N、NO3--N和NO2--N的浓度分别为(4.06±0.23), (2.62±0.57), (0.78±0.36)和(0.66±0.11)mg/L.与S-A相比,S-B出水中NH4+-N和NO3--N的浓度分别增至(2.67±0.72), (3.88±0.34)mg/L,但其对TN和NH4+-N的去除率仍分别达(83.29±1.50)%,(93.56± 5.83)%.上述结果表明,当系统温度³15℃时,SBBR的脱氮性能未发生显著改变,且由S-A和S-B中各形态氮素的变化特征推断[1]:CANON作用依然是2组系统中主要的脱氮途径.然而,当系统温度<15℃后,CANON型SBBR的脱氮性能出现显著恶化.相较于S-A和S-B,S-C对TN和NH4+-N的去除率分别骤降至(16.87±4.79)%, (47.98±7.31)%,出水中NH4+-N、NO3--N和NO2--N的含量分别高达(21.56±1.81),(8.77±1.07),(5.39±0.54)mg/L.S-D对TN和NH4+-N的去除率亦远低于S-A和S-B,分别为(54.83±3.68)%,(65.72±9.01)%.然而,由于S-D出水中NH4+-N和NO2--N的积累较S-C有所缓解,致使其脱氮性能较S-C有所提高.
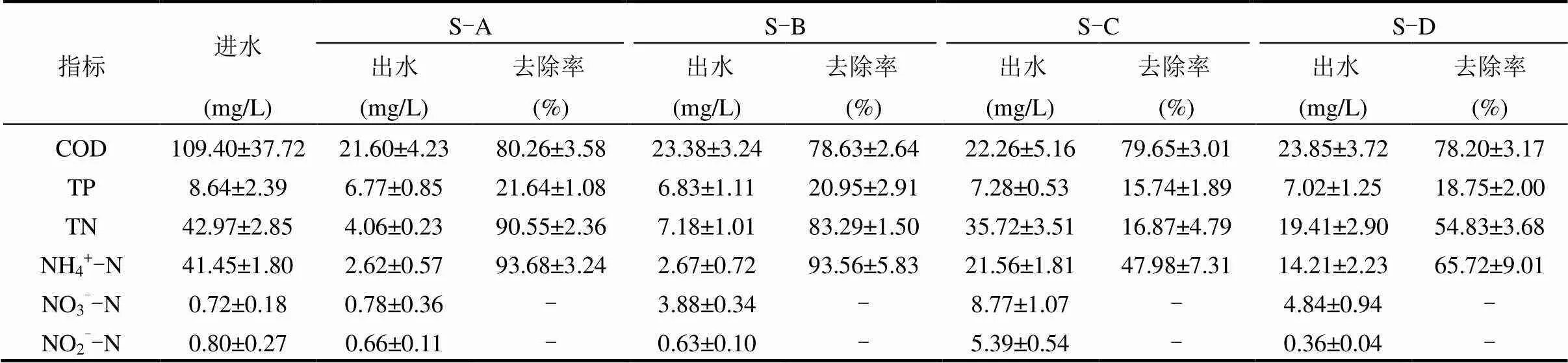
表1 不同低温水平下CANON型SBBR的运行性能
注:“-”为未计算.
2.2 脱氮功能微生物的丰度及活性
图2表明,S-A和S-B中的细菌16S rRNA基因拷贝数并无显著变化,分别为1.32×109,1.30× 109copies/g;而S-C和S-D中的细菌16S rRNA基因拷贝数却分别降至6.06×108,4.40×107copies/g,即<15℃的低温会降低SBBR中的微生物量.

和分别是参与CANON系统中NH4+-N和NO2--N转化的关键基因[17],结合图2、3可知,S-A中的和基因拷贝数分别高达3.45×105,2.59× 105copies/g,其亚硝酸化活性和SAA分别可达(7.77±1.86)mg(O2)/(gVSS·h)和(5.26± 1.26)mg(N)/ (gVSS·h).S-B中的和基因拷贝数较S-A中均无显著变化,分别为3.17×105, 2.37×102copies/g,该系统的亚硝酸化活性和SAA较S-A却略有下降,分别为(7.18±2.95)mg(O2)/ (gVSS·h)和(4.93±2.01)mg(N)/(gVSS·h).相较于S-A和S-B, S-C中的和基因拷贝数均出现了不同程度下降.其中,基因拷贝数降至3.00× 105copies/g,基因拷贝数则骤降至6.84× 103copies/g.与之相对应,此条件下S-C的亚硝酸化活性与SAA较上述2组SBBR分别降至(4.05±1.84) mg(O2)/(gVSS·h)和(0.17±0.02)mg(N)/(gVSS·h).对于S-D,其中的基因拷贝数较S-C并无显著变化,仍保持在2.64×105copies/g,但其基因拷贝数却较S-C又有所上升,稳定在1.51×105copies/g(仍低于S-A和S-B).此时,S-D的亚硝酸化活性和SAA分别为(4.53±1.73)mg(O2)/(gVSS·h)和(1.37±0.34)mg(N)/ (gVSS·h).是参与NO2--N氧化过程的关键基因[20].在CANON系统中,NOB的数量通常保持在较低水平,否则不利于CANON反应的进行与稳定[21].对于S-A,其中的基因拷贝数仅为7.57× 102copies/g,远低于和的基因拷贝数,系统的硝酸化活性亦仅为(0.44±0.16)mg(O2)/(gVSS·h);与S-A相比,S-B中的基因拷贝数增至1.78× 103copies/g,但远低于同系统中和的基因拷贝数,且S-B的硝酸化活性仍维持在(0.47± 0.25)mg(O2)/(gVSS·h);S-C中的基因拷贝数则骤增至1.31×104copies/g,其硝酸化活性亦随之提高至(2.94±0.76)mg(O2)/(gVSS·h),显著高于S-A和S-B.值得注意的是,当S-D在5℃下稳定运行时,其中的基因拷贝数与S-A相当,为5.36×102copies/g,其硝酸化活性亦处于极低水平,为(0.20±0.10)mg (O2)/(gVSS·h).

反硝化过程是反硝化菌将NO3--N最终还原为N2的生物化学过程,可表述为[22]: NO3--N→NO2-- N→NO→N2O→N2.、、、、和分别是参与上述4步还原过程的关键基因[23].其中,和均可编码NO3--N还原酶的催化中心,是参与反硝化过程第一步还原反应(NO3--N→NO2--N)的2种关键基因;而亚硝酸盐还原酶催化NO2--N还原为NO的过程则通常是反硝化过程的限速步骤,也是区别于其他硝酸盐代谢的标志性反应.亚硝酸盐还原酶包括细胞色素型(由基因编码)和Cu型(由基因编码),对和基因的定量研究能够准确反映出系统中反硝化菌群的丰度.另外,和基因分别编码NO还原酶和N2O还原酶的催化中心,分别是参与反硝化过程第3、4步还原反应的关键基因.由图2和图3可知,S-A中的、、、、和基因拷贝数分别为2.09×104,3.91×103, 1.18×104,2.38×103,1.33×104,2.28×103copies/g,其短程反硝化活性与反硝化活性分别为(0.28±0.03)mg (NO2--N)/(gVSS·h)和(0.32±0.03) mg(NO3--N)/ (gVSS·h).与其他相关研究相比[24-26],S-A的反硝化性能较差.与S-A相比,上述6种功能基因在S-B中的丰度并无显著变化,S-B的反硝化性能亦无明显改善.随着温度的进一步降低,上述6种功能基因在S-C中丰度较S-A和S-B显著升高,分别增至1.14× 105,8.74×103,2.41×105,1.03×104,6.02×104,8.48×103copies/g,其短程反硝化活性与反硝化活性相应增至(3.05±0.80)mg(NO2--N)/(gVSS·h)和(1.89±0.36)mg (NO3--N)/(gVSS·h),亦显著高于S-A和S-B.然而, S-C的反硝化性能仍处于较低水平,究其原因,应归因于进水中较低含量的有机碳源.在5℃的低温水平下,6种功能基因在S-D中的丰度分别为7.48×104, 5.38×103,1.05×105,5.86×103,5.50×104,5.07×103copies/g,其短程反硝化活性为(1.41±0.36)mg(NO2--N)/ (gVSS·h),较S-C出现下降,但仍高于S-A和S-B,而反硝化活性则骤降至(0.02±0.006)mg(NO3--N)/ (gVSS·h),远低于其他3组SBBR.
2.3 氮素转化途径解析
基于前述试验结果,利用逐步线性回归模型计算了稳定运行阶段每组SBBR中不同形态氮素(即NH4+-N、NO3--N和NO2--N)转化速率与相关脱氮功能基因(或相关脱氮功能基因组合)的定量响应关系(表2),以期解析不同低温水平下SBBR中各形态氮素的转化途径.由表2可知,4组回归模型的2值均大于0.913.
表2表明,S-A中NH4+-N去除速率[(NH4+-N)]主要受2个变量的影响,即/(+)和/,且上述2变量均与(NH4+-N)呈正相关关系.如前所述, CANON作用依赖于AOB和anammox菌的相互协同作用,而和分别是参与CANON型SBBR中NH4+-N转化的关键基因./(+)表明,CANON作用是S-A中NH4+-N去除的主要途径,且anammox菌丰度与活性的保持有助于提高CANON作用在该系统中的稳定性,进而可确保S-A对NH4+-N的高效去除.与是参与硝化过程的2种关键功能基因,其分别参与NH4+-N和NO2--N的氧化过程[6]./表明,S-A中NO2--N积累率的增加有利于其(NH4+-N)的提高.研究认为[27],短程硝化作用的实现与稳定是CANON工艺高效运行的必要条件,该试验结果与上述研究所得结论一致.S-A中NO3--N累积速率(NO3--N)亦主要受2个变量的影响,即/(+)、和.其中,/(+)与(NO3--N)呈正相关关系,该变量表明CANON作用可引起系统中NO3--N的累积.究其原因,源于CANON作用在进行过程中会产生11%左右的NO3--N[1].另一方面,与(NO3--N)却呈负相关关系.研究表明,在厌氧氨氧化工艺中,当进水C/N较低时,系统中的anammox菌可通过氧化有机物进行硝酸盐异化还原成铵(DNRA)过程[28],此过程可将anammox反应生成的NO3--N转化为可生物再利用的铵盐,进而能进一步提高anammox系统的NH4+-N去除性能.由可推断,S-A中应存在由anammox菌主导的DNRA作用,该作用可缓解系统中NO3--N的累积./和/(+)是影响S-A中NO2--N累积速率(NO2--N)的2个变量.其中,前者与(NO2--N)呈正相关关系,而后者与(NO2--N)呈负相关关系./表明短程硝化作用有助于系统中NO2--N的累积,而/ (+)则表明,S-A中的NO2--N可通过CANON作用去除.基于该组回归模型可知,CANON作用是S-A中TN去除的主要途径.另外,当进水中有机物浓度较低且C/N亦较低时,系统中anammox菌的代谢途径呈现多样化,其主导的DNRA作用可进一步提高S-A的TN去除率.
S-B中(NH4+-N)和(NO2--N)仍分别受/ (+)和/、/和/ (+)此2组变量的影响,而系统中的(NO3-- N)仅受/(+)的影响.由此推断,CANON作用依然是S-B中TN去除的主要途径,但系统中由anammox菌主导的DNRA作用此时却受到抑制,导致S-B出水中的NO3--N出现了一定程度的累积.
相较于S-A和S-B,S-C中的脱氮微生物优势菌群发生显著改变.此时其(NH4+-N)主要受/(+)和/的影响,且2变量均与(NH4+-N)呈正相关关系./(+)表明S-C中NH4+-N去除的主要途径已由CANON作用转变为硝化/反硝化作用,且短程硝化的发生与NO2--N的还原(即反硝化过程中的第2步还原反应)被视为是该作用的两个限速步骤.而/表明NOB的过量增殖不利于S-C中NH4+-N的去除,究其原因,主要归因于S-C中的DO浓度有限,过量的NOB会与AOB竞争O2,进而会对NH4+-N的氧化产生不利影响./(+)和bacterial 16S rRNA是影响S-C中(NO3--N)的2个变量.前者可反映S-C中NO3--N的积累程度,而后者则表明NOB的增殖可导致系统中的NO2--N进一步氧化为NO3--N.因而上述2变量均与(NO3--N)呈正相关关系.S-C中的(NO2--N)主要受(+)/ (+)和/的影响,且其均与(NO2--N)呈正相关关系.(+)和(+)分别是参与反硝化过程第1步和第2步还原反应的关键功能基因,(+)/(+)可体现反硝化过程中NO2--N的积累程度;而/反映的则是硝化过程中NO2--N的积累程度.由上述2变量可知,限氧环境与进水中有机碳源的匮乏应是导致S-C中NO2--N积累的主要原因.上述结果表明,10℃的低温导致了CANON型SBBR中脱氮微生物优势菌群的演替,使得硝化/反硝化作用取代CANON作用成为了S-C中TN去除的主要途径.

表2 SBBR中氮素转化速率与脱氮功能基因的定量响应关系
注:(NH4+-N)表示SBBR中NH4+-N的去除速率[mg/(L·h)];(NO3--N)和(NO2--N)则表示SBBR中NO3--N和NO2--N的累积速率[mg/(L·h)].
/(+)、/(+)和细菌16S rRNA是影响S-D中(NH4+-N)的3个变量,且其均与系统中的(NH4+-N)呈正相关关系.其中,/(+)表明CANON作用复又成为SBBR在5℃低温水平下的一种NH4+-N去除途径;考虑到系统中(+)丰度的降低及其NO3--N还原能力(即反硝化过程中的第1步还原反应)的下降,/(+)表明短程硝化/反硝化作用为S-D中NH4+-N去除的另一种途径.此外,(细菌16S rRNA)表明,S-D对NH4+-N的去除效果在一定程度上依赖于系统中微生物量的高低,即在5℃的低温水平下,CANON型SBBR中微生物量的减少已影响到其脱氮性能的提高.S-D中(NO3--N)主要受/ (+)的影响.该变量与(NO3--N)呈正相关关系,表明CANON作用可引起系统中NO3--N的积累.另外,S-D中(NO2--N)主要受/(+)和(+)/细菌16S rRNA的影响.上述2组变量均与(NO2--N)呈负相关关系,表明CANON作用和短程反硝化作用均参与了S-D中NO2--N的去除.基于该组回归模型可知,S-D中TN的去除依赖于CANON作用和短程硝化/反硝化作用的协同.
3 讨论
CANON系统除了包含协同完成脱氮功能的AOB和anammox菌之外,还存在竞争O2和NO2--N的NOB、反硝化菌以及普通异养菌[29].一旦环境条件、进水水质或运行工况等中的某一因素改变, CANON系统中的脱氮微生物优势菌群便极有可能发生变化.本研究中,20℃的低温并未对S-A中AOB和anammox菌的丰度与活性产生明显抑制, CANON作用始终是系统脱氮的主要途径,且其对TN和NH4+-N的去除效果较为理想.另外,anammox菌的代谢途径此时呈现多样化,其主导的DNRA作用进一步提高了系统的脱氮性能;在15℃时,S-B的亚硝酸化活性和SAA较S-A略有下降,且系统中anammox菌主导的DNRA作用亦受到抑制,从而导致S-B出水中的TN浓度较S-A为高,且其中的NO3--N出现了一定程度的积累,但CANON作用此时依然是系统中TN去除的主要途径,S-B对TN和NH4+-N较高的去除率便得益于该作用在系统中的保持.有研究指出[12]:当CANON装置在16~23℃下稳定运行时,系统中AOB和anammox菌的丰度较30℃时虽有所下降,但两者仍是系统中主要的脱氮功能微生物,系统对TN的去除率与去除负荷分别可达66.90%与1.02kg/(m3·d).当CANON型SBBR在10,5℃2种低温水平下稳定运行后,其中的脱氮微生物优势菌群发生显著改变,系统的脱氮性能亦出现了不同程度的恶化.Anammox作用在温度<15℃时通常会受到较大幅度的抑制,而NOB在-2~15℃的条件下却仍可生长繁殖且具有一定的生物活性[5,30-31].在10℃时,S-C中anammox菌的丰度与活性较20℃时大幅下降,其对NO2--N的亲和力随之降低,而系统中的NOB此时却由于获得竞争优势而增殖,硝化/反硝化作用取代CANON作用成为S-C中TN去除的主要途径.然而,由于系统中较严格的限氧环境及进水中有机碳源的匮乏,S-C中的硝化过程和反硝化过程进行得均不彻底,其出水中的NH4+-N和NO--N分别出现不同程度的累积,导致系统脱氮性能骤降.而在5℃时,S-D中AOB和anammox菌的丰度与活性仍均被抑制,致使NH4+-N在出水中出现积累,但由于anammox菌在此温度条件下保持着对NOB的竞争优势,CANON作用仍为S-D中TN去除的主要途径.Kumar等[32]发现, anammox菌的活性在低于10℃时会被完全抑制,且此条件下anammox作用对系统脱氮的贡献可忽略不计.然而,亦有研究[33-35]指出,anammox菌经驯化后依然能够在低温(<10℃)下保持一定的活性,并可实现系统中部分氮素的脱除.另一方面,S-D中反硝化菌对NO2--N的亲和力有所提高,此类菌群对NO2--N竞争优势的加强使得短程硝化/反硝化作用成为S-D中TN去除的另一途径.值得注意的是,此时系统中反硝化过程的第1步还原反应(即NO3--N还原为NO2--N)却基本停滞.此现象应归咎于以下原因[36-38]:低温条件下硝酸盐还原酶活性的降低使得S-D中的反硝化菌对底物(即有机碳源)的亲和力下降,从而阻碍了其对该类电子供体的利用.同时,进水中有机碳源的匮乏亦加剧了系统中NO3--N的积累.鉴于此,S-D的脱氮性能虽较S-C有所提升,但仍不理想.综上所述,由于不同的低温水平会不同程度影响SBBR中AOB、anammox菌、NOB和反硝化菌群的世代时间及其各自的关键酶活性,上述4种功能微生物在各系统中对底物(如O2、NO--N和有机碳源等)的相对竞争优势便存在较大差异,进而导致各组SBBR中的脱氮微生物优势菌群在不同的低温水平下发生了不同程度的改变,其氮素转化途径及脱氮性能随之各不相同.
4 结论
4.1 当温度³15℃时,CANON型SBBR中AOB和anammox菌的丰度与活性未受到明显抑制,CANON作用始终是系统脱氮的主要途径,系统在20,15℃下稳定运行时其对TN的去除率分别为(90.55±2.36)%和(83.29±1.50)%.
4.2 当温度<15℃时,SBBR中的脱氮微生物优势菌群会因anammox菌的丰度与活性受到显著抑制而明显改变,随之会影响系统的氮素转化途径及其脱氮性能.在10℃时,NOB的增殖及其活性的提高使硝化/反硝化作用取代CANON作用成为SBBR脱氮的主要途径,此时系统对TN的去除率骤降至(16.87± 4.79)%;而在5℃时,反硝化过程中第1步还原反应的停滞与反硝化菌对NO2--N利用率的提高使SBBR中TN的去除依赖于CANON作用和短程硝化/反硝化作用的协同,系统对TN的去除率为(54.83± 3.68)%.
[1] Zhang L, Zhang S, Peng Y, et al. Nitrogen removal performance and microbial distribution in pilot- and full-scale integrated fixed-biofilm activated sludge reactors based on nitritation-anammox process [J]. Bioresource Technology, 2015,196:448-453.
[2] Khin T, Annachhatre A P. Novel microbial nitrogen removal processes [J]. Biotechnology Advances, 2004,22(7):519-532.
[3] 李 冬,苏庆岭,梁瑜海,等.CANON颗粒污泥高效脱氮及处理生活污水实验研究 [J]. 哈尔滨工业大学学报, 2015,47(8):79-86. Li D, Su Q, Liang Y, et al. Efficient nitrogen removal from domestic wastewater by CANON granular sludge [J]. Journal of Harbin Institute of Technology, 2015,47(8):79-86.
[4] 王亚宜,黎 力,马 骁,等.厌氧氨氧化菌的生物特性及CANON厌氧氨氧化工艺 [J]. 环境科学学报, 2014,34(6):1362-1374. Wang Y, Li L, Ma X, et al. Bio-characteristics of anammox bacteria and CANON anammox process [J]. Acta Scientiae Circumstantiae, 2014,34(6):1362-1374.
[5] 张 倩,王淑莹,苗圆圆,等.间歇低氧曝气下CANON工艺处理生活污水的启动 [J]. 化工学报, 2017,68(1):289-296. Zhang Q, Wang S, Miao Y, et al. Start-up of CANON process on domestic wastewater using intermittent aeration with low DO [J]. CIESC Journal, 2017,68(1):289-296.
[6] 郑雅楠,滝川哲夫,郭建华,等.SBR法常、低温下生活污水短程硝化的实现及特性 [J]. 中国环境科学, 2009,29(9):935-940. Zhen Y, AKIO T, Guo J, et al. Partial nitrification via nitrite at ordinary and low temperature in an SBR treating domestic wastewater [J]. China Environmental Science, 2009,29(9):935-940.
[7] 王衫允,马 斌,贾方旭,等.AAO污水处理工艺中厌氧氨氧化效能及微生物交互作用 [J]. 中国环境科学, 2016,36(7):1988-1996. Wang S, Ma B, Jia F, et al. The role and microbial interaction of anammox in WWTPs with AAO process [J]. China Environmental Science, 2016,36(7):1988-1996.
[8] 付昆明,张 杰,曹相生,等.CANON反应器运行稳定性及温度冲击的影响 [J]. 环境科学, 2012,33(10):3507-3512. Fu K, Zhang J, Cao X, et al. Performance stability of CANON reactor and temperature impact [J]. Environmental Science, 2012,33(10): 3507-3512.
[9] 张 杰,付昆明,曹相生,等.序批式生物膜CANON工艺的运行与温度的影响[J]. 中国环境科学, 2009,29(8):850-855. Zhang J, Fu K, Cao X, et al. Performance of CANON process in a sequencing batch biofilm reactor and influence of temperature [J]. China Environmental Science, 2009,29(8):850-855.
[10] Tomaszewski M, Cema G, Ziembińska-Buczyńska A. Influence of temperature and pH on the anammox process: A review and meta-analysis [J]. Chemosphere, 2017,182:203-214.
[11] Gonzalez-Martinez A, Rodriguez-Sanchez A, Garcia-Ruiz M J, et al. Performance and bacterial community dynamics of a CANON bioreactor acclimated from high to low operational temperatures [J]. Chemical Engineering Journal, 2016,287:557-567.
[12] Liu T, Li D, Zhang J, et al. Effect of temperature on functional bacterial abundance and community structure in CANON process [J]. Biochemical Engineering Journal, 2016,105:306-313.
[13] 国家环境保护总局.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002:227-285. General Administration of Environmental Protection of the People’s Republic of China. Standard methods for the examination of water and wastewater [M]. Beijing: China Environmental Science Press, 2002: 227-285.
[14] 高瑶远,彭永臻,包 鹏,等.低溶解氧环境下全程硝化活性污泥的特性 [J]. 中国环境科学, 2017,37(5):1769-1774. Gao Y, Peng Y, Bao P, et al. The characteristics of activated sludge in nitrifying low DO reactor [J]. China Environmental Science, 2017, 37(5):1769-1774.
[15] 宋成康,王亚宜,韩海成,等.温度降低对厌氧氨氧化脱氮效能及污泥胞外聚合物的影响 [J]. 中国环境科学, 2016,36(7):2006-2013. Song C, Wang Y, Han H, et al. Effect of decreasing temperature on the performance and extracellular polymer substance of anaerobic ammonia oxidation sludge [J]. China Environmental Science, 2016, 36(7):2006-2013.
[16] 郑照明,李 军,杨京月,等.不同C/N比和碳源种类条件下的SNAD生物膜脱氮性能 [J].中国环境科学, 2017,37(4):1331-1338. Zheng Z, Li J, Yang J, et al. The nitrogen removal performance of the SNAD biofilm with different C/N ratios and carbon sources [J]. China Environmental Science, 2017,37(4):1331-1338.
[17] Ji G, Zhi W, Tan Y. Association of nitrogen micro-cycle functional genes in subsurface wastewater infiltration systems [J]. Ecological Engineering, 2012,44:269-277.
[18] Zhi W, Ji G. Quantitative response relationships between nitrogen transformation rates and nitrogen functional genes in a tidal flow constructed wetland under C/N ratio constraints [J]. Water Research, 2014,64:32-41.
[19] 王梅香,赵伟华,王淑莹,等.A2N2系统反硝化除磷性能的优化及稳定运行 [J]. 中国环境科学, 2016,36(11):3311-3320. Wang M, Zhao W, Wang S, et al. Denitrifying phosphorus removal performance optimization and stable operation of A2N2system [J]. China Environmental Science, 2016,36(11):3311-3320.
[20] Poly F, Wertz S, Brothier E, et al. First exploration of Nitrobacter diversity in soils by a PCR cloning-sequencing approach targeting functional gene[J]. FEMS Microbiology Ecology, 2007,63(1): 132-140.
[21] 李 冬,赵世勋,关宏伟,等.常温低氨氮CANON工艺稳定性研究 [J]. 中国环境科学, 2017,37(1):102-107. Li D, Zhao S, Guan H, et al. Stable operation of CANON process at normal temperature and low ammonia concentration [J]. China Environmental Science, 2017,37(1):102-107.
[22] Zhu X, Chen Y. Reduction of N2O and NO generation in anaerobic- aerobic (low dissolved oxygen) biological wastewater treatment process by using sludge alkaline fermentation liquid [J]. Environmental Science & Technology, 2011,45(6):2137-2143.
[23] 靳慧征,王 振,丁亚男.排水速率对潮汐流人工湿地中CANON作用的强化 [J]. 中国环境科学, 2018,38(6):2182-2192. Jin H, Wang Z, Ding Y. Effect of drainage rate on the enhancement of the complete autotrophic nitrogen removal over nitrite process in a tidal flow constructed wetland [J]. China Environmental Science, 2018,38(6):2182-2192.
[24] 魏思佳,于德爽,李 津,等.厌氧氨氧化与反硝化耦合脱氮除碳研究Ⅰ:COD/NH4+-N对耦合反应的影响 [J]. 中国环境科学, 2016, 36(3):759-767. Wei S, Yu D, Li J, et al. Simultaneous carbon and nitrogen removal by anaerobic ammonium oxidation and denitrification Ⅰ: effect of COD/NH4+-N on coupled reaction [J]. China Environmental Science, 2016,36(3):759-767.
[25] 刘常敬,李泽兵,郑照明,等.不同有机物对厌氧氨氧化耦合反硝化的影响 [J]. 中国环境科学, 2015,35(1):87-94. Liu C, Li Z, Zheng Z, et al. Effect of different organic matters on anammox coupling denitrifying [J]. China Environmental Science, 2015,35(1):87-94.
[26] 李 冬,杨 卓,梁瑜海,等.耦合反硝化的CANON生物滤池脱氮研究 [J]. 中国环境科学, 2014,34(6):1448-1456. Li D, Yang Z, Liang Y, et al. Nitrogen removal performance by CANON biological filtration with denitrification [J]. China Environmental Science, 2014,34(6):1448-1456.
[27] 李 冬,何永平,张肖静,等.MBR系统CANON工艺的快速启动及微生物种群特征 [J]. 中国环境科学, 2014,34(11):2788-2795. Li D, He Y, Zhang X, et al. The fast start-up of CANON process in MBR system and the characterization of microbes [J]. China Environmental Science, 2014,34(11):2788-2795.
[28] Castro-Barros C, Jia M, van Loosdrecht M C M, et al. Evaluating the potential for dissimilatory nitrate reduction by anammox bacteria for municipal wastewater treatment [J]. Bioresource Technology, 2017, 233:363-372.
[29] 闫 媛,黎 力,王亚宜,等.采用高通量测序分析全程自养脱氮(CANON)系统不同脱氮效能下的微生物群落结构 [J]. 北京工业大学学报, 2015,41(10):1485-1492. Yan Y, Li L, Wang Y, et al. Microbial community characteristics of a completely autotrophic nitrogen removal over nitrite (CANON) system based on high-throughput sequencing technology [J]. Journal of Beijing University of Technology, 2015,41(10):1485-1492.
[30] Zhou H, Li X, Xu G, et al. Overview of strategies for enhanced treatment of municipal/domestic wastewater at low temperature [J]. Science of The Total Environment, 2018,643:225-237.
[31] Yang Q, Peng Y, Liu X, et al. Nitrogen removal via nitrite from municipal wastewater at low temperatures using real-time control to optimize nitrifying communities [J]. Environmental Science & Technology, 2017,41(23):8159-8164.
[32] Kumar M, Lin J G, Co-existence of anammox and denitrification for simultaneous nitrogen and carbon removal-strategies and issues [J]. Journal of Hazardous Materials, 2010,178(1):1-9.
[33] Pang Y, Zhang Y, Yan X. et al. Cold temperature effects on long-term nitrogen transformation pathway in a tidal flow constructed wetland [J]. Environmental science & technology 2015,49(22):13550-13557.
[34] Hendrickx T L G, Wang Y, Kampman C, et al. Autotrophic nitrogen removal from low strength waste water at low temperature [J]. Water Research, 2012,46(7):2187-2193.
[35] Canion A, Overholt W A, Kostka J E, et al. Temperature response of denitrification and anaerobic ammonium oxidation rates and microbial community structure in Arctic fjord sediments [J]. Environmental microbiology, 2015,16(10):3331-3344.
[36] Misiti T M, Hajaya M G, Pavlostathis S G. Nitrate reduction in a simulated free-water surface wetland system [J]. Water Research, 2011,45(17):5587-5598.
[37] Nedwell D B. Effect of low temperature on microbial growth: lowered affinity for substrates limits growth at low temperature [J]. FEMS microbiology ecology, 1999,30(2):101.
[38] Pan Y, Ni B J, Yuan Z. Modeling electron competition among nitrogen oxides reduction and N2O accumulation in denitrification [J]. Environmental Science & Technology, 2013,47(19):11083-11091.
Effect of low temperature on nitrogen removal in a sequencing batch biofilm reactor with CANON process.
WANG Zhen1*, ZHU Zhen-hua2, DING Ya-nan1, WU Shao-xian1, LI Su-qing1, LIU Xiao-xia3
(1.Anhui Province Key Laboratory of Farmland Ecological Conservation and Pollution Prevention, School of Resources and Environment, Anhui Agricultural University, Hefei 230036, China;2.Dezhou Vocational and Technical College, Dezhou 253034, China;3.Zhejiang Agricultural Technology Extension Center, Hangzhou 310020, China)., 2019,39(4):1533~1541
The treatment performance and underlying molecular mechanisms of nitrogen transformation in a sequencing batch biofilm reactor (SBBR) with the complete autotrophic nitrogen removal over nitrite (CANON) process were investigated at four different low temperatures in this study. After each system achieved the stable stutus in the low temperature environment, different low temperatures resulted in different degrees of variations in the nitrogen removal performance and transformation pathways of the SBBRs, which was mainly because the original dominant bacterial communities for nitrogen removal in the system changed with the temperature during the operation. When the temperature was above 15°C, the abundances and activities of aerobic ammonia oxidizing bacteria (AOB) and anammox bacteria in the SBBR had not been significantly inhibited, the CANON process was the dominant methanism in the nitrogen removal, and the ideal average removal rates of total nitrogen were also achieved. When the temperature was below 15°C, the abundance and activitity of anammox bacteria experienced different degrees of reduction at 10 and 5°C, which led to the change of main pathway for nitrogen transformation in SBBRs, thus the various degrees of deterioration in the nitrogen removal performance. At 10°C, the proliferation and increased activities of nitrite oxidizing bacteria (NOB) made the nitrification/denitrification process replaced CANON to become the primary route of TN removal in the SBBR with the TN removal efficiency of the system declined to (16.87±4.79)%. At 5°C, the stagnation of reduction process in the 1ststage of denitrification and the increased capacity of denitrifiers to compete for NO2--N caused the removal of nitrogen in SBBR to rely on both the CANON process and the nitrification/denitrification process. The nitrogen removal rate at this status was (54.83±3.68)% in the system.
sequencing batch biofilm reactor (SBBR);low temperature;completely autotrophic nitrogen removal over nitrite (CANON);anammox;nitrogen transformation
X703.1
A
1000-6923(2019)04-1533-09
2018-09-10
国家自然科学基金资助项目(51508002);安徽省重点研究与开发计划项目(201834040011);农田生态保育与污染防控安徽省重点实验室开放基金项目(FECPP201704);安徽省高校优秀青年人才支持计划项目(gxyqZD2017016)
*责任作者, 副教授, zwang@ahau.edu.cn
王 振(1985-),男,山东德州人,副教授,博士,主要从事污水生物资源化处理与回用技术研究.发表论文30余篇.
