中江县丹参连作土壤细菌多样性研究
2019-04-26王强锋刘轶豪张凌子
陈 章,王强锋,陈 强,刘轶豪,张凌子
( 1. 四川省农业科学院农业信息与农村经济研究所,四川 成都 610066; 2. 四川省农业科学院生物技术核技术研究所,四川 成都 610066; 3. 四川农业大学资源学院,四川 温江 611130)
【研究意义】丹参(SalviamiltiorrhizaBge)为多年生草本唇形科鼠尾草属植物,以根入药,对心血管系统疾病疗效显著,是四川的主要道地中药材[1]。近年来,随着中医药大健康产业的发展,丹参人工栽培面积快速扩大,但连作障碍却成为制约优质丹参生产的重要因素,因此亟需解决连作难题,促进丹参产业可持续健康发展。【前人研究进展】王刚云和李先恩等[2-3]研究表明,大部分丹参连作障碍的发生与多种病原菌有关,且属于土传病害。近年来对丹参的研究,主要集中于丹参栽培,包括种植方式与密度[4]、生防菌剂应用与丹参品质[5-7],连作土壤浸提物变化[8-9],以及丹参轮作[10-11]和丹参不同连作年限的土壤微生物变化[12-14]等方面。目前仅有少许研究丹参连作过程中正常生长丹参根际与非根际土壤、患病丹参根际与非根际土壤真菌类群差异[12],但细菌类群变化未见报道。【本研究切入点】本论文采用可培养技术和PCR-DGGE技术,开展丹参GMP基地连作土壤细菌群落特征研究,旨在弄清楚丹参连作根际和非根际土壤细菌群落变化,为进一步解决丹参连作障碍提供依据。
1 材料与方法
1.1 土壤样品的采集
采样点在四川省中江县石泉乡GMP丹参种植基地,土壤类型为石灰性紫色土壤,土壤丹参连作8年。分别采集正常生长和患病丹参各10株连同植株与土壤一起装入无菌采样袋中带回实验室。按照患病丹参根际(HD1)和非根际(HD2),正常生长丹参根际( CK1)和非根际(CK2)收集土样。
1.2 可培养细菌多样性
1.2.1 土壤细菌的分离 采用稀释涂布平板法[15]。将土壤制成10-1~10-7系列稀释悬液,取10-5、10-6、10-7梯度,采用牛肉膏蛋白胨固体培养基平板表面涂布,37 ℃培养2~3 d,挑取单个菌落进行划线纯化,结合镜检获得供试细菌纯培养,牛肉膏蛋白胨培养基斜面保存4 ℃冰箱备用。
1.2.2 菌株DNA提取 将纯化的菌株接种至牛肉膏蛋白胨液体培养基中,28 ℃,150 r·min-1振荡培养8 h。将菌液转移至1.5 mL的EP管,4 ℃、10 000 r·min-1离心2 min,弃上清液,加入200 μl 1×TE缓冲液,再加入2 μl 20 mg·mL-1的溶菌酶和2 μl 10 mg·mL-1的蛋白酶K,37 ℃水浴1 h,后续步骤参照陈强等[16]的方法。
1.2.3 16S rDNA PCR-RFLP分析 16S rDNA序列扩增引物及反应体系参见文献[17]。PCR产物用4种限制性内切酶HaeⅢ、HinfⅠ、MspⅠ及TaqⅠ在37 ℃(TaqⅠ在65 ℃)酶切8 h。酶切反应体系为10 μl,其中包括1 μl酶(10 U·μl-1),1 μl 10×Buffer,1 μl BSA(1 mg·mL-1),5 μl 16S rDNA的PCR产物和2 μl ddH2O。酶切产物用2 %的琼脂糖凝胶在80 V电压条件电泳分离2.5 h,使用凝胶成像系统拍照,图谱采用NTSYS软件,用非加权平均连锁法(UPGMA)进行聚类分析[12]。
1.2.4 16S rDNA序列测定及系统发育树构建 采用生物琼脂糖凝DNA胶回收试剂盒(EZ-10 Spin Column PAGE Gel DNA Extraction Kit)对已扩增的16S rDNA PCR产物进行纯化,纯化后送生基因测序公司测序。在NCBI中将菌株16S rDNA序列BLAST比对,取与之相似的菌株16S rDNA序列,用MEGA 5.1构建系统发育树[18]。
1.3 免培养细菌多样性
1.3.1 土壤总DNA提取 参见文献[12],土样加入9 mL DNA 提取液混匀,再加入450 μl 溶菌酶(20 mg·mL-1),37 ℃水浴30 min,其间摇动数次;然后加入50 μl蛋白酶K (10 mg·mL-1),37 ℃水浴30 min,后续步骤参见Zhou 等[19]的方法进行。
1.3.2 PCR-DGGE 采用嵌套式PCR扩增,第一轮: 进行16S rDNA序列扩增[17],然后用特异引物GC-F984/R1378扩增第二轮获得大约430 bp的片段用于DGGE分析[20]。
取20 μl第2轮PCR产物进行DGGE,采用Bio-Rad公司的DcodeTM基因突变检测系统,DGGE参数为:8 %聚丙烯酰胺凝胶,变性剂浓度梯度35 %~65 %,150 V电压下预电泳10 min,随后在85 V的固定电压,60 ℃下电泳11 h。电泳结束后银染[21],条带克隆测序。
1.3.3 DGGE图谱分析 DGGE图谱采用Bio-rad的Quantity One分析软件进行微生物多样性分析[22]。
2 结果与分析
2.1 可培养细菌多样性
从供试丹参种植土壤共分离出46株细菌纯培养物,其中正常生长丹参根际土壤(CK1)17株,正常生长丹参非根际土壤(CK2)8株;患病丹参根际土壤(HD1)12株,患病丹参非根际土壤(HD2)9株。菌株编号ZJZG代表正常根际土壤(CK1),ZJZF代表正常非根际土壤(CK2),ZJHG代表患病根际土壤(HD1),ZJHF代表患病非根际土壤(HD2)。从丹参根际土壤分离的可培养细菌高于非根际土壤,说明根系分泌物对土壤细菌有较大的影响。
提取土壤基因组DNA,1 %琼脂糖凝胶电泳分析,条带清晰、整齐,无拖尾现象,说明土壤DNA提取质量较高。以土壤细菌基因组DNA为模板扩增16S rDNA片段,获得1500 bp的特异性片段。酶切图谱进行聚类分析,在50 %的水平上,全部菌株聚在一起;在79 %相似水平处,全部供试菌株被分成分为7个遗传群(图1),其中,ZJHF06,ZJHG09,ZJHF09 和ZJZF04分别单独成群;群Ⅰ由来源于4种土样的27个菌株组成; ZJHF08,ZJHG06,ZJHG07组成群Ⅲ; ZJZG06和ZJZG10组成群Ⅵ。从4种土壤中分离的细菌,既有细菌处于同一个遗传群,也有细菌构成特有的遗传群。
选取12个细菌为代表菌株,其16S rDNA构建的系统发育树形成了5个分支(图2)。分支1为芽孢杆菌属(Bacillus),分支2为短杆菌属(Brevibacterium),分支3为拜叶林克氏菌属(Beijerinckia),分支4为假单胞菌属(Pseudomonas)。可见,中江丹参连作土壤细菌主要类群为芽孢杆菌属细菌(Bacillus)。不同生长状态的丹参土壤,可培养细菌也表现出了差异,其中,短杆菌属和拜叶林克氏菌属出现在患病根际土壤;而假单胞菌属出现在丹参正常生长的根际和非根际土壤。
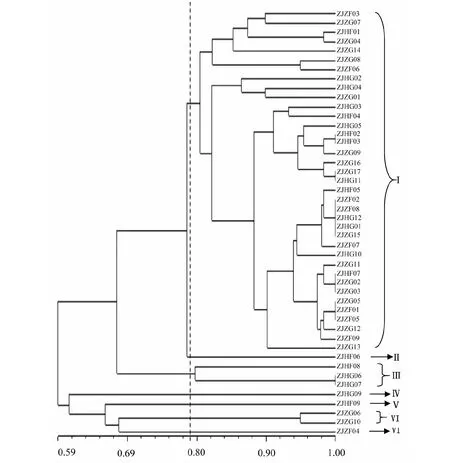
图1 细菌16S rDNA PCR-RFLP UPGMA 树状图Fig.1 UPGMA dendrogram generated from the positive bacteriaof 16S rDNA PCR-RFLP
2.2 免培养细菌多样性
2.2.1 土壤总DNA提取及16S rDNA扩增 土壤总DNA纯化后,经0.8 %的琼脂糖凝胶电泳检测,大于23 kb,条带清晰、整齐,无拖尾现象,质量较好。土壤总DNA经过巢式PCR,第一轮获得大小约1500 bp的16S rDNA片段,阴性对照无扩增条带,第二轮获得约430 bp的片段,与预期一致。
2.2.2 DGGE图谱分析 变性梯度凝胶电泳结果表明,不同样品间DGGE条带强度和迁移位置都有所不同(图3)。患病丹参根际土壤(HD1)与其他土壤的条带差异很大。其中,相比正常生长丹参根际土壤(CK1),条带XB2,XB3,XB4,XB5为患病丹参根际土壤(HD1)所特有,而XA1,XD6,XD7为其它3种土样所特有,这说明患病丹参根际土壤细菌类群发生较大变化。
采用UPGMA对供试土壤DGGE图谱进行聚类(图4),供试样品形成3个分支,CK1和CK2为1个分支,与患病丹参土壤样品HD1和HD2明显分离开。正常生长和患病丹参种植土壤,不同土壤样品的DGGE条带存在差异,说明丹参种植过程中,根际与非根际细菌类群发生了显著变化,尤其是患病丹参的根际和非根际差异极大,表明其细菌类群在连作过程中已经发生较大的变化。

图2 代表菌株的16S rDNA基因系统发育树Fig.2 Phylogenetic tree of 16S rDNA sequences of the representative isolates

图3 土壤细菌PCR-DGGE图谱Fig.3 PCR-DGGE profiles of the soil bacterial community

图4 土壤细菌DGGE条带图谱聚类分析Fig.4 Cluster analysis based on DGGE bands profiles
2.2.3 DGGE条带克隆测序分析 选取7个典型DGGE条带进行克隆测序,绝大多数条带为未培养细菌(Uncultured bacterium),占所有条带的71.43 %;仅有2个条带为可培养菌,条带XB2代表了可培养的植物乳杆菌(Lactobacillusplantarum),条带XB3代表了为可培养的坚强肠球菌(Enterococcusdurans),其相似性达99 %(表1)。

表1 DGGE条带的序列相似性比对
3 讨 论
尽管传统的板分离技术只能获得环境微生物总数的0.1 % ~10.0 %[23],不利于研究环境样品的微生物多样性,但稀释平板法可通过分离、纯化得到纯菌株,鉴定明确分类地位,这对于弄清不同种植方式对丹参土壤细菌群落的影响具有积极意义。本研究分离获得的46个菌株,虽然只分布在芽孢杆菌属(Bacillus)、短杆菌属(Brevibacterium)、拜叶林克氏菌属(Beijerinckia)和假单胞菌属(Pseudomonas),但研究结果较好地揭示出了不同处理间细菌种群差异,且以芽孢杆菌为优势种群,这有助于进一步筛选促进丹参生长的有益菌株。
与此同时,应用PCR-DGGE免培养技术分析了土壤细菌群落,其结果显示,PCR-DGGE结果与纯培养结果完全不同,代表性条带大多为不可培养细菌,仅有2个条带代表了可培养的植物乳杆菌(Lactobacillusplantarum),坚强肠球菌(Enterococcusdurans),而这2个菌株未在纯培养物中出现。相关研究表明,植物在连作过程中,其根系分泌物和残落物亦会对根际微生物群落产生影响[26-27]。PCR-DGGE能较好地反映丹参患病土壤和正常土壤细菌类群的差异,尽管大多数条带都是未鉴定细菌(Uncultured bacterium),这与林贵兵的研究相似[11],也说明丹参连作障碍的发生机理极为复杂。
4 结 论
本研究表明,不同的丹参种植土壤样品间,既有分类地位相同的细菌种类存在,也有各自特有的细菌种群,这为进一步探明丹参连作障碍发生机理,进而控制连作障碍提供微生物学理论依据。
