大黄素预处理对LPS/ATP诱导的人脐静脉内皮细胞焦亡的影响
2019-04-25吴树宁夏中元
吴树宁,王 凯,施 思,夏中元
(武汉大学人民医院麻醉科,武汉 430060;*通讯作者,E-mail:xiazhongyuan2005@aliyun.com)
细胞焦亡是一种炎症反应相关的程序性细胞死亡方式,由含半胱氨酸的天冬氨酸蛋白水解酶(caspase-1)依赖性介导,伴有大量促炎因子的释放,诱发级联放大的炎症反应[1]。在病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和损伤相关分子模式(damage-associated molecular patterns,DAMPs)的作用下激活NLRP3炎性小体。其中,PAMPs(如核酸、脂蛋白、脂多糖)激活TLR4(Toll like receptor 4)信号通路,促进核转录因子κB(NF-κB)激活介导IL-1β和IL-18等前体产生;DAMPs(如尿酸、ATP)促进NLRP3炎性小体蛋白复合物组装,procaspase-1剪切成活化形式,活化的caspase-1将IL-1β和IL-18前体剪切活化释放到胞外,进而引起细胞焦亡,导致细胞损伤[2-4]。
大黄素是存在于大黄和许多其他植物中的天然蒽醌,是中药大黄的主要有效单体,具有抗病毒、抗癌症和免疫抑制作用[5-8]。此外,有多项研究表明,大黄素在抗炎方面也有重要作用[9-11],在主动脉内皮细胞中,大黄素可以通过抑制NF-κB和TNF-α活化,进而抑制炎症反应[12],而在血管平滑肌细胞中,大黄素可以通过ROS-ERK1/2/p38通路抑制C反应蛋白的产生,进而抑制炎症反应[13],目前,大黄素在HUVEC中的研究主要集中在通透性方面[14],细胞焦亡作为一种炎性程序性细胞死亡方式,大黄素是否可以通过减轻内皮细胞焦亡,从而减轻内皮细胞的损伤尚未见研究。本研究拟探讨大黄素对内皮细胞焦亡的影响及其可能的机制。
1 材料与方法
1.1 细胞株及主要试剂
人脐静脉内皮细胞购自于YRGene(NC006),RPMI 1640培养基、胰酶购自于美国Hyclone公司,胎牛血清为美国Sciencell公司产品,LPS、ATP、大黄素(纯度≥98%,批号:E7881)、ROS检测试剂盒为美国Sigma公司产品,CCK-8试剂盒为日本同仁公司产品,LDH检测试剂盒为中国南京建成公司。NLRP3抗体、caspase-1抗体、IL-1β抗体、IL-18抗体为英国Abcam公司产品,羊抗兔荧光二抗为美国Millpore公司产品。
1.2 细胞培养
HUVEC细胞用含10%胎牛血清的1640培养基、37 ℃、5% CO2培养。待细胞密度为90%左右时,去掉培养液,用PBS洗涤细胞3次,吸干培养皿内液体,加0.25%的胰酶将贴壁细胞消化分离,轻轻吹打均匀,使细胞彻底从培养皿底壁脱落,进行传代培养,每隔3-4 d传代一次。取处于对数期、生长状态良好的细胞进行实验。
1.3 细胞活力检测
取HUVEC细胞悬液加入96孔板(每孔约1×104个细胞),加入不同浓度的大黄素溶液(0,20,40,60,80,100 μmol/L),持续培养24 h,换液后,每个孔分别加入10%的CCK-8溶液100 μl,在培养箱中孵育1 h,用酶标仪检测450 nm出的吸光度,计算细胞存活率。另外,取对照组、LPS/ATP组、EMO组细胞悬液,用上述方法分别检测各组细胞活力,细胞活力(% )=[A加药-A空白]/[A未加药-A空白]×100%。
1.4 分组
将HUVEC随机分为三组:正常对照组(C组),正常条件下培养细胞;LPS/ATP组,用1 μg/ml脂多糖(LPS)刺激细胞24 h,再用5.5 mmol/L三磷酸腺苷(ATP)刺激细胞4 h;EMO组,先用大黄素60 μmol/L预处理细胞24 h,然后用1 μg/ml脂多糖(LPS)刺激细胞24 h,再用5.5 mmol/L三磷酸腺苷(ATP)刺激细胞4 h。
1.5 乳酸脱氢酶检测
取各组经过处理的细胞上清液,按照检测试剂盒说明书操作步骤,用酶标仪在450 nm处检测各组样本的吸光度,计算各组乳酸脱氢酶的活性。
1.6 活性氧检测
将消化后的细胞悬液加入6孔板(每孔约1×105个细胞),按照上述分组方法给药。按照ROS检测试剂盒说明书操作步骤,收集细胞后,加入DCFH-DA(1 mmol/L)工作液,在37 ℃,5% CO2的环境中避光温育30 min,检测各组细胞的ROS水平。
1.7 Western blot法检测蛋白表达
取各组培养的细胞,去除培养基后,经PBS洗两次后加入裂解液裂解细胞,收集蛋白。采用BCA法测定蛋白浓度,取20 μg上样,经SDS-PAGE电泳、转膜。用5%脱脂牛奶封闭1 h。分别用抗体NLRP3(1 ∶500)、caspase-1(1 ∶500)、IL-1β(1 ∶1 000)、IL-18(1 ∶1 000)进行4 ℃孵育过夜。用TBST洗膜3次,每次10 min,加入对应荧光二抗(1 ∶10 000),室温孵育1 h。洗膜3次,每次10 min,使用Odyssey双色红外激光扫描显影仪(Li-Cor公司,美国)扫描荧光蛋白条带,用Odyssey系统软件进行结果分析,通过目的蛋白条带灰度值与内参β-actin条带灰度值的比值表示目的蛋白的表达水平。
1.8 统计学分析
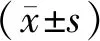
2 结果
2.1 细胞活性
当大黄素浓度在0-60 μmol/L之间时,细胞活力逐渐增加,差异具有统计学意义(P<0.05),当大黄素浓度超过80 μmol/L时,细胞活力明显下降,差异具有统计学意义(P<0.05,见图1A),故选用大黄素60 μmol/L进行后续实验。如图1B所示,与对照组相比较,经过LPS/ATP处理后,细胞活力明显下降,差异具有统计学意义(P<0.05),与LPS/ATP组相比较,加入大黄素后细胞活力有所增加,差异具有统计学意义(P<0.05)。
2.2 ROS水平、LDH活性
与对照组相比,经过LPS/ATP处理后细胞内ROS水平、LDH活性明显升高,差异具有统计学意义(P<0.05);与LPS/ATP组相比较,经过EMO处理后的细胞内ROS水平、LDH活性下降,差异具有统计学意义(P<0.05,见图2)。

与0 μmol/L相比较,#P<0.05;与60 μmol/L相比较,*P<0.05 与对照组相比,*P<0.05;与LPS/ATP组相比,#P<0.05图1 不同处理条件对细胞活力的影响Figure 1 The effects of different treatment conditions on cell viability
与对照组相比,*P<0.05;与LPS/ATP组相比,#P<0.05图2 大黄素对LPS/ATP处理后细胞上清ROS、LDH水平的影响Figure 2 The effect of emodin on the levels of ROS and LDH in supernatant of cells after treated with LPS/ATP
2.3 NLRP3、caspase-1、IL-1β、IL-18蛋白表达水平的变化
与对照组相比,经过LPS/ATP处理后,细胞内NLRP3、caspase-1、IL-1β、IL-18蛋白表达水平升高,差异具有统计学意义(P<0.05);与LPS/ATP培养细胞相比较,经过EMO处理后的细胞内NLRP3、caspase-1、IL-1β、IL-18蛋白表达水平明显下降,差异具有统计学意义(P<0.05,见图3)。
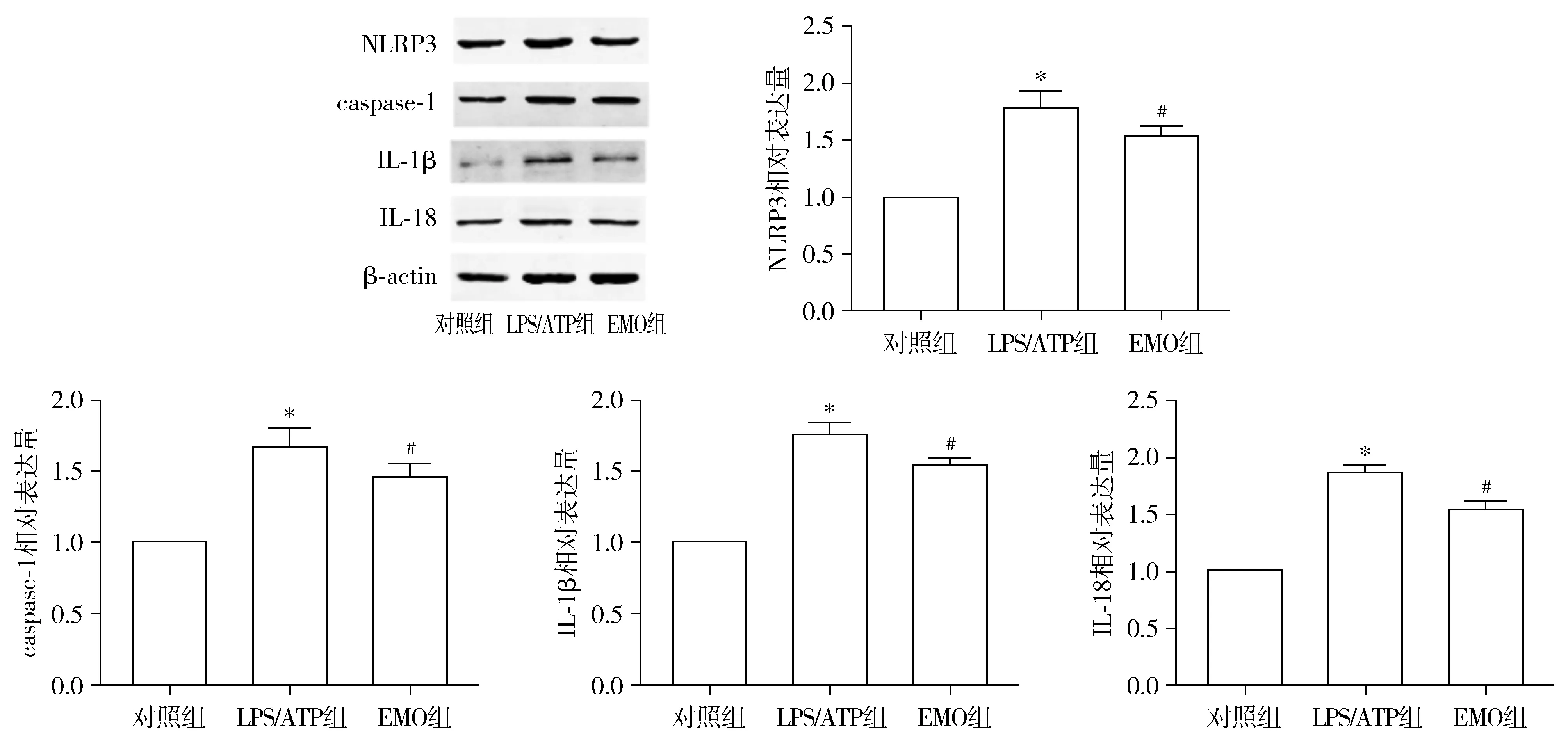
与对照组相比,*P<0.05;与LPS/ATP组相比,#P<0.05图3 大黄素对LPS/ATP处理后细胞内NLRP3、caspase-1、IL-1β、IL-18蛋白的影响Figure 3 The effects of emodin on NLRP3, caspase-1, IL-1β and IL-18 proteins after LPS/ATP treatment
3 讨论
本研究通过向细胞培养液中预先加入大黄素溶液来减轻LPS/ATP共同作用诱导的细胞焦亡,从而达到对细胞的保护作用。NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白ASC和caspase-1组成[15],脂多糖(LPS)通过作用于细胞膜表面的CD14/TLR4受体来激活细胞,促进NLRP3炎性小体形成[16],从而使细胞发生炎症反应[17];此外ATP作用于P2X7受体也可以诱发NLRP3炎症小体的形成。在诱导焦亡的过程中,单独给予LPS和ATP并不能引起caspase-1和IL-1β的显著升高,而经过LPS刺激细胞后再给予ATP,会使caspase-1和IL-1β显著升高[18]。因为NLRP3的激活需要两种信号的参与,第一种信号是TLR4/LPS,可以促进proIL-1β的形成;第二种信号为ATP等物质的刺激[19]。LPS只能促进procaspase-1和proIL-1β形成,当给予ATP刺激后,会使NLRP3炎症小体活化,进而依次活化caspase-1、IL-1β、IL-18,引起细胞焦亡。当细胞内ROS的含量增加时,会促进NLRP3炎性小体活化,随后大量激活caspase-1、IL-1β、IL-18,引起细胞焦亡,导致细胞损伤加重,LDH水平增加[20,21]。
大黄素为蒽醌衍生物,对机体具有多重保护作用,研究发现,ATP通过作用于P2X7受体,使离子通道通道打开,允许阳离子(Na+、Ca2+等)通过,使胞质中Ca2+浓度升高,进而引起细胞损伤[22]。大黄素可以作用于P2X7受体抑制ATP的作用,使胞质中Ca2+浓度降低、减少IL-1β的释放以及ROS的产生,减轻细胞损伤[23]。此外有研究表明,大黄素还可以通过多种途径抑制LPS的作用从而减轻细胞损伤[24,25]。在LPS参与的炎症反应中,LPS激活TLR4信号通路被认为是最重要的部分[26],TLR4活化后可以激活MyD88和TRIF,进而引起炎症反应[27,28],进而通过髓系分化因子88[29]或TRIF相关的衔接分子[30]活化NF-κB,TLR4/MyD88/NF-κB通过活化NLRP3炎性小体,导致细胞焦亡的发生[31]。此外,研究发现,TLR信号通路和氧化应激可以相互作用,ROS可以促进TLR4的表达[32],而TLR4还可以通过MyD88促进ROS产生[33,34],继而促进NLRP3炎性小体活化,导致焦亡的发生发展[35]。大黄素可以通过抑制TLR4/NF-κB或者促进Nrf2来抑制ROS产生,进而抑制炎症反应发生[11,36],减轻细胞焦亡。
本研究结果表明,与对照组相比,经过LPS/ATP处理后,细胞的ROS产生增加,同时生成pro-caspase-1和pro-IL-1β,ROS刺激NLRP3炎性小体,促进pro-caspase-1成熟为caspase-1,活化的caspase-1促进pro-IL-1β成熟,引起细胞焦亡。当向细胞培养液中加入大黄素后,能够抑制ROS产生,减少NLRP3炎性小体活化,减少caspase-1、IL-1β、IL-18和LDH产生,减少细胞焦亡,减少细胞损伤。
综上所述,本研究结果证实,大黄素可以通过抑制细胞ROS的产生,进而抑制NLRP3炎性小体和caspase-1通路活化,减少焦亡发生。大黄素的保护作用可能不仅与抑制ROS的释放有关,而且可能通过多条信号通路发挥作用。本研究结果提示,大黄素对血管内皮细胞有保护作用,通过这种保护作用可以减少细胞损伤,从而发挥其对心血管疾病的防治作用。
