茯苓菌固态发酵小麦基质的成分变化
2019-04-24李佳欢金文松张燎原胡开辉
李佳欢 , 林 辉 , 金文松 , 张燎原 , 胡开辉 *
(1.福建农林大学 生命科学学院,福建 福州 350002;2.福建农林大学(古田)菌业研究院,福建 宁德352200)
茯苓(Poria cocos(Schw.)Wolf)作为一种药用真菌,目前已报道的生物活性物质包括多糖类、甾体类、蛋白质、四环三萜类、三环二萜类等[1-3]。现代药学研究证实,茯苓具有抗肿瘤、抗氧化、增强免疫功能等多种生物活性[4-6]。现阶段,人们对茯苓的利用不仅局限于子实体,还可以通过其菌丝体进行液态或固态发酵,提取其发酵产物。
谷物因具有丰富的营养成分,如淀粉、蛋白质、植物脂肪、微量元素等,可供给微生物生长所需的营养成分,是很好的发酵基质。营养学分析表明,谷物在经发酵后,其营养成分将会更加丰富。文献[7]的研究表明,经自然发酵后的豇豆等豆科植物,其赖氨酸、苏氨酸等必需氨基酸质量分数明显提升。文献[8]的研究中指出,燕麦、大豆2种混合谷物经灰树花孔菌进行固态发酵后,其总三萜、总多酚等抗氧化活性成分均有所提升,清除自由基能力显著增强。文献[9]对桑黄发酵的薏米、稻米展开研究,发现两种谷物经发酵后,其抗氧化能力明显增强。
在微生物的作用下,谷物的营养组成发生了变化,同时发酵中产生的代谢产物,一定程度上提升了谷物的附加值。但在已有的研究中鲜见以茯苓菌为菌种对谷物进行发酵的报道,更未有研究对发酵过程中的酶活及各有效物质的变化展开研究。本研究采用无毒保健的茯苓菌对小麦进行发酵,初步分析了发酵过程中茯苓菌关键酶活性质的变化,并探讨了酶活变化与产物营养成分变化之间的关系,以期为茯苓发酵口服液、饮料等功能性产品的开发提供借鉴。
1 材料与方法
1.1 原料与试剂
小麦购自福州农贸市场;茯苓菌种由福建农林大学微生物工程实验室提供;葡萄糖购自Sigma试剂公司;其他试剂皆为分析纯试剂。
1.2 仪器与设备
Agilent1100高效液相色谱仪,美国 Agilent公司产品;BS110S型电子天平,赛多利斯科学仪器(北京)有限公司产品;LDZX-50KBS型立式压力蒸汽灭菌锅,上海申安医疗器械厂制造;DHG-9203型鼓风干燥机,上海精宏公司产品;LRH-250型恒温培养箱,宁波江南仪器厂制造;UV1100型紫外分光光度计,上海美谱达仪器有限公司产品;5804R型高速冷冻离心机,德国Eppendorf公司产品;PB10型pH计,德国赛多利斯集团产品。
1.3 实验方法
1.3.1 培养基 PDA加富固体培养基:土豆(去皮)200 g、葡萄糖 20 g、蛋白胨3 g、酵母提取粉 3 g、硫酸镁 1.5 g、磷酸二氢钾 1.5 g、维生素 B10.1 g、琼脂 20 g,加水定容至1 000 mL,pH自然,115℃灭菌30 min。
小麦固体培养基:去除小麦中杂质与空心小麦颗粒,用蒸馏水冲洗2~3次,去除灰尘、麦麸等杂质,加蒸馏水至刚好浸没小麦,于40℃水浴2 h,将小麦捞出,按料液比1∶1.2加入蒸馏水煮至小麦饱满全熟无白心,注意小麦不能裂开,以避免营养散失。将煮好的小麦粒分装于栽培瓶中,每瓶110 g,压平,封口膜封口后121℃灭菌120 min。
1.3.2 发酵与样品收集 将灭菌后的小麦固体培养基冷却至室温,取活化好的茯苓菌种按5 mL/hg的接种量接至小麦栽培料,置于26℃恒温培养箱中培养。接种后每隔5 d取1次样,将所得样品混匀后置于60℃鼓风干燥机中干燥48 h。将干燥后的发酵小麦经中草药粉碎机粉碎后,过60目筛,于干燥封闭环境下保存以供后续营养成分测定实验。未接种的小麦经过上述处理后作为对照,所有实验设定3组平行。
1.3.3 提取液的制备 将发酵小麦取出搅拌均匀后,称取10 g于研钵中,研磨后移至100 mL三角瓶中,加入50 mL双蒸水,于150 r/min,25℃恒温振荡摇床培养90 min,经纱布过滤后,8 000 r/min离心15 min,取上清液即为提取液,用于相关酶活、草酸和pH值的测定。
1.4 测定方法
1.4.1 酶活力的测定方法 淀粉酶活力测定在文献[10]的方法上进行改良,采用淀粉-碘化钾显色法。定义60℃、pH 6.0条件下,1 min液化1 μg可溶性淀粉所需酶量为1个酶活力单位“U”。
木聚糖酶活力测定方法在文献[11]等方法上进行改良,采用3,5-二硝基水杨酸(DNS)法。定义50℃、pH=5.2条件下,1 min生成 1 μg D-木糖所需酶量为1个酶活力单位“U”。
羧甲基纤维素酶的测定方法在文献[12]的方法上进行改良,采用3,5-二硝基水杨酸(DNS)法。定义50 ℃、pH 4.6的条件下,1 min生成 1 μg葡萄糖(GLU)所需酶量为1个酶活力单位“U”。
1.4.2 茯苓菌发酵小麦营养成分变化
1)pH值测定:用pH计对样品粗酶提取液进行测定。
2)草酸测定方法:本研究采用HPLC法来测定小麦中草酸的质量分数。取粗酶液0.4 mL,加入0.2 mL酸性乙醇,在振荡器上混合1 min,8 000 r/min离心10 min,上清液经0.22 μm滤膜过滤。色谱分离柱:SB-Aq C18柱;流动相:0.025 mol/L磷酸二氢钾和四丁基氢氧化铵溶液(磷酸调pH2.0);紫外检测波长:220 nm;进样量 2 μL;流动相速度:流速 0.6 mL/min;柱温30℃。以草酸标品质量浓度(mg/mL)为X轴与峰面积的值(Y轴)绘制标准曲线。所得标曲的线性回归方程为Y=3 039.1X+5.096,R2=0.997 7。
3)总糖测定:参考文献[13]的方法测定小麦当中的总糖质量分数,采用葡萄糖溶液进行标准曲线的测定,根据葡萄糖质量(X轴)与OD值(Y轴)绘制标准曲线。所得标准曲线的线性回归方程为:

4)还原糖质量分数测定:参考文献[14-15]的方法测定小麦当中的还原糖质量分数,采用DNS法进行还原糖测定。以葡萄糖溶液进行标准曲线的测定,根据葡萄糖质量(X轴)与OD值(Y轴)绘制标准曲线。所得标准曲线的线性回归方程为:
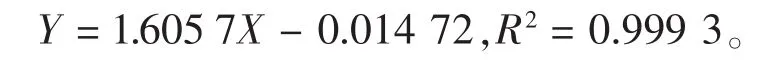
5)多糖测定:参考文献[16]的方法提取小麦粉中多糖,用苯酚硫酸法测定其吸光值,将结果代入葡萄糖标准曲线计算其多糖质量分数。
6)总三萜质量分数测定:参考文献[17]的方法对小麦中的总三萜,采用香草醛-冰醋酸测定样品中三萜质量分数。以熊果酸作为标品进行标准曲线的测定,根据熊果酸质量(X轴)与OD值(Y轴)绘制标准曲线,所得标准曲线的线性回归方程为:
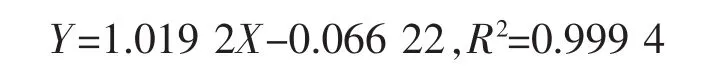
7)水溶性三萜酸测定:取10 g栽培料至三角瓶,加入50 mL的双蒸水,60℃水浴2 h,每隔半小时摇晃混匀,8 000 r/min离心15 min,取上清液2 mL于烘干箱60℃烘干,烘干后用1 mL双蒸水溶解,添加 1 mL乙酸乙酯(质量分数99.5%)进行萃取2遍;合并上层液烘干后使用香草醛-冰醋酸测定样品中三萜酸质量分数。
1.5 数据处理
实验数据用SPSS 20.0软件进行统计学分析,用EXCEL软件进行绘图。
2 结果与分析
2.1 茯苓发酵小麦过程中菌丝生长变化情况
图1表示的是不同培养时间下,茯苓菌在小麦培养基上的长势情况,可以看出茯苓菌丝呈白色,菌丝较为纤细,生长速度快,培养6 d即可满瓶。随着培养时间的延长,菌丝密度逐渐升高且呈白色,充斥麦粒之间的间隙,培养至30 d后菌丝密度不再发生明显变化。

图1 茯苓栽培过程的生长情况Fig.1 Growth of the P.cocos
2.2 茯苓固态发酵过程中酶活力变化情况
茯苓栽培过程中纤维素酶、木聚糖酶和淀粉酶的活力变化如图2所示。
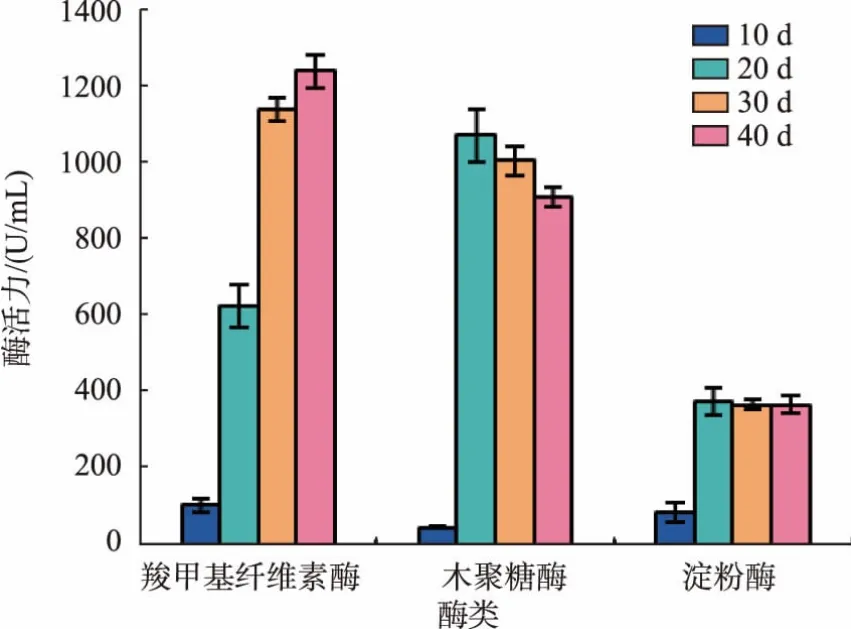
图2 茯苓固态发酵过程纤维素酶、木聚糖酶和淀粉酶活力Fig.2 Activity variation of cellulose,xylanase and amylase produced by P.cocos during the process of solid-state fermentation
小麦基质中含有大量的淀粉、纤维素、木聚糖等,这些物质可以在相关酶的作用下,分解成单糖以供食用菌的生长所需。通过分析发酵过程中相关酶活力的变化,观察茯苓菌的生长情况及其对小麦培养基中营养成分的利用情况。
淀粉为小麦中主要贮藏物质,质量分数约为53%~70%。在茯苓菌发酵小麦的过程中,淀粉酶的活力对菌丝生长起着重要作用。由图2可知,随着发酵时间的增加,淀粉酶活力不断增强,在20 d时活力达最大值247.1 U/mL,随后基本维持在240 U/mL左右,持续降解淀粉以供茯苓菌丝生长所需。其可能原因为小麦中的淀粉质量分数一直较高,故淀粉酶作为茯苓菌分泌的一种诱导酶,其活力将保持着相对稳定的状态。
纤维素是麦麸中的主要成分之一,其质量分数约占其干物质的35%~40%[18]。茯苓菌若要利用小麦胚乳中的营养成分,首先要具有降解麸皮中纤维素的能力,因此茯苓菌纤维素酶是茯苓菌能否在小麦基质中生长的关键酶之一。从图2可以看出,酶的活力在培养10 d时为100 U/mL,随茯苓菌发酵时间的延长,纤维素酶活力以每隔10 d 500 U/mL的速度提升,培养30 d时纤维素酶活达1 150 U/mL,后酶活提升趋势减缓,40 d时其活力为1 250 U/mL左右。说明茯苓菌可以很好的降解小麦胚乳中的纤维素,以供菌丝生长和代谢所需。
小麦中可溶性多糖(非淀粉)的质量分数可达6%以上,而其主要成分为阿拉伯木聚糖,是机体无法消化利用的成分之一,因此将降低其能量的利用效率[19],而茯苓菌分泌的木聚糖酶可降解小麦中的木聚糖。由图2可知,木聚糖酶活力在10~20 d时显著提高,由54 U/mL提升至1 080 U/mL,之后随着培养时间的延长,木聚糖酶活力逐渐降低,在40 d时酶活力为920 U/mL。
2.3 发酵产物总糖、还原糖及多糖的变化
由图3可知,小麦发酵前总糖质量分数高达80%以上,但经茯苓菌发酵后,小麦中的总糖质量分数逐渐降低。培养前10 d总糖降低速度较慢,但10~20 d期间,总糖被迅速消耗,20 d时栽培料中的总糖质量分数仅剩57.2%,随后总糖下降速率减缓。通过相关性分析发现,总糖的变化与纤维素酶、木聚糖酶及淀粉酶的变化趋势呈现显著的负相关性(r值分别为-0.961、-0.925和-0.958), 结合发酵过程中的酶活力变化可知,培养前10 d,由于茯苓菌菌丝酶活力较弱,对营养的利用率较低,总糖降低速率较低。发酵10~20 d期间,茯苓菌的代谢较旺盛,生长速度加快,淀粉酶、羧甲基纤维素酶及木聚糖酶的活力在该阶段的活力大幅提升(P<0.01)。在3种酶的作用下,小麦中的淀粉、纤维素及木聚糖被大量消耗,总糖质量分数下降速度加快,第20天时产物中的总糖质量分数下降了43.6%。

图3 茯苓固态发酵过程总糖、还原糖、多糖质量分数变化Fig.3 Changesoftotalsugar、reducing sugar and polysaccharidecontents during the solid-state fermentation of P.cocos
茯苓菌在发酵小麦的过程中,不能直接利用基质中的淀粉、纤维素等物质,而需要通过相应酶系的作用,将其降解为还原糖后再进行利用,所以还原糖质量分数的变化可以在一定程度上反映真菌对碳水化合物的有效利用率[20]。未发酵小麦的还原糖质量分数仅为0.389%,发酵过程中小麦还原糖质量分数呈整体上升趋势,发酵35 d时的还原糖质量分数高达27.40%,为未发酵小麦的70倍。通过相关性分析发现,总糖的变化与纤维素酶、木聚糖酶及淀粉酶的变化趋势呈现正相关性 (r值分别为0.986、0.734 和 0.804)。 发酵 0~35 d 期间,发酵产物中的还原糖质量分数不断上升,可能是由于在发酵过程中产生的淀粉酶、纤维素酶、木聚糖酶等多酶体系的作用下,碳水化合物转化为还原糖以供菌丝生长利用,而在35 d之后,还原糖质量分数明显下降,提示茯苓菌菌丝对淀粉、纤维素等碳水化合物的利用率降低。
茯苓发酵小麦多糖的质量分数在培养0~20 d内大幅上升,由8.72%上升至26.83%。多糖质量分数在培养20 d后开始下降,至40 d时下降为14.96%。可能是因为发酵前期,在相关酶系的作用下,小麦基质中的碳水化合物被降解为单糖、还原糖和多糖,茯苓菌首先利用单糖和还原糖,多糖积累下来,其质量分数逐渐提升。随着茯苓菌代谢逐渐旺盛,其他糖类不能供给茯苓菌丝的正常生长,茯苓菌开始降解小麦基质中的多糖供能。多糖的变化情况其与淀粉酶之间存在着一定的正相关性(r=-0.468)。
2.4 发酵产物pH值及草酸的变化情况
由图4可知,茯苓菌发酵小麦的pH值随培养时间增加而呈下降趋势,后期趋于平缓。发酵前期,茯苓菌生长进入对数期,由于其生长速度快,在利用小麦淀粉为碳源生长时,产生了大量草酸、月桂酸、茯苓酸等有机酸,pH显著下降,在15 d左右pH值降至3.70左右后逐渐趋于平稳,进入稳定期,此时茯苓菌生物量基本保持稳定,有利于产物的合成。而随着培养时间的延长,草酸质量分数有所提高,但在培养的25 d内草酸质量分数变化不大,质量分数维持在1.2 g/kg左右,而培养25 d以后,产物中的草酸质量分数迅速提高。

图4 茯苓固态发酵过程pH值及草酸质量分数变化Fig.4 Changes of pH and oxalic acid during the process of solid-state fermentation of P.cocos
2.5 发酵产物三萜质量分数的变化
三萜是萜类物质中的一种,是真菌和植物在生长过程中产生的一种次级代谢产物。具有抗肿瘤、免疫调节、醛固酮拮抗等功效,是一种极具潜力的功能性物质[21]。然而仅通过日常饮食摄入,无法满足人体对三萜的需求。因此,通过食用菌对谷物发酵,既改良了谷物原本的营养结构,同时可制成富含三萜类物质的功能性食品。由图5可知,发酵过程中总三萜与水溶性三萜酸变化趋势相同,随着培养时间的延长,总三萜与水溶性三萜酸质量分数逐渐提高,在培养至25 d时达到最高值,分别为1.6 g/kg与0.13 g/kg,但随着培养时间的继续延长,两者的质量分数略有降低。研究指出,茯苓子实体、菌丝体三萜类化合物种类并无差异,只是其质量分数有所不同。本研究得到的茯苓发酵小麦,采用全麦小麦培养基,通过茯苓菌进行发酵,其菌丝的生长极大地提升了小麦中的三萜物质质量分数,因此,可以以茯苓发酵后小麦为原料,开发富含三萜类物质的功能性食品。
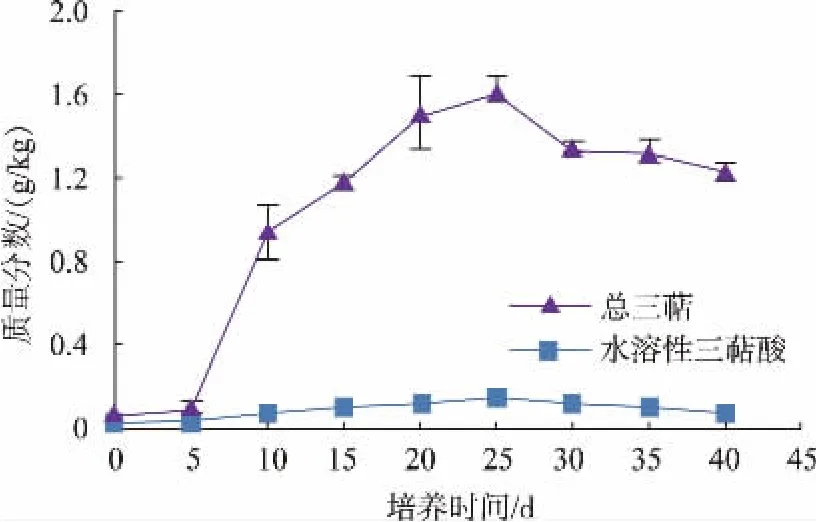
图5 茯苓固态发酵过程三萜质量分数变化Fig.5 Changes oftriterpenes contents during the process of the solid-state fermentation of P.cocos
2.6 讨论
茯苓菌作为一种木腐菌,在生长过程中可以分泌多种酶,将大分子营养物质降解为可供其利用的小分子物质。研究菌丝生长过程中的关键酶的活性,可以反映出菌丝的生长发育情况及其对基质的生物转化率[22]。本文对茯苓菌发酵小麦的过程中的酶活分析结果表明,纤维素酶活力随培养时间延长不断上升,40 d时达1 280.5 U/mL,这与文献[23]在研究茯苓菌发酵木屑培养基中纤维素酶的变化趋势不同,其原因可能是所采用的发酵基质不同;文献[24]对杏鲍菇固态发酵过程中木聚糖酶的变化情况的研究与本研究所得结果一致,在茯苓菌发酵小麦的过程中,木聚糖酶活力在20 d时达最大值,为1 073.2 U/mL,随后略有下降,可能原因是发酵后期,小麦中木聚糖质量分数下降,导致其酶活力逐渐降低;淀粉酶活力在发酵20 d时达最高值,约为494.2 U/mL,随后基本保持稳定,这一结果与文献[25]对银耳与香灰菌混合培养过程中的变化趋势一致。由于小麦胚乳中含有大量淀粉,淀粉酶可能作为一种诱导酶存在,在淀粉量维持稳定时,其酶活性变化不大。
3 结 语
茯苓菌固态发酵的过程中,发酵产物中的总糖、还原糖、多糖、三萜类物质等质量分数都有明显变化。与未经发酵的小麦相比,茯苓菌发酵小麦中的总糖质量分数明显下降,减少了53%;还原糖质量分数显著上升,由发酵初期的0.389%上升至27.40%;多糖质量分数由8.72%上升至14.96%,发酵过程中最高可达26.83%;总三萜与水溶性三萜的质量分数逐渐提高,在培养至第25天时达到最高值,分别高达1.6 g/kg与0.13 g/kg。
通过对茯苓菌发酵小麦过程中茯苓菌酶活变化和基质中营养成份变化的分析,可以看出茯苓菌在发酵的过程中,通过纤维素酶、木聚糖酶及淀粉酶等酶系的共同作用可将大分子物质降解,改善小麦原有的营养结构。由于固态发酵方式工艺简单、原料成本低,又因小麦本身的可食性,在进行后期加工时不需采取将菌丝分离的步骤,极大地简化了加工流程。综上所述,可将固态发酵技术与传统谷物加工结合,开发具有高营养价值的谷物产品,既能促进传统谷物的应用,又提升了其营养价值,其市场价值可期。
