酿酒酵母萌发突变株的筛选
2019-04-24邱盼盼高晓冬中西秀树
邱盼盼, 高晓冬, 中西秀树
(江南大学 生物工程学院,江苏 无锡 214122)
酵母细胞在缺乏氮源且遇到非发酵性碳源的情况下,酵母细胞就会进入减数分裂进行孢子生殖,将单倍体的染色体分到4个不同的子细胞中,形成孢子[1]。而孢子在遇到营养物质如葡萄糖时,开始萌发、发生形变,出芽长成正常的营养细胞[2-3]。孢子萌发是孢子经过休眠,非分裂性孢子的生长和进入有丝分裂的过程,而控制细胞进入有丝分裂的系统是个有序的选择性系统,只有在遇到适合的情况才会退出休眠期进入有丝分裂[4],该选择性系统涉及一系列蛋白质,影响到转录、蛋白质的磷酸化、催化子和抑制子的稳定性[5]。关于萌发机制则至今还未被详细解析,因此本实验对萌发机制的研究有理论意义。
孢子外层壁结构由里到外依次是甘露糖蛋白(mannoprotein),β-葡 聚糖 (β-glucan), 壳 聚糖(chitosan),以及二酪氨酸(dityrosine)层[6-7],而孢子最外层的二酪氨酸层对其乙醚抗性具有重要作用[8-9],而正常的营养细胞对乙醚缺乏抗性,本研究利用这一特性筛选萌发缺陷型突变株。
本研究室首次利用孢子作为微胶囊[10],建立2种新型固定化酶方法。其中一个方法是以孢子为载体[11],利用二酪氨酸的阻挡作用,将酵母中分泌型的酶固定在孢子壁上,其特点是固定化酶的稳定性高,能抵抗较高的温度和培养环境水解酶的降解作用。另一种方法是将外层二酪氨酸层去除,使壳聚糖层暴露在孢子最外层形成壳聚糖球。利用壳聚糖层上的氨基,结合有效的化学方法将需要固定的外源酶共价交联在壳聚糖层上,具有重复利用率高,热稳定性好等特点。该壳聚糖球还具有吸附性强的特点,可去除废水中的金属离子和带负电荷的离子,达到净化环境的目的。但是上述2种方法的不足之处在于孢子遇到营养物质即开始萌发,不利于酶的固定化,为保证其重复利用性,本研究对酿酒酵母进行化学诱变,经筛选获得若干株具有萌发缺陷的突变株。
1 材料与方法
1.1 材料
1.1.1 菌株 出发菌株酿酒酵母(Saccharomyces cerevisiae)AN120由本实验室保藏和提供。
1.1.2 培养基 YPAD培养基(g/dL):2葡萄糖,2蛋白胨,1酵母提取物,0.003腺嘌呤,(固体培养基加2琼脂);预产孢液体培养基(YPACe):2蛋白胨,1酵母提取物,2醋酸钾;产孢培养基(KOAC):2醋酸钾,(固体培养基加2琼脂);萌发液体培养基YPA(g/dL):2蛋白胨,1酵母提取物,0.003腺嘌呤;选择性培养基(SD)(g/dL):0.67不含氨基酸的酵母氮源,2琼脂,2葡萄糖,2不含特定氨基酸的氨基酸混合物;大肠杆菌培养基(LB)(g/dL):0.5 酵母提取物,1胰蛋白胨,1氯化钠,2琼脂。
1.1.3 化学突变试剂和缓冲液 本实验采用甲基磺酸乙酯(EMS)[12]对酵母细胞进行突变,再使用5 g/dL灭菌的硫代硫酸钠(Sigma)解除突变后的药物毒性,缓冲液使用灭菌的0.1 mol/L磷酸钠缓冲液,pH7.0。
1.1.4 仪器与设备 (Pipet Lite XLS)移液枪、(CF16RXⅡ)台式高速冷冻离心机,购于德国Eppendorf;(BA210)光学显微镜,购于美国 GE 公司;(CV334)超声破碎仪,购于南京新辰生物科技公司。
1.2 方法
1.2.1 突变以及用乙醚筛选突变株 突变参照Fred Winston[12]的方法进行诱变,每 3.0×108个细胞使用150 μL的突变化学试剂EMS在30℃震荡处理1 h,然后加入100 mL 5 g/dL sodium thiosfate进行解毒处理。
乙醚筛选:产孢后,将孢子悬浮在液体YPAD培养基中于37℃摇床内萌发14 h,滴加乙醚使其终体积分数13%,在30℃摇床中处理45 min,稀释1 000倍后涂布在50个固体YPAD培养基上置于25℃恒温箱内4 d以进行后续实验。
1.2.2 子囊孢子的制备以及萌发步骤 在YPAD培养基中过夜培养细胞,上述液体预产孢培养基YPACe培养24 h后,在产孢培养基KOAC中培养1~2 d,收集孢子,加入2 g/dL lyticase,置于30℃摇床中2~3 h,收集孢子,用去离子水洗涤2次,溶于5 mL体积分数0.5%TritonX-100,使用超声破碎仪进行破壁处理5 min,用去离子水洗涤2次。在光学显微镜下可见97%以上的细胞均为单个的孢子。萌发的步骤如下:将孢子置于YPA液体培养基于30℃下30 min,再加入葡萄糖至总质量浓度为2 g/dL。萌发率的计算则由每100个细胞计已萌发孢子数,测3次取平均值。
1.2.3 四分体孢子的分离 将新鲜的孢子,置于100μL的去离子水中,加0.5μL的lyticase置于30℃下15 min,将YPAD平板在边缘处划线,取10 μL的处理液置于一个线内的YPAD上,在操作台内吹干处理液,将切孢的针用乙醇处理10 min,在显微镜下利用针尖将四分体的孢子分离开来置于该YPAD平板上。由于没有添加裂解酶的四分体子囊孢子不能通过针尖取到,因此后续部分实验处理子囊孢子时先将其分开再放置在一起。
2 结果与讨论
2.1 突变方法的确立
突变流程见图1,首先对细胞进行化学试剂突变处理,在细胞量回补后,经过正常的产孢,在高温下37℃下萌发,使得没有高温萌发缺陷的孢子萌发成正常的营养细胞,而有缺陷的孢子依然保持孢子的结构,经过一定浓度的乙醚处理,将萌发后的营养细胞杀死,而保留对乙醚有抗性的孢子,然后置于25℃下,缺陷孢子开始萌发即得到萌发缺陷初选菌株。本实验由于完全不能萌发的突变株不能被筛选到,因此本实验假设突变株在高温下不能萌发而在低温下能萌发。其中测试乙醚筛选条件时,经过一系列不同浓度乙醚测试,发现处理以13%终体积分数的乙醚在30℃下45 min能杀死所有的萌发细胞,而保留一定数量的孢子存活。本实验获取3×108个酵母细胞,经过EMS诱变后,致死率约为50%~70%,最后经过乙醚筛选得到300株左右菌株。实验通过对突变条件的测试,确立了通过化学试剂对酿酒酵母进行突变,结合利用乙醚筛选突变株的方法,成功获得了具有萌发缺陷的突变株。
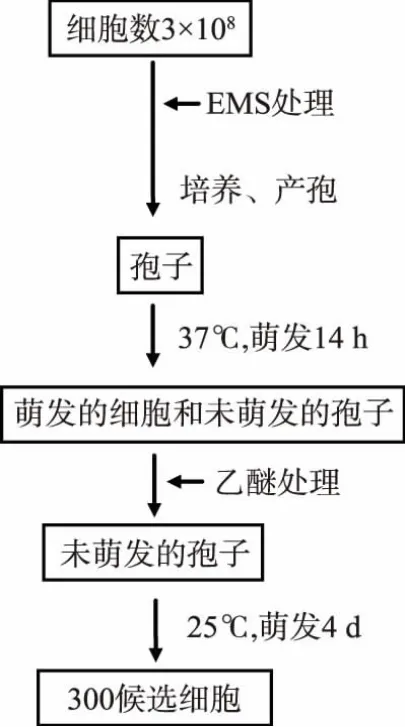
图1 突变流程Fig.1 Mutation procedure
筛选最终得到约300株初选菌株,为排除生长缺陷菌株,将此300株菌株置于37℃下培养,其中103株可以生长。而为方便研究萌发的缺陷,本文主要针对能产孢的菌株以方便后续的研究,故此排除产孢有缺陷或者单倍体菌株,最后得到32株菌株能产孢的双倍体菌株。为进一步确认这32株菌株的确有萌发缺陷,对这些菌株再进行萌发处理,发现有明显萌发缺陷的只有4株,分别命名为AN120-m5、AN120-m8、AN120-m10、AN120-m17。
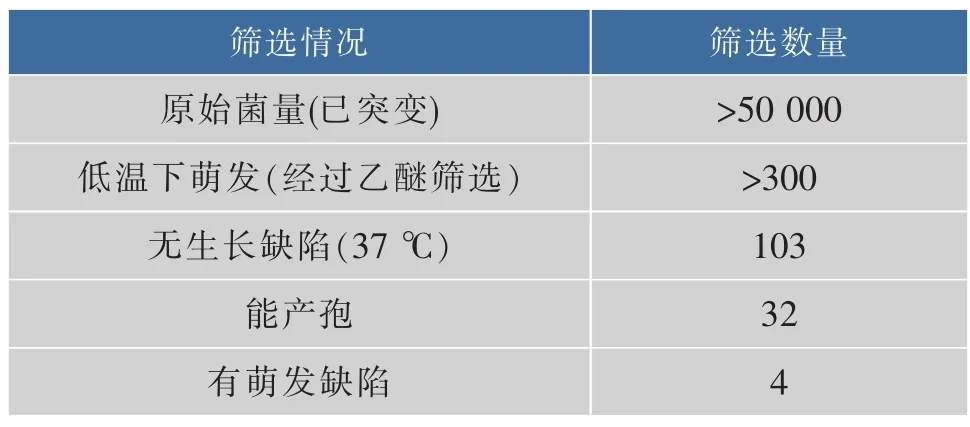
表1 筛选量Table 1 Screening volume
2.2 突变株验证
上述实验已证明,4株突变株均可以正常产孢,为进一步确认这4株突变株是在萌发过程中有缺陷,并非生长缺陷突变株,对固体培养基亦做了生长缺陷测试。将野生型和突变株在37℃下培养,由图 2 可看出 AN120-m8,AN120-m10,AN120-m17相对于野生型来说没有明显的生长缺陷,而AN120-m5则表示为轻微生长劣势,但是能够在37℃下生长。实验表明,4株突变株都能在37℃下生长。
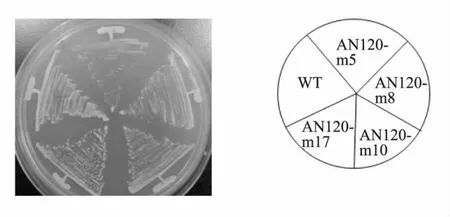
图2 突变株37℃生长状况Fig.2 Growth of mutants on YPAD plate in 37℃
为确认突变株在萌发过程中有缺陷,测试突变株在液体培养基内的缺陷进行验证。如图3(a)所示,经过8 h后,野生型孢子在37℃和25℃下均能正常萌发,而该4株突变株在25℃下和37℃下都有明显的萌发缺陷,而尤其特殊的是AN120-m10突变株在25℃下和37℃下萌发率都极低,说明该突变株的萌发缺陷非常严重。之后,对突变株在固体培养基的缺陷进行验证。将突变株单个孢子置于固体培养基上,将来自同一子囊的四个孢子放在一行,将6组单孢子组在固体YPAD于25℃中培养3~4 d后,4株突变体在固体培养基上萌发状况如图3(b)所示,能直观的看到4株突变株在固体培养基上的萌发缺陷更为严重。而各突变株在37℃下除AN120-m17全不萌发,且AN120-m17萌发率也极低。并且野生型的单孢子在固体培养基上萌发只需2 d,而突变型则需要4 d。显著观察到的是AN120-m5的单个孢子在固体培养基上于任何温度下都完全不萌发。结合上述实验数据表明,4株突变株在产孢正常,也没有生长缺陷的情况下,确实是在萌发过程中有缺陷,其孢子萌发时间较野生型更长。

图3 验证突变株在液体和固体培养基中的萌发率Fig.3 Germination efficiency of mutants in liquid medium and on solid medium
可见突变体AN120-m5的单个孢子在固体培养基中完全不能萌发,但是在液体培养基中,却能够萌发,考虑到在液体培养基中孢子的聚集性,于是将其子囊孢子的4个孢子紧紧贴近置于固体培养基YPAD上,发现萌发效率和单个孢子相比有所提高,如图4,这可能是因为在AN120-m5中多个孢子聚集在一起,某种物质的生成能诱发萌发的发生,而导致萌发率提高。

图4 AN120-m5 4个紧凑挨近的子囊孢子在固体培养基上的萌发Fig.4 Germination on solid plate of tetrad spores of AN120-m5
2.3 萌发缺陷稳定性验证
为确保突变株的缺陷稳定性,验证是否单个基因突变发生在突变株中,对突变株的孢子进行分离,将其与自身突变株的单倍体进行交配,获得自交双倍体。测验结果由图5可知,突变体AN120-m8、AN120-m10和AN120-m17的自交后代AN120-m8C、AN120-m3C、AN120-m4D,在 37℃下萌发率为38%、14%、43%。而由于AN120-m5突变株不能得到单倍体,所以不能交配得到自交双倍体。实验显示,在自交后,萌发缺陷依然存在,说明突变性状是稳定的。

图5 自交双倍体萌发率Fig.5 Germination efficiency of self-crossed mutant diploid cells
为了进一步验证萌发缺陷的稳定性,在和野生型单倍体杂交三代后,测试在液体培养基内的萌发率,由图6可知,同一个平板上切割的杂交双倍体的孢子,为清楚确认生长良好的菌落确是来自于野生型,取生长良好菌落和野生型单倍体交配,发现其和野生型孢子萌发情况相同。实验证明,萌发状况良好的单菌落是来自野生型,而萌发状况不良的单菌落则是来自突变型。由图6可以明显看到,每个四分体的2个突变型孢子在25℃下经过三代杂交后萌发情况始终较野生型的2个孢子弱,呈现出萌发缺陷的性状。由图7可知AN120-m8、AN120-m10和AN120-m17的第三代杂交双倍体AN120-G38、AN120-G310、AN120-G317在 37 ℃萌发率分别为45%、48%和53%,较原始菌株有所提高,但是始终低于野生型。实验进一步证明,萌发缺陷稳定存在突变型菌株中,不随着产孢过程中遗传物质的分离3次后消失,显著表现为野生型与突变型孢子的生长优良状况始终呈现出2∶2的状态,进一步证明突变株是单基因突变菌株的可能性很大。

图6 第三代杂交双倍体切割孢子Fig.6 Dissection of the third gerneration hybrid diploid cells

图7 第三代杂交双倍体萌发率Fig.7 Germination of the third gerneration hybrid diploid cells
2.4 讨论
本实验室研究利用孢子作为载体进行酶的固定化,将酶固定在孢子壁外层二酪氨酸层内以及利用化学方法将酶共价交联在去除二酪氨酸层的壳聚糖球体上,得到新型固定化酶型孢子。但是经过固定化的孢子其中一个缺陷是孢子遇到营养物质将萌发,为了确保固定化酶的重复使用性,同时利于研究萌发机制,本研究通过化学试剂对酿酒酵母细胞进行诱变,旨在获取萌发缺陷菌株。本实验筛选方法的特征在于利用孢子对乙醚的抗性,保护了在37℃下未萌发的突变型孢子,再在25℃下得以萌发,经过进一步筛选,成功地从3×108个细胞中筛选到约300株初选菌株,并且通过各种验证,最终获得了4株目的菌株。由于上述突变株在液体培养基中有严重的萌发缺陷,初步表明符合微胶囊的应用条件。
有研究者用切孢技术将四倍体孢子分离[13],在本研究中,使用显微镜和针尖将孢子分离获得突变体单倍体,不仅直观看到在固体培养基上突变株的萌发缺陷更为明显,并且明显观察到AN120-m5突变体单个孢子在固体培养基上完全不能萌发,这对于后续筛选突变基因具有重要意义。而该突变体在液体培养基中能萌发,但是其单个孢子不能在固体培养基上萌发,并且多个孢子聚集在一起时,其四分体孢子在固体培养基上萌发率提高,这可能是由于孢子分离的状态影响了萌发的发生,该突变体的孢子可能只以子囊的形式萌发,其具体的原因待进一步探究。
为验证突变株萌发缺陷的稳定性,从而确认突变的来源是否来自单个基因上。在同时测试杂交双倍体和自交双倍体的萌发率后,实验证明,在与野生型单倍体杂交三代后,其野生型孢子和突变型孢子生长优劣状况始终呈现2∶2的比例,缺陷依然存在,不随着产孢后遗传物质的分离而消失,证明缺陷稳定存在突变株内,所以4株突变株是单基因突变菌株有很大的可能性。4株突变株性状各有不同,而且特别显著的是AN120-m5的性状和其余3株有很大差异,至少说明经过后续筛选我们可以获得2个以上的突变基因。
3 结 语
本研究成功利用甲基磺酸乙酯进行突变处理,并利用孢子对乙醚的抵抗性确定了一种筛选萌发突变株的方法,并以此找到了4株在固体培养基和液体培养基同时具有萌发缺陷的突变株,并且萌发缺陷稳定存在。由于单基因突变的可能性很大,后续实验利用确定找到发生突变的基因,从而达到敲除突变基因获得完全不萌发的突变菌株,并研究用于工业固定化酶的工程菌株以及为萌发机制。
