调控黑曲霉葡萄糖转运系统增强柠檬酸的合成
2019-04-24李江华堵国成
殷 娴 , 李江华 , 刘 龙 , 堵国成 , 陈 坚 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
柠檬酸 (citrate)是最具商业价值的有机酸之一,年产量达到170万吨。黑曲霉(Aspergillus niger)是主要的柠檬酸生产菌[1],然而根据Alvarez-Vasquez的模型,柠檬酸生产强度还可以有5倍的提高空间[2]。目前黑曲霉的代谢工程改造策略围绕中心代谢通路和呼吸链展开[3],表达糖酵解途径[4-5]和TCA循环[6-8]的关键酶以及交替氧化酶[9]均无法提升柠檬酸产量,仅加强rTCA循环[10]对柠檬酸合成有促进作用。在柠檬酸工业生产中,原料为淀粉,淀粉经过淀粉酶液化后过滤,得到清液和混液,通过清液和混液进行勾兑得到种子和发酵培养基,此时培养基中约一半的碳源为葡萄糖,一半碳源以多聚葡萄糖的形式存在,而工业生产菌在发酵初期合成大量糖化酶,将多聚葡萄糖分解为葡萄糖,因此,在发酵前期培养基中碳源已经基本以葡萄糖的形式存在,所以柠檬酸发酵对碳源的吸收实际上就是对葡萄糖的吸收。Torres的研究发现黑曲霉中存在两类葡萄糖转运蛋白,一为高亲和力葡萄糖转运蛋白,Km值约为260 μmol/L,另一类为低亲和力的葡萄糖转运蛋白,Km值约为3.67 mmol/L[11]。低亲和力葡萄糖转运蛋白可以提供柠檬酸发酵足够的代谢通量,但该系统仅在葡萄糖浓度高于50 g/L时起作用[11]。葡萄糖转运是柠檬酸发酵的第一步,调整葡萄糖转运系统对柠檬酸发酵的影响值得研究。目前黑曲霉中已经鉴定到一个高亲和力葡萄糖转运蛋白mstA[12],该蛋白质在产酶黑曲霉CBS513.88和产酸原始菌株ATCC1015中存在,而在黑曲霉柠檬酸生产菌株H915-1中不存在,因此,H915-1中的高亲和力葡萄糖转运蛋白需要进行鉴定。
在真菌中存在很多假定的葡萄糖转运蛋白,它们归类于主要协同转运蛋白超家族(major facilitator superfamily,MFS)[13-14],可以是单向转运蛋白或 H+同向转运蛋白,有些可以转运多种底物。酿酒酵母(Saccharomyces cerevisiae)的葡萄糖转运目前研究得最透彻,含有至少20个转运蛋白参与葡萄糖的转运[15],一些转运蛋白具有信号转导功能[16-17]。在构巢曲霉(A.nidulans)基因组中预测到了17个己糖转运蛋白[18],白念珠菌(Candida albicans)基因组中含有20个假定的葡萄糖转运蛋白[19]。在真菌中存在多种葡萄糖转运蛋白,说明特定条件下转运系统是多个基因差异性表达的结果。每一个转运蛋白有其特定的底物、亲和力和转运能力,调整转运蛋白可以使赋予菌体营养摄入的灵活性,使之适应多样的营养环境。
黑曲霉H915-1基因组中预测到21个葡萄糖转运蛋白,其中1个低亲和力葡萄糖转运蛋白在整个发酵过程中高表达,5个高亲和力葡萄糖转运蛋白低表达(GEO号GSE74544)。本研究对一个假定的葡萄糖转运蛋白的功能进行鉴定,最终通过过表达转运蛋白提升了柠檬酸产量。
1 材料与方法
1.1 菌株和培养基
大肠杆菌DH5α用作载体构建的宿主菌。黑曲霉H915-1为江苏国信协联能源有限公司 (柠檬酸产量居中国第三位)的柠檬酸生产菌株,作为出发菌株。
大肠杆菌转化子利用含100 μg/mL氨苄青霉素的LB培养基进行筛选,黑曲霉转化子利用含150 μg/mL潮霉素的ME培养基 (3%麦芽提取物,0.5%蛋白胨)进行筛选。柠檬酸发酵培养基为玉米清液和玉米混液的混合物,含15%总糖和0.08%总氮。不同葡萄糖浓度的发酵实验使用合成培养基 (3 g/L NH4NO3,0.1 g/L KH2PO4,1 g/L MgSO4·7H2O,0.015 g/L CuSO4·5H2O,0.001 67 g/L FeCl3·6H2O,0.008 g/L ZnSO4·7H2O 和 3.74 g/L CaCl2),葡萄糖浓度分别调整为3%、5%、8%和10%。葡萄糖限制性培养基中的葡萄糖质量浓度则分别调整为0.05、0.1 g/L和0.5 g/L。
1.2 实验方法
1.2.1 表达载体的构建 共表达所用表达框包含hph抗性基因表达框以及AnHGT1表达框。载体pUCDT利用Kpn I和Bam HI进行酶切。HGT1基因(NCBI序列号 XM_001399160.2) 以 H915-1的cDNA为模板,利用引物gpd-HGT-F和Trp-HGT-R进性RT-PCR扩增,序列两端含有20 bp pUCDT同源序列,利用Vazyme One Step Clone Kit进行同源重组形成载体pGTH。随后pGTH利用Spe I和Not I进行酶切,并与用相同限制性内切酶酶切的pHPH连接,形成pHGTH,包含了2个表达框。利用引物pMD-F和pMD-R以pHGTH为模板,PCR扩增得到共表达框。所用引物序列见表1。共表达框示意图见图1。
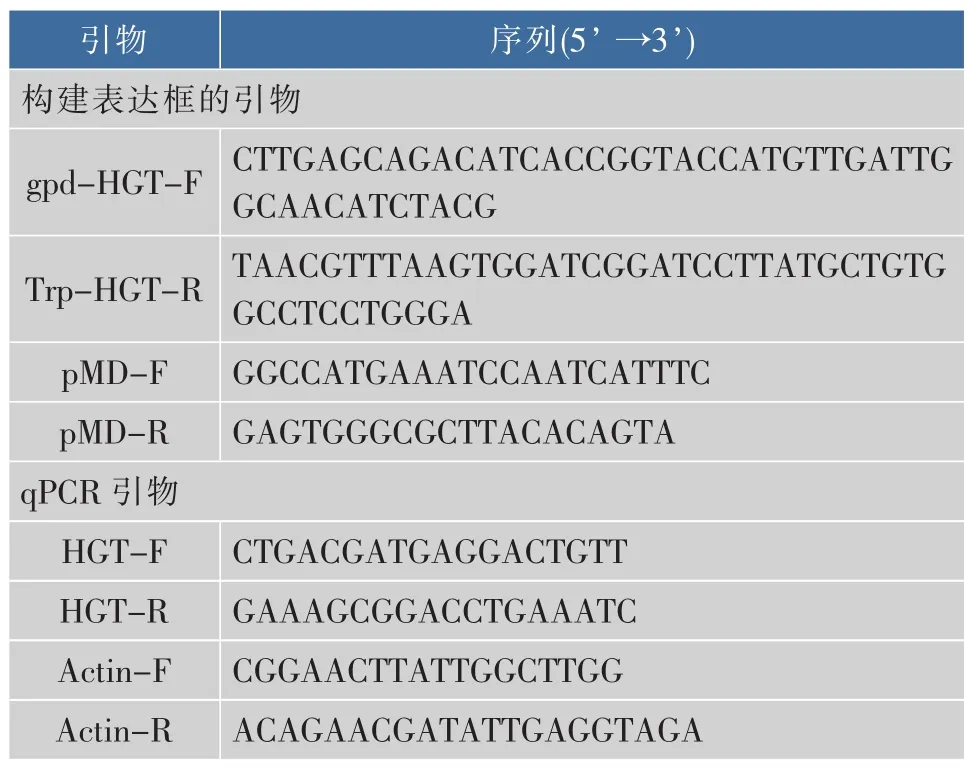
表1 引物序列Table 1 Primer sequences

图1 HGT1双元表达框示意图Fig.1 Structure of HGT1 binary expression cassette
1.2.2 进化树分析 利用Clustal Omega软件对DNA序列进行比对,利用MEGA5进行进化树分析[20]。
1.2.3 跨膜区域预测 利用在线软件TMHMM Server v.2.0 (www.cbs.dtu.dk/services/TMHMM/),对序列跨膜区域进行预测。
1.2.4 黑曲霉H915-1的转化 通过制备原生质体[21],利用PEG介导法进行转化[22]。所有的转化子在抗性培养基上经过3次单克隆培养进行纯化,纯化后的菌株进行qPCR鉴定。
1.2.5 黑曲霉H915-1的柠檬酸摇瓶发酵 黑曲霉种子培养:将黑曲霉孢子悬液以终浓度4×105个/mL接种至种子培养基,在35℃转速250 r/min培养24 h。
摇瓶发酵:将种子培养液以体积分数10%接种量接种至发酵培养基以250 r/min、35℃培养至还原糖耗尽,测定柠檬酸产量。
1.2.6 HPLC检测有机酸 收集样品后,利用miracloth过滤去除菌球,溶液在4℃经12 000 r/min离心10 min,取上清液经过相应稀释后,用0.22 μm滤膜过滤。利用Aminex 87-H有机酸柱进行HPLC检测,流动相 5 mmol/L H2SO4,流速 0.6 mL/min,温度35℃,利用紫外检测器在210 nm处进行检测。
1.2.7 总糖和还原糖的测定 DNS法测定还原糖:配制 0.2、0.4、0.6、0.8、1.0 g/L 的葡萄糖溶液。分别取葡萄糖溶液(或样品)1.0 mL,与1 mL DNS混匀,沸水浴加热 15 min,冰浴冷却后稀释定容至10 mL,测OD540。
总糖的测定:取5 mL发酵液至25 mL三角瓶中,加入6 mol/L HCl 5 mL,在沸水浴中加热25 min进行水解,冷却至室温。将溶液转移到50 mL烧杯中,调pH至7~8之间,定容至100 mL,过滤,适当稀释后用DNS法测定还原糖。
还原糖的检测。利用3,5-二硝基水杨酸(DNS)法检测还原糖含量。
未分解还原糖含量=总糖含量-还原糖含量。
1.2.8 qPCR检测柠檬酸发酵过程HGT1基因的表达 黑曲霉发酵8 h和24 h时快速取样,用miracloth收集菌体,并用无菌去离子水清洗并压干,置于液氮中冻存。用RNeasy Plant Mini Kit参照说明书进行样品总RNA的抽提,利用Takara公司PrimeScript RT Reagent Kit with gDNA Eraser进行反转录,qPCR所用引物见表1,引物Tm值为55℃,产物长度为120~150 bp,内参为actin。误差线为3个生物学重复。
2 结果与讨论
2.1 柠檬酸发酵过程中葡萄糖吸收速率的变化
对黑曲霉H915-1柠檬酸发酵的总糖和还原糖进行测定。柠檬酸发酵前,原料淀粉经淀粉酶液化后部分分解,初始还原糖质量浓度约为9%,未分解多糖在发酵过程中由黑曲霉自分泌的糖化酶进一步降解。因此,发酵前期的还原糖质量浓度增加,为避免糖化酶分泌不足造成培养基中的淀粉持续分解,发酵后期的还原糖生成影响糖耗速率检测。在一组接种种子培养基的同时添加过量糖化酶(糖化酶酶活为 2.5 g/(mL·min),添加量为 40 μL),另一组则不添加糖化酶。2组均在16 h时还原糖含量达最高值,添加糖化酶后培养基中的未分解多糖在16 h消化完全,未添加糖化酶的培养基则在24 h将未分解多糖完全消化(图2)。还原糖的消耗速率均在发酵后期放缓,从80 h的2.09 g/L/h逐步下降104 h的 1.16 g/(L·h), 至116 h糖消耗速率仅为 0.35 g/(L·h),因此需解决糖耗速率放缓的问题。由于黑曲霉产酸阶段主要由低亲和力的葡萄糖转运蛋白承担吸收葡萄糖,在发酵后期,随着葡萄糖浓度的减少,将逐步过渡到高亲和力的葡萄糖转运蛋白接管葡萄糖的吸收,因此有必要研究葡萄糖转运系统对柠檬酸合成的影响。

图2 柠檬酸发酵过程中还原糖、未分解多糖质量浓度及柠檬酸质量浓度Fig.2 Concentration of reducing sugar,undegraded sugar and citrate titer during fermentation
2.2 葡萄糖转运蛋白的进化树分析、多序列比对及跨膜预测
对黑曲霉H915-1柠檬酸发酵过程中在转录水平获得表达的糖转运蛋白采用进化树分析 (图3),参考序列为Swiss-Prot数据库所有高亲和力葡萄糖转运蛋白。ScHXT2为酿酒酵母的高亲和力葡萄糖转运蛋白[23],并没有鉴定到与之亲缘关系较近的蛋白。ScSnf3为酿酒酵母的高亲和力葡萄糖转运蛋白,同时是葡萄糖转运的负调节因子,在低葡萄糖浓度下通过抑制RGT1参与诱导HXT2的表达[15],evm.model.unitig_4.946与之亲缘关系较近。KlHGT1为乳酸克鲁维酵母(Kluyveromyces lactis)的高亲和力葡萄糖转运蛋白,同时可以转运半乳糖[24],evm.model.1.1149、evm.model.unitig_0.1770 和 evm.model.unitig_3.1098与之亲缘关系较近;进一步对这4条序 列 进 行 比 对 ,evm.model.1.1149、evm.model.unitig_0.1770和evm.model.unitig_3.1098与KlHGT1的同源性分别为41.7%、41.0%和43.1%(图4)。随后对evm.model.unitig_0.1770进行跨膜预测,发现该蛋白含有11个跨膜区域,N端在细胞膜内,C端预测在胞内(图5),对其命名为AnHGT1。
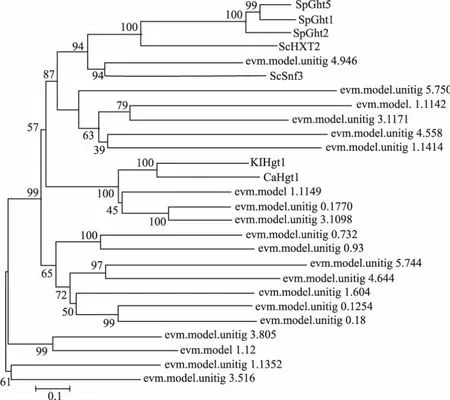
图3 葡萄糖转运蛋白序列的进化树分析Fig.3 Phylogenetic analysis of the sequences of glucose transporters by Neighbour-joining(NJ) method
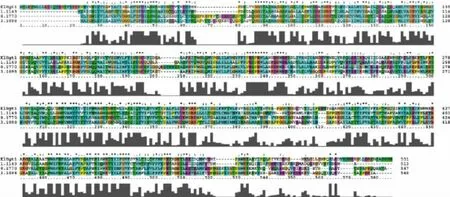
图4 葡萄糖转运蛋白的多重序列比对分析Fig.4 Multiple sequence alignment of glucose transporters
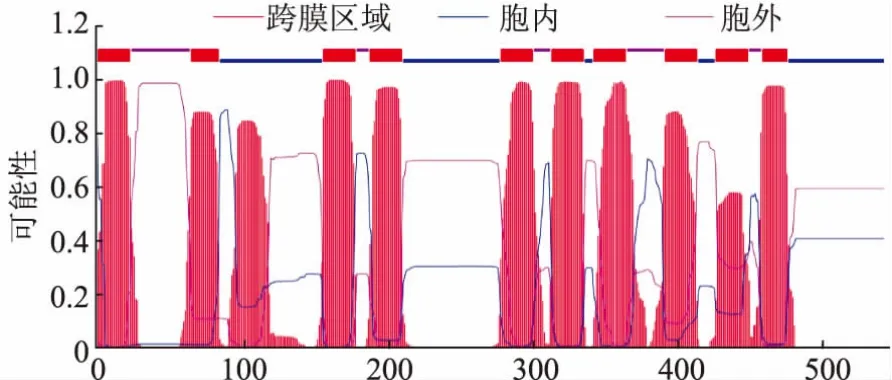
图5 evm.model.unitig_0.1770的跨膜预测Fig.5 Transmembrane helices in evm.model.unitig_0.1770
2.3 黑曲霉HGT1转化子的柠檬酸发酵
克隆黑曲霉自身的HGT1基因并构建表达框以转化黑曲霉H915-1,得到HGT1转化子。对转化子进行柠檬酸发酵,利用qPCR检测HGT1基因的表达 (图6),以H915-1发酵8 h的HGT1表达量为1,H915-1中的HGT1基因始终弱表达;HGT1转化子的基因在8 h的相对表达量是H915-1的44.5倍,24 h的相对表达量则下降为22.4倍,证明HGT1基因在转化子中的表达,同时由于HGT1的启动子为PgpdA,说明PgpdA在柠檬酸发酵中启动基因表达能力有所减弱。发酵前期还原糖生成速度放缓,意味着糖化酶的合成量有所降低,由于糖化酶组成型表达,因此与菌体量相耦联,可能HGT1的大量表达反而使菌体生长放缓,从发酵40 h开始,HGT1转化子的还原糖消耗快于H915-1,最终转化子的柠檬酸产量为145.2 g/L,比H915-1增加了14.7%,发酵时间缩短了 6 h(图 7(a)),最大比产酸速率提升了29.5%(图7(b))。由于发酵中后期,HGT1的表达量比较于菌体生长阶段减弱,可能HGT1的表达量需要在合适的范围内才有利于菌体利用碳源。

图6qPCR检测HGT1基因的表达Fig.6 qPCR for varification of HGT1 gene expression
进一步检测HGT1转化子在不同浓度碳源下的柠檬酸发酵,如图8(a)所示,在复合培养基中,初始葡萄糖浓度从3%逐步提升至10%,HGT1转化子的柠檬酸产量始终比H915-1提高6%左右,表明HGT1的表达有利于柠檬酸的合成。利用合成培养基,在发酵120 h碳源耗尽的情况下,添加30 g/L葡萄糖到培养基中,检测葡萄糖的消耗,由图8(b)可知,HGT1转化子对葡萄糖的吸收快于H915-1,转化子完全消耗葡萄糖花费了26 h,而H915-1则在38 h时依然可检测到微量的葡萄糖,证明了HGT1的表达蛋白具有葡萄糖转运的功能,在低浓度碳源条件下促进了葡萄糖的吸收。同时,HGT1转化子的柠檬酸产量始终高于H915-1,表明促进葡萄糖的转运可进一步促进H915-1合成柠檬酸。
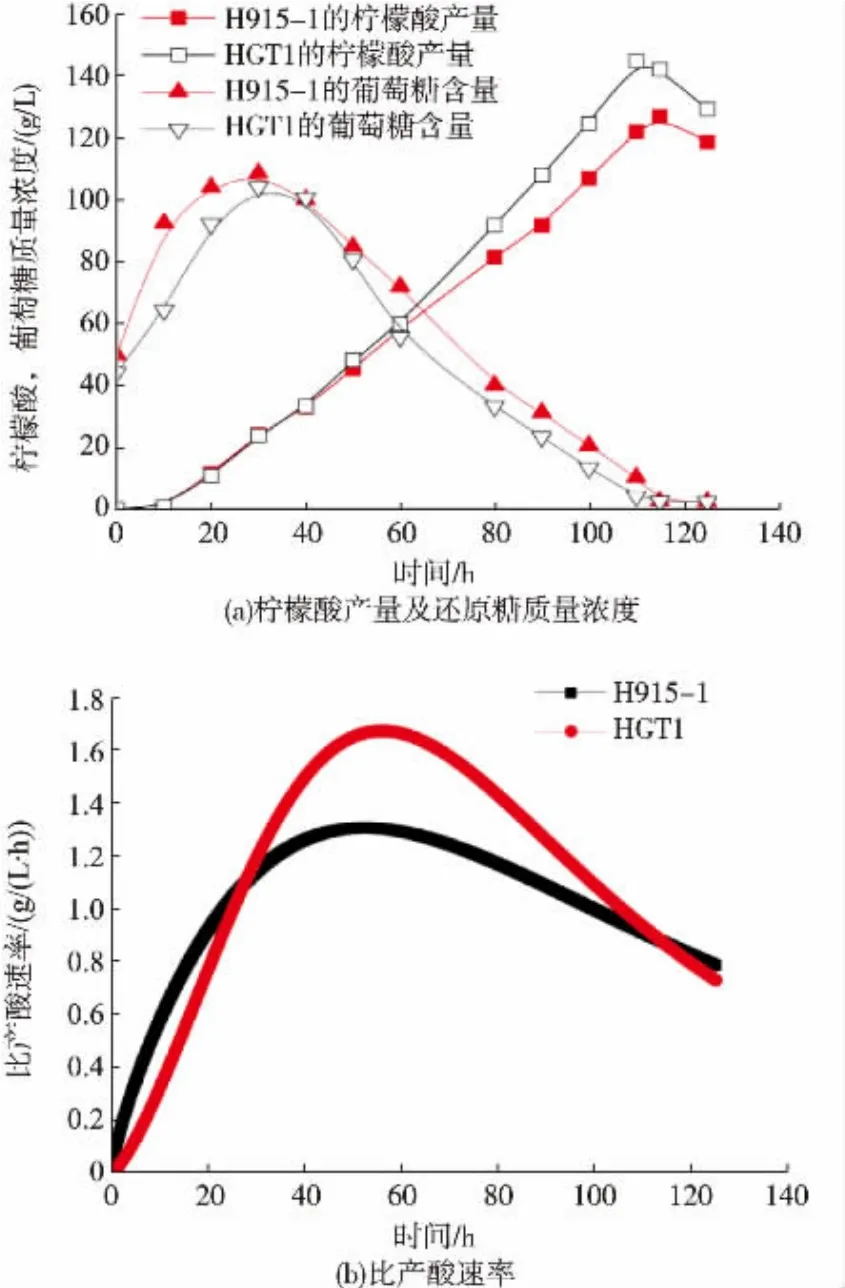
图7 HGT1转化子的柠檬酸发酵Fig.7 Citrate fermentation of HGT1 transformants


图8 不同条件下的柠檬酸发酵Fig.8 Citrate fermentation under different conditions
2.4 HGT1对黑曲霉在葡萄糖限制性培养基上生长的影响
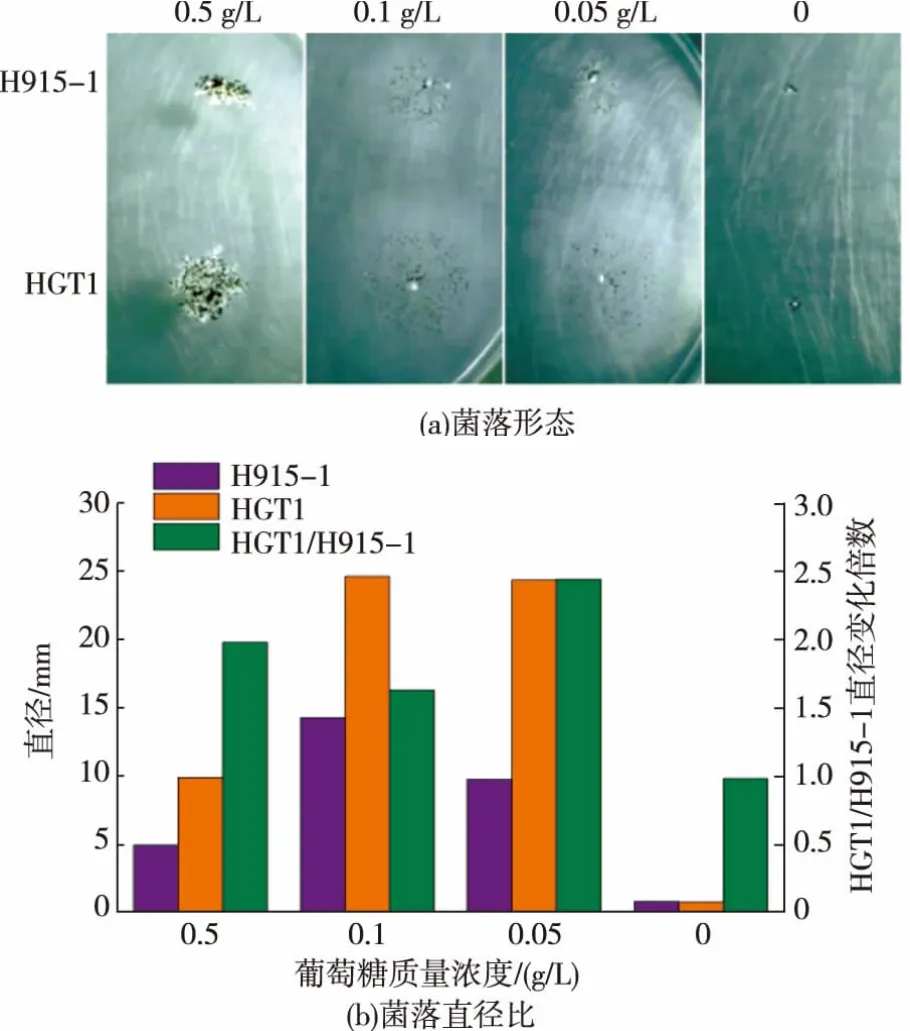
图9 葡萄糖限制性培养基上菌落的生长Fig.9 Growth of strains in limited glucose media
在平板上涂布稀释的黑曲霉孢子,在34℃静置培养24 h至长出单菌落,将单菌落接种于低浓度碳源培养基上,34℃培养4 d,测量菌落直径,检测HGT1对黑曲霉生长的影响,由图9(a)可知,在各质量浓度葡萄糖限制性培养基上[25],HGT1转化子的菌落生长强于H915-1。转化子和H915-1的菌丝形态没有明显差异,在0.5 g/L葡萄糖质量浓度下形成致密菌落,菌落直径较小,显微镜下显示菌丝为短粗状,孢子囊较大;降低碳源质量浓度至0.1 g/L导致菌丝成发散的细丝状,并贴在培养基表面生长以吸收贫瘠的碳源,孢子囊细小,但和菌丝一样分散生长,使菌落直径比0.5 g/L葡萄糖时更大。但进一步降低葡萄糖质量浓度并没有扩大菌落,因为菌体生长受碳源限制而更缓慢。由菌落直径比(图9(b))可知,HGT1转化子在各质量浓度葡萄糖限制性培养基上生长的菌落直径比H915-1增加约50%~150%,说明HGT1的组成型表达有利于菌体在低质量浓度葡萄糖培养基上生长,意味着糖转运速度的加快,证明HGT1蛋白具有转运葡萄糖的功能。
3 结语
本文作者对黑曲霉H915-1基因组中假定的葡萄糖转运蛋白进行了研究,通过进化树分析、序列比对分析,获得与KlHGT1亲缘关系较近的evm.model.unitig_0.1770序列,经跨膜预测该蛋白含有11个跨膜区域,N端在细胞膜内,C端在胞内,将其命名为AnHGT1。在H915-1中组成型表达HGT1基因,转化子的柠檬酸产量比对照增加了14.7%,发酵时间缩短了6 h,最大比产酸速率提升了29.5%。且在不同碳源浓度的培养基中,HGT1转化子的柠檬酸产量均高于H915-1,表明增加葡萄糖吸收速度有利于强化柠檬酸合成。葡萄糖补加实验表明HGT1转化子完全消耗葡萄糖的时间比H915-1缩短了12 h,证明了HGT1蛋白具有转运葡萄糖的功能。在限制性葡萄糖培养基上的生长实验,发现HGT1转化子的菌落直径比对照增加50%~150%,进一步证明HGT1具有转运葡萄糖的功能。本研究提高了黑曲霉菌株生产柠檬酸的产量,对柠檬酸产业具有积极意义,并且确定了新的高亲和力葡萄糖转运蛋白的功能,丰富了对黑曲霉葡萄糖转运系统的认识,为后续改造黑曲霉提供了依据。
