饲料添加活性污泥对刺参生长、摄食及代谢的影响
2019-04-24,,,,,
, ,,, ,
(1.大连市现代农业生产发展服务中心大连市水产研究所,辽宁 大连 116085;2.大连汇新钛设备开发有限公司,辽宁 大连 116039;3.近海(大连)生态发展有限公司,辽宁 大连 116085)
刺参(Apostichopusjaponicus)属棘皮动物门(Echinodemata)、海参纲(Holothuroidea)、刺参科(Stichopodidae),在自然条件下分布于我国黄渤海水域。刺参营养丰富,富含多糖和不饱和脂肪酸等活性物质,具有很高的医用价值和营养保健作用。随着上世纪九十年代刺参养殖业的蓬勃发展,蛋白质饲料供应面临着新的挑战。传统刺参配合饲料的蛋白质来源主要以鱼粉、大豆粉、虾粉、豆粕等为主[1-3],近年来饲料价格逐年攀升导致刺参养殖成本增加,同时刺参饲料行业管理混乱,饲料营养配比不科学、饲料质量低下等问题严重制约了刺参养殖经济效益[4-5]。本试验中的活性污泥是工厂化鱼类养殖的残饵和代谢物经生物包细菌降解处理的固体代谢物,含有大量微生物蛋白和多种营养物质,其营养成分可以作为潜在的蛋白质饲料替代来源[6-8]。本试验在饲料中添加不同剂量的活性污泥,研究其对刺参生长、摄食、耗氧率、排氨率的影响,为养殖代谢物二次开发利用,提高资源利用效率提供理论依据。
1 材料与方法
1.1 试验刺参来源
试验刺参取自大连金州三十里堡养殖场,平均体重为(0.97±0.09)g,挑选大小相似的健康个体进行分组试验。
1.2 日常饲养与管理
养殖槽规格为50 cm×40 cm×80 cm,槽内弱充气。海水取自大连黑石礁海域经过沙滤沉淀处理,槽内养殖水温14±1 ℃,pH 7.9~8.4,盐度30‰~32‰。每天早晨按照刺参体重的8%投喂饲料,投喂前清除粪便和残饵并全量换水。养殖室内避光处理,白天光照小于600 lx。
1.3 活性污泥来源和饲料设计
污泥和活性污泥取自全封闭循环水养殖大菱鲆的固体废物。其中污泥为集污槽中直接收集的大菱鲆粪便和残饵颗粒物等,活性污泥为大菱鲆养殖中的代谢物和残饵经过生物包中微生物降解后的脱落固体物。试验饲料的主要成分为海参商品饲料、污泥和活性污泥,在试验饲料中适量添加鱼粉和沸石粉,使各组饲料营养成分尽量一致。A组为对照组,B组为污泥试验组,C组、D组、E组、F组为活性污泥试验组,按照活性污泥在饲料中所占比例设置试验梯度。各组饲料适量添加黏合剂并涂在波纹板上投喂,可以减少饲料在水中的溶失,便于研究海参的摄食情况。各组饲料的配比如表1。

表1 试验饲料配方和成分分析(%)
1.4 样品测定与分析方法
1.4.1 刺参生长指标 在试验开始和第30 d、第60 d时对刺参体重称重。称量前停食48 h,称量时将刺参放在干净光滑的瓷盘上静置待其自然舒展。用吸水纸吸附体表水分至微干。用解剖工具取出刺参内脏器官后,用电子分析天平分别対刺参体重、体壁、内脏重进行称重,计算试验刺参增重率(WGR)、日增重(WGPD)、特定生长率(SGR)、脏壁比(R)。计算公式如下:
增重率WGR(%)=(Wt-W0)/W0×100
日增重WGPD(g/d)=(Wt-W0)/T
特定生长率SGR(%)=[lnWt-lnW0]/W0×100
脏壁比R=Wv/Wb
式中,Wt为刺参平均终重(g),W0为刺参平均初重(g),T为饲养时间(d),Wv为刺参内脏重量(g),Wb为刺参体壁重量(g)。
1.4.2 摄食率及饲料转化率 投喂前对饲料板称重,每天换水时将饲料板取出与收集的粪便烘干称重。通过计算饲料板上的重量差值和饲料板上饲料的回收率进行校正,计算刺参的摄食量和摄食率。饲料回收率的测定是将饲料板放置加满海水的空白槽24 h后称重计算饲料回收量与投入量的比值。回收的粪便和各组投喂饲料采用灰分法测定有机质的含量。以15 d为周期计算60 d内各组刺参的摄食率(IR)、排粪率(FPR)、饲料转化率(FCR)和刺参对有机质的同化率(AE)。计算公式如下:
摄食量C(g)=W1-(W2/Rf)
摄食率IR(g/g·d)=C/(Wt×T)
排粪率FPR(g/g·d)=F/(Wt×T)
饲料转化率FCR(%)=(Wt-W0)/TF×100
同化效率AE(%)=(1-e/f)/(1-e)×100
式中,W1为饲料投入量(g),W2为饲料回收量(g),Rf为饲料回收率(%),Wt为刺参平均终重(g),W0为刺参平均初重(g),C为摄食量(g),F为排粪量(g),T为饲养时间(d),TF为总投饵量(g),e为刺参粪便有机质含量,f为饲料有机质含量。
1.4.3 刺参耗氧率和排氨率 试验第30 d和60 d对各组刺参进行耗氧率和排氨率试验,试验前停食48 h。试验采用静水密闭法,每组设三个500 mL塑料瓶呼吸室作为重复,每个塑料瓶放置4头刺参并设三个重复,另取新鲜海水注满塑料瓶作对照组,各组用塑料薄膜密封4 h后抽取水样。溶解氧和氨氮分别采用碘量法和次溴酸盐氧化法进行测定。
耗氧率的计算公式:RO2=[(D1-D2)×V]/(T×W)。
其中RO2为耗氧率[mg/(g·h)]。D1为试验开始呼吸室溶解氧含量(mg/L),D2为试验结束呼吸室溶解氧含量(mg/L),V为呼吸室内水体的体积(L),T为试验时间(h),W为呼吸瓶内刺参湿重(g)。
氨氮排泄率的计算公式:RTNH3=[(N2-N1)×V]/(T×W)。
其中RTNH3为氨氮排泄率[μg/(g·h)]。N1为试验开始呼吸室内氨氮含量(μg/L),N2为试验结束呼吸室内氨氮含量(μg/L),V为呼吸室内水体的体积(L),T为试验时间(h),W为呼吸瓶刺参湿重(g)。
1.4.4 数据处理 数据用SPSS13.0软件进行单因素方差分析,结果用平均值±标准差表示,组间均值差异性比较采用Duncan多重检验,以P<0.05为显著性差异。
2 结果分析
2.1 活性污泥饲料对刺参生长的影响
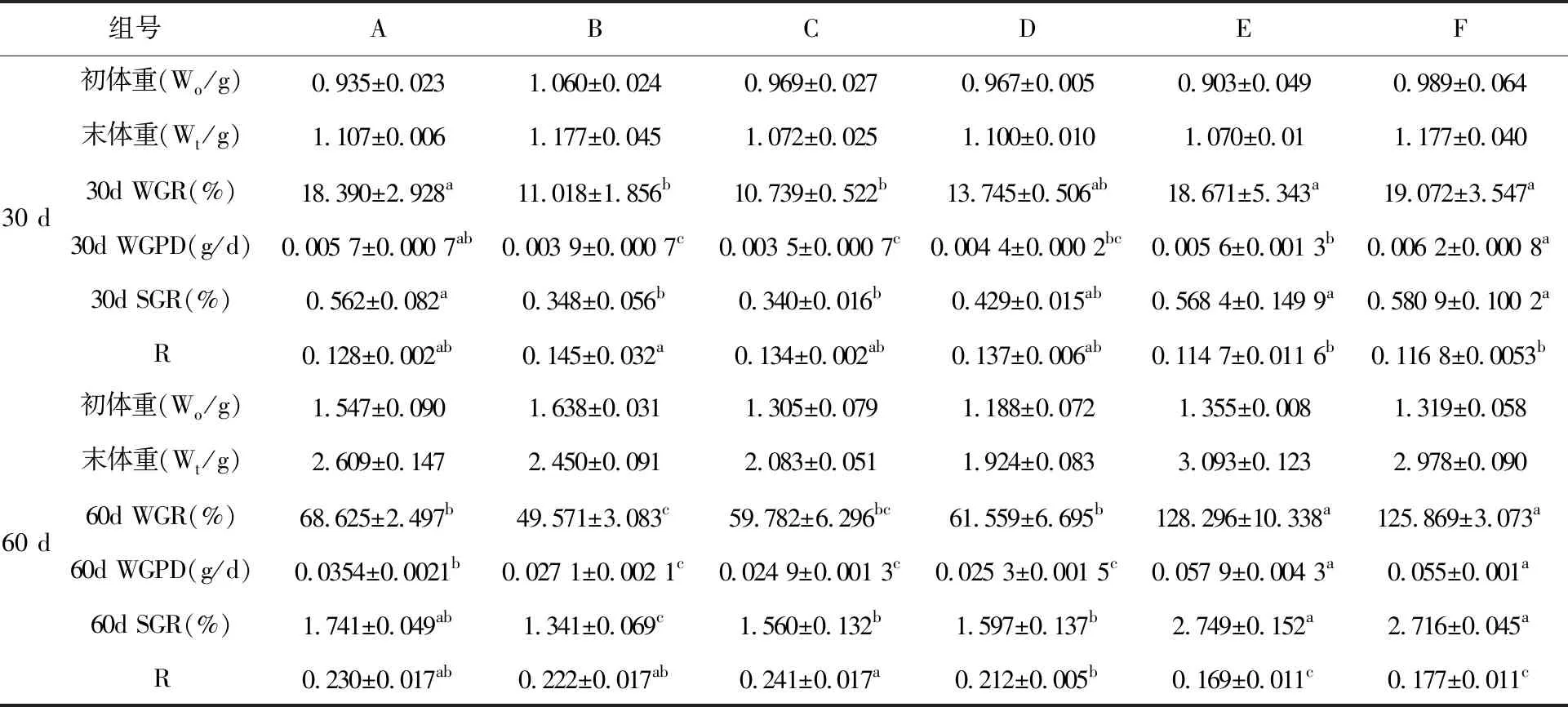
表2 30 d和60 d不同饲料组刺参生长情况
注:同行中标有不同小写字母表示差异显著(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)。
表2分别显示试验第30 d和第60 d各组刺参的增重率、日增重、特定生长率和脏壁比。在前30 d添加20%、30%活性污泥组和商品饲料组刺参增重率和特定生长率最高,三组之间差异不显著(P>0.05)。投喂污泥组和添加50%活性污泥组增重率和特定生长率最低,两组之间差异不显著(P>0.05),但与F组、E组和A组差异显著(P<0.05);E组和F组的脏壁比最低,B组脏壁比值最高,另外A、B、C、D四组之间差异不显著(P>0.05)。
在后30 d添加30%和20%活性污泥组的刺参增重率显著高于其它四组(P<0.05),两组之间差异不显著(P>0.05)。A组、D组、C组次之,三组间差异不显著(P>0.05)。投喂污泥组增重率最低;投喂20%和30%活性污泥刺参日增重率最高,与其它四组均差异显著(P<0.05)。投喂污泥组特定生长率最低,与其他组相比差异显著(P<0.05);投喂20%和30%活性污泥组刺参脏壁比最低,与其它四组均差异显著(P<0.05)。C、A、B三组脏壁比最高,三组间差异不显著(P>0.05)。
2.2 活性污泥饲料对刺参摄食影响

表3 四个周期(60 d)不同饲料组刺参摄食率、排粪率、饲料转化率、同化效率
注:同行中标有不同小写字母表示差异显著(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)。
表3为各组刺参在4个周期(15 d为一个周期)对不同饲料的摄食率、排粪率、饲料转化率和对饲料有机质的同化效率。第一周期投喂商品饲料组和添加30%活性污泥组刺参摄食率最高,两组之间差异不显著(P>0.05),投喂污泥组刺参摄食率最低,与其他五组刺参相比差异显著(P<0.05);添加50%活性污泥组和添加40%活性污泥组排粪率最高,两组之间差异不显著。B组排粪率最低,与其他五组差异均显著(P<0.05);第一周期污泥组刺参饲料转化率最高;在试验前15 d对照组刺参对饲料有机物的同化效率显著高于其他五个组,各组之间均差异显著(P<0.05)。第二周期对照组刺参摄食率最高并与其它组差异显著(P<0.05),污泥组刺参摄食率最低,与前15 d结果相似;投喂20%、30%活性污泥和对照组刺参排粪率最高,三组之间差异不显著(P>0.05),污泥组刺参排粪率最低,与其他五组差异显著(P<0.05);B、F、E组饲料转化率最高,三组之间差异不显著(P>0.05)。50%活性污泥组刺参饲料转化率最低;对照组刺参对饲料有机质的同化效率最高,与其它五组差异均显著(P<0.05)。第三周期各组刺参的摄食率均比前30 d明显提高,其中20%活性污泥组刺参摄食率最高,污泥组最低,各组之间均差异显著(P<0.05);E组和F组排粪率最高,两组差异不显著(P>0.05),D组排粪率最低;F、E组饲料转化率最高,C组最低;F组刺参有机质同化效率最高,B组同化效率最低。第四周期添加活性污泥的各组刺参摄食率和对照组没有显著差异(P>0.05),污泥组刺参摄食率最低,与其它组差异显著(P<0.05);C组排粪率最高,与其他各组差异显著(P<0.05);投喂20%和30%活性污泥组刺参饲料转化率最高,与对照组相比差异显著(P<0.05),C组饲料转化率最低;F组和E组刺参同化效率最高,污泥组同化效率最低并与其它五组差异显著(P<0.05)。
2.3 活性污泥饲料对刺参代谢的影响
图1显示在第30 d投喂20%、30%活性污泥组和对照组刺参耗氧率最高,达到0.038~0.041 mg/g·h,三组之间差异不显著(P>0.05)。污泥组刺参耗氧率最低(0.026 mg/g·h),与其他五个组差异显著(P<0.05)。在第60 d对照组刺参耗氧率最高,达到0.033 mg/g·h。而投喂污泥组刺参最低(0.017 mg/g·h)。投喂50%、40%和30%活性污泥组刺参耗氧率差异不显著,在0.025~0.027 mg/g·h之间。各组刺参在第30 d耗氧率均比第60 d高。

图1 不同饲料组的刺参耗氧率
图2显示在第30 d投喂20%、30%和对照组刺参排氨率最高,达到5.52~5.89 μg/g·h,三组之间差异不显著(P>0.05)。污泥组排氨率最低(3.57 μg/g·h),与其它五个组差异均显著(P<0.05)。第60 d 20%活性污泥组刺参排氨率(4.08 μg/g·h)最高,对照组(3.79 μg/g·h)次之,两个组之间差异显著(P<0.05),污泥组排氨率最低(1.94 μg/g·h)。各组刺参在养殖60 d排氨率均比30 d低。
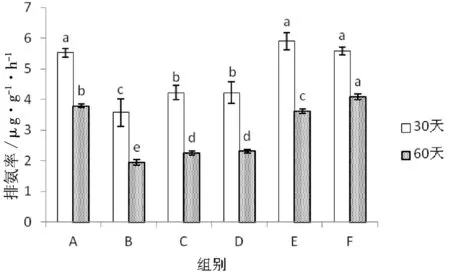
图2 不同饲料组的刺参排氨率
3 讨论
3.1 饲料对刺参生长和摄食的影响
水产动物通过对饲料各种营养物质的摄取,满足自身生长、发育、代谢的需求[9-11]。试验中刺参的生长指标与摄食效率、饲料转化率和同化效率有一定关系。前30 d各组刺参生长指标总体较低,各组刺参的摄食率、排粪率也不高,可能是刺参适应新的养殖环境和饲料。在后30 d添加20%、30%的活性污泥饲料的刺参优于投喂商品饲料刺参,特定生长率和增重率最高。同时两组刺参摄食率和排粪率也较好,尤其是添加20%的活性污泥组对饲料有机质的同化效率最高。脏壁比的高低代表刺参体壁的增长对有效生长结果的影响,添加20%、30%的活性污泥饲料刺参脏壁比在试验中最低,反映出这两组刺参有效生长较其它组刺参快。近年来根据刺参底栖腐屑型食性的特点与其它生物混养研究具有重要的生态效益和经济效益。在混养模式中海参可以摄食鱼类、虾类、贝类等养殖产生的有机碎屑和代谢产物,提高氮、磷利用效率[12-13]。王吉桥[14]等研究显示刺参与虾夷马粪海胆混养比同密度单养养殖效率高。谢双如[15]在福建进行仿刺参与日本对虾、花蛤池塘生态混养取得了良好的养殖效益。滕炜鸣[16]等混养研究显示红鳍东方鲀的代谢产物可以丰富刺参饵料,促进刺参生长。本试验投喂经过生物包细菌处理过的活性污泥能够促进刺参生长和摄食,今后针对刺参不同生长阶段生理消化的特点,更加高效地利用活性污泥尚需进一步的研究。
3.2 饲料对刺参生理代谢的影响
呼吸和排泄是动物基本的生理活动。水产动物进行能量代谢会消耗氧气和体内的营养物质,饵料经过刺参体内分解后产生排泄物并排入水中,在刺参的排泄物中氨氮约占70%[17],因此耗氧率和排氨率能够反映动物摄食、吸收、排泄等能量活动的情况。试验第30 d投喂海参商品配合饲料和投喂20%、30%活性污泥组刺参耗氧率和排氨率较高,而在第60 d投喂20%活性污泥的刺参排氨率最高,刺参生理代谢能力最强。各组刺参耗氧率和排氨率差异可能与各组饲料蛋白含量有关。朱伟[18]等研究表明稚参饲料中最适粗蛋白含量为18.21%~24.18%,本试验在刺参商品饲料中添加污泥和活性污泥,各组试验饲料粗蛋白含量在19.54%~26.1%之间,粗蛋白含量比较适合刺参的生长。同时在最适粗蛋白含量范围内,较低的蛋白水平饲料下幼刺参体内生理活动较强,与于建华[19]等研究的结果基本一致。活性污泥经流化床处理后含有硝化细菌等益生菌,益生菌对刺参代谢具有一定的促进作用。付鑫[20]等研究表明投喂益生菌能够促进刺参生长,提高代谢能力。活性污泥中的益生菌对幼刺参代谢的作用机制有待进一步深入研究。
