神经元-小胶质细胞EphA4/ephrin通路调控小胶质细胞介导的缺血后炎性损伤
2019-04-22魏慧星陈萍萍吴钢杨锦珊
魏慧星,陈萍萍,吴钢,杨锦珊
(福建医科大学附属第一医院神经内科,福州350000)
Eph 受体家族是目前已知最大的受体蛋白酪氨酸激酶家族,Eph 受体及其配体ephrin 构成的双向信号系统能同时向受体和配体所在的细胞传导信号[1]。EphA4受体是中枢神经系统表达最为丰富的EphA受体,主要分布于神经元[2-4]。我们前期研究发现,EphA4受体在缺血后早期即出现蛋白表达水平的上调[5],提示EphA4/ephrin可能通过调节炎性损伤,参与缺血性脑损伤早期的病理过程,但具体机制仍不明确。本研究建立神经元-小胶质细胞混合培养体系和糖氧剥夺再复氧模型,使用预聚集化的EphA4-Fc激动小胶质细胞ephrin配体,从离体水平检测缺血再灌注后的细胞凋亡、小胶质细胞增殖活化和亚型极化以及小胶质细胞功能的变化,旨在研究神经元-小胶质细胞间EphA4/ephrin 信号通路介导的脑缺血后炎性损伤的分子机制,为缺血性脑损伤的治疗提供新思路。
材料与方法
1 实验动物
出生24h内的C57BL/6乳鼠购自福建医科大学动物实验中心 [SYXK (闽)2012. 0001]。
2 主要试剂与仪器
DMEM/F12、胎牛血清、0.25%胰蛋白酶、PBS、HBSS、EBSS购自美国Hyclone公司;Neurobasal培养基、B27购自美国Gibco公司;多聚赖氨酸、DAPI、谷氨酸、99%甘油、Triton X-100购自美国Sigma公司;BSA、CHAPS购自美国Amresco公司;重组小鼠EphA4-Fc嵌合体购自美国R&D systems公司;重组人IgG(Fc)、山羊抗人IgG(Fc)抗体、CY3标记的山羊抗兔抗体购自美国Jackson ImmunoResearch Laboratories公司;兔抗小鼠EphA4抗体、兔抗小鼠MAP-2抗体、兔抗小鼠iNOS抗体购自美国Abcam公司;兔抗小鼠GAPDH抗体购自武汉博士德公司;兔抗小鼠Iba-1抗体购自日本Wako公司;兔抗小鼠Arg-1抗体购自美国Cell Signaling Technology公司;HRP标记山羊抗兔IgG购自北京中杉金桥生物试剂公司;PVDF膜(0.45μm)购自美国Millipore公司;BCA蛋白定量试剂盒购自武汉博士德公司;SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术有限公司;增强化学发光法(ECL)试剂盒购自美国Thermo Fisher Scientific公司;Annexin V- FITC 凋亡检测试剂盒购自美国Cell Signaling Technology公司;总RNA提取试剂盒购自德国Qiagen公司; 1st strand cDNA合成试剂盒、SYBR Green PCR Master Mix购自日本Takara公司;IL-1β、IL-4、IL-6、IL-10、TNF-α、TGF-β细胞因子ELISA检测试剂盒购自美国Invitrogen公司;FC 500流式细胞仪购自美国Beckman公司;荧光显微镜(BX51)购自日本Olympus公司;台式低温离心机购自德国Eppendorf公司;电泳仪购自美国Bio-Rad公司;凝胶成像分析系统购自美国Syngene公司; ABI 7500荧光定量PCR仪购自美国 Applied Biosystems公司;Infinite 200多功能荧光酶标仪购自奥地利Tecan公司。
3 海马神经元的原代培养
于无菌条件下取新生24h 内野生型C57 BL/6小鼠大脑,剔除脑膜和血管后小心分离双侧海马,用显微剪剪成1mm×1mm×1mm的小块,以终浓度0.125%的胰蛋白酶消化后吹打成单细胞悬液,经200目滤网过滤,800r/min×8min离心并小心弃去上清后以含2% B27、1% 双抗和 0.5mmol/L L-谷氨酸的Neurobasal培养基重悬细胞,将细胞接种于多聚赖氨酸包被的24孔板(105细胞/孔)或96孔板(5×104细胞/孔),定时换液,选取第5d 的细胞用于实验,MAP-2 免疫荧光染色鉴定神经元。
4 小胶质细胞原代培养
取出生24h 内的乳鼠大脑,消化、过滤、离心、以含10% FBS的DMEM/F12培养基重悬后,以5×106/ml接种至多聚赖氨酸包被的75cm2培养瓶,培养7~9d 至胶质细胞分层,200r/min 振荡2h,收集上清液离心、接种,继续培养5d 后,Iba1 免疫荧光染色鉴定小胶质细胞。
5 神经元-小胶质细胞混合培养及糖氧剥夺再复氧(OGD/R)
神经元和纯化后的小胶质细胞(小胶质细胞:神经元=1∶2)进行混合培养。小胶质细胞种入神经元后3h后弃去培养基,用无菌PBS漂洗培养瓶2遍后,加入无糖的DMEM缓冲液,置于含有93% N2/5% CO2/2% O2的三气培养箱中,进行氧糖剥夺培养60min。随后弃去无糖的DMEM缓冲液,用无菌PBS漂洗培养瓶2遍后,加入神经元培养基,重新移入含95% O2和5% CO2的37 ℃恒温培养箱复氧复糖培养24h后收取细胞。
6 实验分组和干预药物的配置
实验分为正常对照组(Control)、糖氧剥夺再复氧组(OGD/R)、OGD/R+溶剂对照组(Vehicle)和OGD/R+EphA4-Fc干预组4组。
20μg重组小鼠EphA4-Fc嵌合体与48mg羊抗人IgG-Fc抗体溶于30μl PBS4℃孵育过夜,Vehicle对照组以人IgG-Fc片段代替重组小鼠EphA4-Fc嵌合体孵育过夜。OGD时及复氧后均向培养基内分别加入终浓度3μg/ml的预聚集化的EphA4-Fc或IgG-Fc
7 免疫荧光染色
细胞爬片晾干后冰甲醇固定15min,0.25%Triton X-100/PBS 破膜液室温孵育15min,10% BSA-/PBS 封闭1 h,由一抗(兔抗小鼠EphA4,1∶200或兔抗小鼠Iba-1,1∶400)4℃孵育过夜,二抗(CY3标记的山羊抗兔抗体,1∶400)室温孵育1h,PBS漂洗后滴加DAPI(1μg/ml)室温避光孵育10min染核,PBS漂洗后甘油封片,Olympus荧光显微镜(BX51型)显像并拍照。小胶质细胞计数:在高倍(40倍物镜)荧光显微镜下每细胞爬片随机选取5个视野,计数Iba-1阳性细胞(个/视野),并取平均数。
8 流式细胞凋亡检测
细胞消化后,冰PBS漂洗2遍,以1×Annexin V 结合缓冲液重悬至 1~5×106细胞 /ml。每 96μl细胞混悬液加入1μl Annexin V-FITC和12.5μl 碘化丙啶(PI),室温避光孵育10min,流式细胞仪检测凋亡细胞。正常活细胞Annexin V及PI均低染, 分布在流式细胞分析图的左下区(Q4;早期凋亡细胞Annexin V高染而PI低染分布在图的右下区(Q3);晚期凋亡细胞annexin V及PI 均高染, 分布在图的右上区(Q2);坏死细胞Annexin V低染而PI高染,分布在图的左上区(Q1),将早期凋亡细胞百分数(Q3)和晚期凋亡细胞百分数(Q2)之和称为总凋亡率。
9 实时荧光定量PCR
Trizol 提取总 RNA,样品在-80℃保存,并取部分样品测RNA的质量,OD260/280在1.8~2.0之间,可用于下一步实验。然后按照cDNA逆转录试剂盒的步骤将RNA转录为cDNA。进行荧光定量PCR,采用20μl的反应体系,Master Mix 10μl、上下游引物各 0.5μl、cDNA 模板 2μl、SYBR Green 1μl、ddH20 6μl。iNOS、Arg-1 和 GAPDH 引物由上海生工设计并合成,引物序列见(图3A)。扩增条件为:95℃预变性10min,进入循环,95℃变性10s,58℃退火30s,72℃延伸30s共循环40次。反应结束后用荧光定量分析软件绘制扩增曲线以及熔解曲线,通过对熔解曲线的分析来检测产物特异性。建立标准曲线后,以GAPDH为内参,2-ΔΔCt法计算样本的相对定量值。
10 Western blotting
在糖氧剥夺再复氧后24h收取细胞加入CHAPS裂解液冰上充分裂解细胞30min,搜集细胞裂解液置于4℃离心机12000r/min离心10min,搜集上清以BCA法测定蛋白浓度,12%聚丙烯酰胺凝胶电泳分离蛋白,转移蛋白至PVDF膜,5%脱脂奶粉室温封 1.5h,加入一抗 iNOS(1∶400),Arg-1(1∶1000),GAPDH(1∶500),4℃摇床孵育过夜,TBST漂洗4次后加入二抗,室温孵育1h,TBST漂洗4次,超敏ECL发光检测系统检测iNOS,Arg-1和内参GAPDH的蛋白表达水平,Gene Genius Bio-Imaging System凝胶成像仪拍照,并利用Image J软件系统分析结果。
11 酶联免疫吸附试验(ELISA)
在规定的时间点,搜集细胞上清,4℃ 3000r/min离心20min,用无菌管收集细胞上清,严格按照ELISA试剂盒操作手册的步骤进行操作,并绘制标准曲线,分别计算细胞上清IL-1β、IL-4、IL-6、IL-10、TNF-α、TGF-β 水平(pg/ml)。
12 统计学分析
数据采用SPSS 19.0软件进行分析,计量结果以(¯x±sd)表示,随后进行单因素方差分析,并使用Turkey法进一步进行组间比较,P<0.05被认为差异有统计学意义。
结 果
1 神经元表达EphA4受体
原代神经元免疫荧光染色显示,几乎100%的原代神经元表达EphA4受体,EphA4受体呈点状弥漫分布于原代神经元细胞胞膜和细胞质,未见其表达于胞核(图1)。
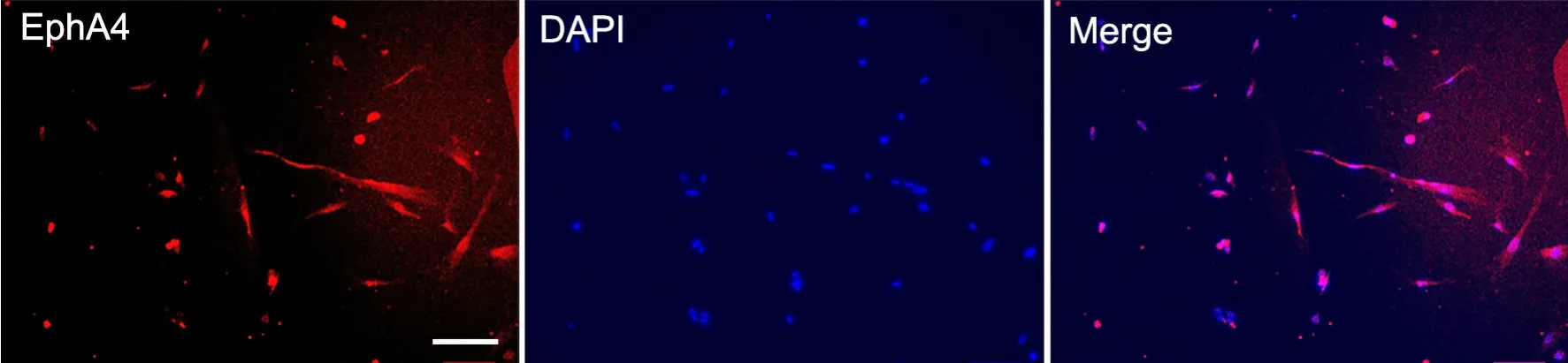
图1原代神经元EphA4表达的免疫荧光检测(DAPI复染)。标尺,100μmFig. 1 Immunofluorescent examination for expression of EphA4 in the primary neurons (DAPI counterstaining). Scale bar, 100μm
2 EphA4-Fc处理促进OGD/R诱导的神经元细胞凋亡和小胶质细胞增殖
Annexin V-PI 流式细胞术分析显示,在OGD/R后24h,OGD/R组总凋亡率(16.19%)较Control组(8.23%)明显上升;EphA4-Fc干预组总凋亡率(23.93%)较Vehicle(IgG)对照组(16.87%)显著升高,表明EphA4-Fc干预进一步加重OGD/R导致的细胞凋亡(图2A,图2C)。
Iba-1免疫荧光染色结果显示,在OGD/R后小胶质细胞数目增加、胞体增大,表现为增殖、活化,而EphA4干预组较Vehicle(IgG)对照组小胶质细胞增殖、活化更为显著(图2B,图2D)。
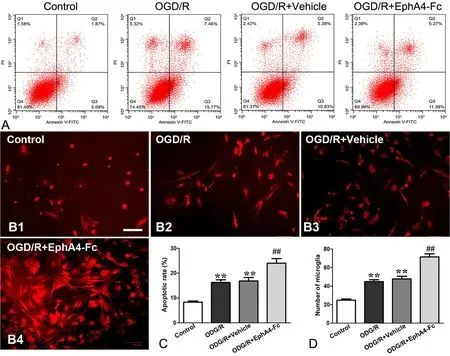
图2 EphA4-Fc处理对OGD/R导致的细胞凋亡和小胶质细胞增殖的影响 。A,细胞凋亡的流式细胞术检测; B1-B4,Iba-1免疫荧光染色显示小胶质细胞的数目和形态(标尺,100μm);C,流式细胞术检测细胞凋亡率的统计学分析;D,小胶质细胞计数(单位:个/视野)的统计学分析;**,P <0.01 vs Control组;##, P < 0.01 vs Vehicle 组Fig. 2 Effects of EphA4-Fc treatment on apoptosis of neuron and proliferation of microglia induced by ODG/R. A, representative results of flow cytometry analysis for apoptosis; B1 to B4, the number and morphology of primary microglia detected by Iba-1 immunofluorescent staining (scale bar, 100μm);C, statistical analysis for apoptotic rate detected by flow cytometry; D, statistical analysis for microglia number; **, P <0.01 vs Control group; ##, P <0.01 vs Vehicle group
3 EphA4-Fc处理促进OGD/R后小胶质细胞向M1亚型极化
进一步应用实时荧光定量PCR和Western blot分析小胶质细胞亚型标志物iNOS和Arg-1表达显示,OGD/R后iNOS的mRNA和蛋白表达水平均明显上调,而EphA4干预组这一趋势较Vehicle(IgG)对照组更为显著;与之相反,OGD/R后Arg-1的mRNA和蛋白表达水平均明显下调,而EphA4干预组较Vehicle(IgG)对照组下调更为显著。由此结果提示EphA4-Fc干预可促进OGD/R后的小胶质细胞向M1亚型极化(图3)。
应用ELISA法对细胞上清的细胞因子检测发现,OGD/R 后 IL-1β、IL-4、IL-6、IL-10、TNF-α 和TGF-β水平均显著上升;然而,在EphA4-Fc干预组,IL-1β、IL-6和TNF-α水平较Vehicle(IgG)对照组明显下降,IL-4、IL-10和TGF-β水平较Vehicle(IgG)对照组进一步上升,其中IL-4和TGF-β的水平升高具有统计学意义(表1,图4)。
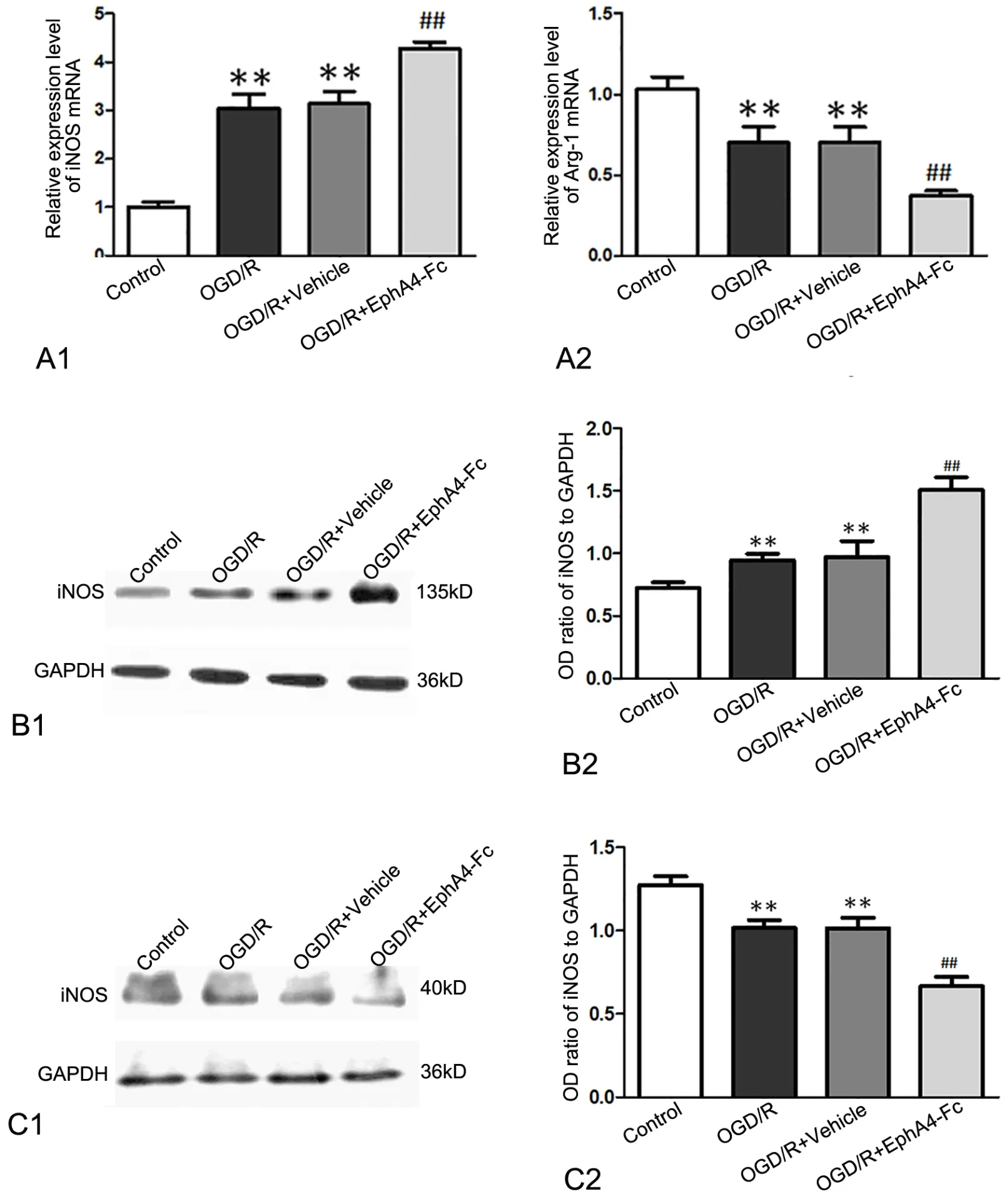
图3 EphA4-Fc处理对OGD/R后小胶质细胞亚型极化的影响。小胶质细胞亚型标记物iNOS(M1型)和Arg-1(M2型)的引物序列 (B-C)A,EphA4-Fc处理对OGD/R后小胶质细胞iNOS(A1)和Arg-1(A2)mRNA表达影响的qRT-PCR分析;B和C,EphA4-Fc处理对OGD/R后小胶质细胞iNOS(B1和B2)和Arg-1(C1和C2)表达影响的Western blot检测与统计学分析;*,P <0.01 vs Control组;##, P < 0.01 vs Vehicle组Fig. 3 Effects of EphA4-Fc treatment on ODG/R induced polarization of microglia subtype. Primers sequences(B-C) of microglia subtype marker iNOS(M1 type) and Arg-1(M2 type) used for RT-PCR A, qRT-PCR analysis for the effect of EphA4-Fc treatment on expression of iNOS mRNA (A1)and Arg1 mRNA (A2) in the microglia after OGD/R; B and C, Western blot detection and statistical analysis for the effect of EphA4-Fc treatment on expression of iNOS (B1 and B2) and Arg1 (C1 and C2) in the microglia after OGD/R; **, P <0.01 vs Control group; ##, P< 0.01 vs Vehicle group
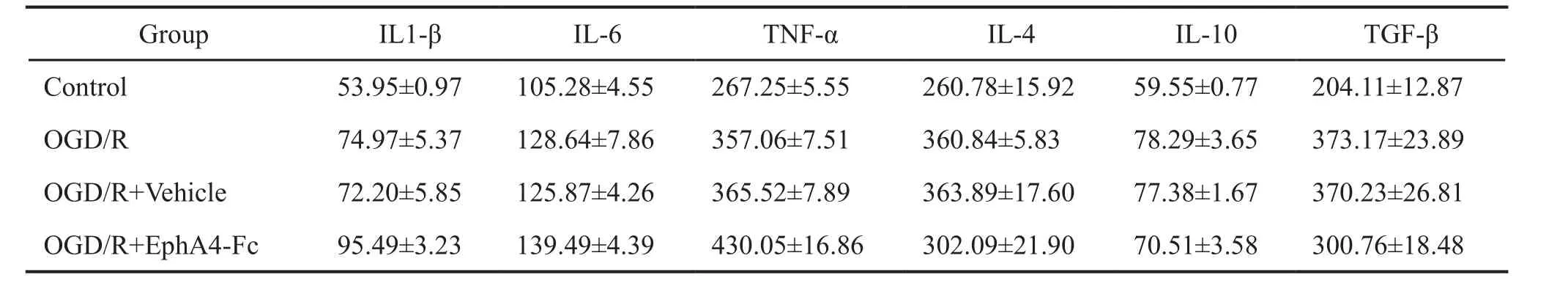
表1 培养细胞上清细胞因子水平(pg/ml)Tab.1 Content of cytokines in cultured cells (pg/ml)
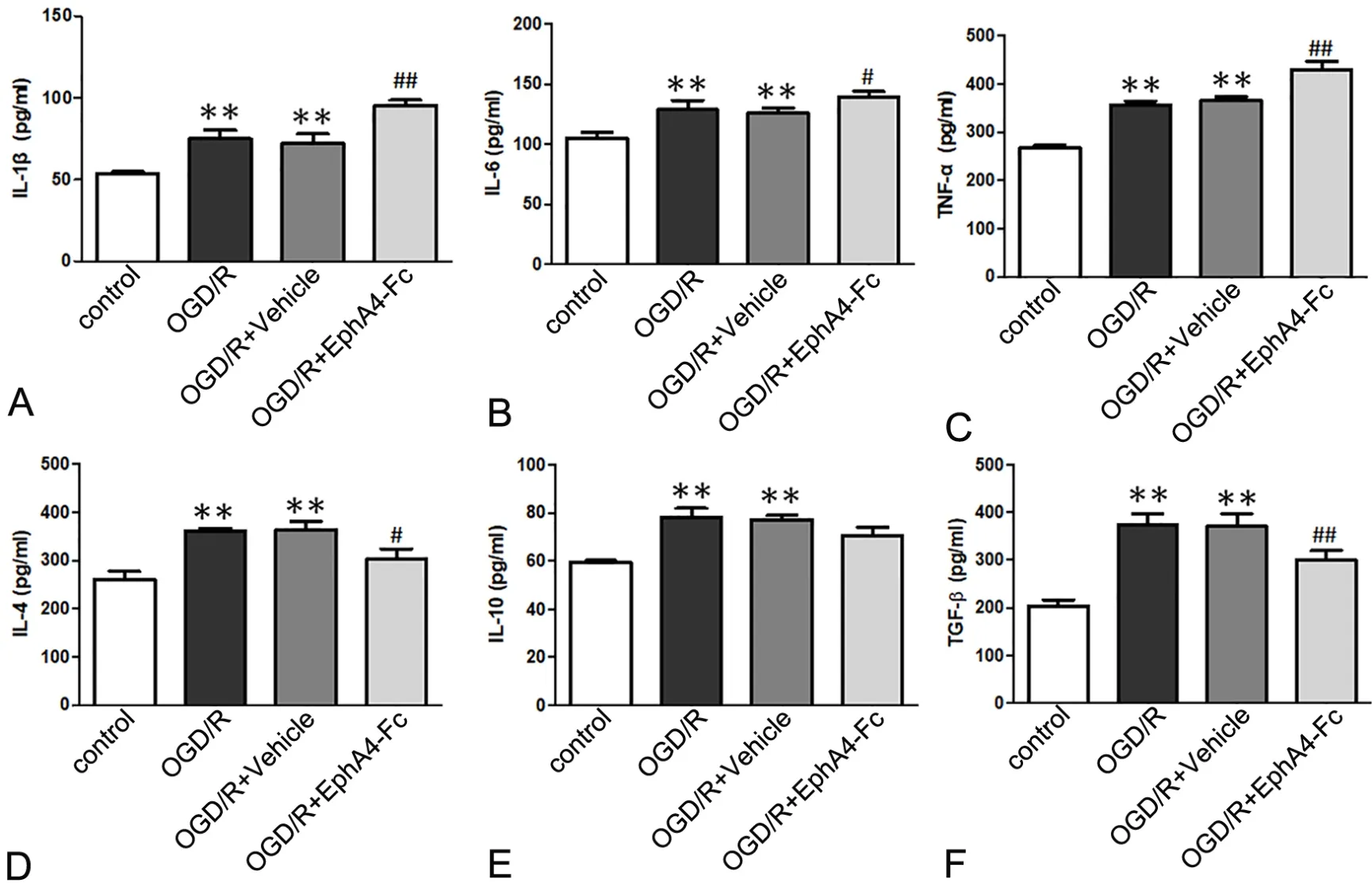
图4 EphA4-Fc处理对OGD/R后细胞上清细胞因子分泌的影响。A, IL-1β水平的统计学分析;B,IL-6水平的统计学分析;C,TNF-α水平的统计学分析;D,IL-4水平的统计学分析;E,IL-10水平的统计学分析;F,TGF-β水平的统计学分析;**,P<0.01 vs Control组;#,0.01<P< 0.05 vs Vehicle组;##,P< 0.01 vs Vehicle组Fig. 4 Effect of EphA4-Fc treatment on content of cytokines assessed by ELISA in cultured cells after OGD/R. A, statistical analysis for content of IL-1β; B, statistical analysis for content of IL-6 ; C, statistical analysis for content of TNF-α ; D, statistical analysis for content of IL-4 (D); E, statistical analysis for content of IL-10; F, statistical analysis for content of TGF-β; **, P<0.01 vs Control group; #, 0.01<P< 0.05 vs Vehicle group; ##, P< 0.01 vs Vehicle group
讨 论
脑缺血后的炎性损伤以小胶质细胞的聚集、活化和循环免疫细胞浸润为主要特点,在脑缺血后病理和转归过程中扮演重要角色。小胶质细胞作为中枢神经系统中重要的常驻免疫细胞,起源于中胚层,属于单核巨噬细胞系,是中枢神经系统抵御包括缺血在内的各种损伤的第一道防线。小胶质细胞活化是脑内炎症反应的第一步,脑缺血后活化的小胶质细胞迁移至缺血边缘区,并展示出“双刃剑”效应。活化的小胶质细胞一方面释放分泌炎症因子和细胞毒性物质加重组织损伤;另一方面吞噬细胞碎片,分泌抗炎因子和营养因子促进神经损伤的修复[6]。
小胶质细胞的亚型极化能解释其在中枢神经系统损伤后所展示出的双重作用。活化后小胶质细胞极化为不同的表型及功能亚型(M1和M2型),其中M1 型被视作经典的炎症型,通过分泌TNF-α,IL-1β 和IL-6等多种趋化因子和炎症因子,以清除病原体,但同时炎症介质如NO和氧自由基的释放如也会导致神经毒性,加重神经损伤;与之相反,M2型小胶质细胞能分泌多种抗炎因子如IL-4、IL-10和TGF-β及神经营因子促进神经损伤的修复与再生[7]。促进小胶质细胞从M1型向M2型极化,可能作为一种有效调控手段,减轻脑缺血后的炎性损伤、促进神经功能的恢复[8]。小胶质细胞的活化状态由许多因素所决定,比如神经元和小胶质细胞间的相互作用[9]。
在前期的研究中我们发现,EphA4受体在缺血后早期即出现蛋白表达水平的上调,参与缺血性脑损伤早期的病理过程[5];此外,有研究表明,EphA4 受体敲除减轻了小鼠脊髓损伤后小胶质细胞介导的炎症反应[10];另有研究发现,阻断EphA4 受体能降低缺血再灌注肠损伤后的血管通透性[11],提示EphA4/ephrin 信号通路可能通过调控缺血后的炎性损伤发挥作用。在本研究中,我们发现EphA4受体高表达于原代神经元,以预聚集化的EphA4-Fc激动神经元-小胶质细胞间的EphA4/ephrin逆向通路,发现糖氧剥夺再复氧后的小胶质细胞增殖、活化进一步增强,此外小胶质细胞向M1型极化,炎性介质分泌增加,抗炎因子分泌减少,最终导致的细胞凋亡增加。
综上所述, EphA4受体高表达于神经元,并且神经元EphA4介导的小胶质细胞ephrin逆向通路激活通过促进小胶质细胞向M1亚型极化,调控小胶质细胞功能,进而加重OGD/R所致的细胞凋亡。我们的发现为进一步研究EphA4/ephrin 通路在卒中后神经血管单元重塑中的角色,为缺血性脑卒中的治疗研究提示了新思路和新靶点。
