细胞膜异位表达钙网蛋白的CD4+ T细胞诱导EAE小鼠保护性免疫*
2019-04-22李心群李金亭
周 湧, 李心群, 李金亭, 许 文△
(1东莞市第五人民医院检验科, 广东 东莞 523899; 温州医科大学 2附属第一医院, 3基础医学院, 浙江 温州 325035)
包括多发性硬化症(multiple sclerosis,MS)在内的多种自身免疫病与自身反应性CD4+T细胞的过度活化有关[1]。将这些自身反应T细胞当作病原体,在体外活化并经射线照射后可作为疫苗,即T细胞疫苗(T-cell vaccines,TCV),可用于预防/治疗这些自身免疫病[2]。我们先前的研究表明,射线照射可上调活化T细胞表面钙网蛋白(calreticulin,CALR)表达[3]。因此我们推测TCV治疗自身免疫病的机制与射线上调活化T细胞表面的CALR表达有关。
实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)在临床表现及免疫病理方面与MS相似,是研究MS发病机制的经典动物模型。本研究采用小鼠髓鞘少突胶质细胞糖蛋白35-55(myelin oligodendrocyte glycoprotein,MOG35-55)诱导EAE动物模型,以射线照射的MOG35-55特异性T细胞为疫苗,探讨细胞膜异位表达CALR对TCV接种EAE小鼠免疫效果的影响,以期为MS等自身免疫性疾病的生物治疗提供新的理论依据和实验数据。
材 料 和 方 法
1 实验动物
雌性6~8周龄的C57BL/6购自上海斯莱克实验动物有限公司(合格证号:X1104063),并饲养于本校实验动物中心。所有实验均遵守温州医科大学实验动物福利和伦理原则,并随时接受伦理委员会的监督和检查。
2 主要试剂
小鼠MOG35-55(MEVGWYRSPFSRVVHLYRNGK)肽段由上海紫域联生物科技有限公司合成,纯度(HPLC)>95%;结核杆菌H37Ra购自Difco;完全福氏佐剂(complete Freund′s adjuvant,CFA)和百日咳毒素(pertussis toxin,PTX)购自Sigma;胎牛血清和RPMI- 1640培养基购自HyClone;小鼠干扰素γ(interferon-γ,IFN-γ)、白细胞介素4(interleukin-4,IL-4)、IL-10和IL-17A ELISA试剂盒购自R&D;兔抗鼠CALR多抗购自Abcam;FITC标记羊抗兔IgG购自北京百奥生物;T细胞分离磁珠购自美天旎公司;FITC-兔抗鼠CD4及PE-兔抗鼠Foxp3和PE-兔抗鼠CD25购自eBiosciences;RPMI-1640完全培养基:以RPMI-1640培养基为基础,加入10%的灭活的胎牛血清、1×105U/L青霉素及0.1 mg/L 链霉素。
3 主要方法
3.1抗原特异性T细胞制备 参照本实验室方法[4],将MOG35-55肽尾根部皮下注射以免疫C57BL/6 小鼠,制备抗原特异T细胞系(MOG-T)。体外培养的T细胞经抗原刺激48~72 h后细胞为活化态T细胞。使用前以磁珠分选纯化CD4+T细胞,以CD4和CD25双染检测细胞类型及活化状态。活化后的T细胞继续培养3~5 d 后作为静息态T细胞。
3.2CALR表达分析 活化T细胞以γ射线(20 Gy)照射后,继续培养4 h。分别于0、1、4和12 h取出部分细胞置于1.5 mL EP管中(每管1×106细胞),加入FITC标记的兔抗鼠CALR,4 ℃孵育30 min,流式细胞仪(FACSAria,BD Biosciences)检测,CellQuest 软件分析。
3.3特异抗体封闭CALR表达 活化T细胞以γ射线照射后,继续培养4 h后加入兔抗鼠CALR抗体,37 ℃孵育30 min,流式细胞术检测确认封闭效果。
3.4EAE诱导 依文献操作[5],将MOG35-55用PBS稀释成5 mg/L,并按1∶1等体积加入含结核杆菌H37Ra(终浓度5 g/L)的CFA,充分混合乳化。每只0.1 mL于C57BL/6小鼠尾根部两侧分4点皮下注射,第0和48 h腹腔注射0.5 mL PTX(每只500 ng)。采用5分制法对实验小鼠进行神经功能评估。具体评分标准如下: 无临床症状为 0 分;尾部张力消失为 1 分;双后肢无力为 2 分;后肢瘫痪为 3 分;双后肢伴前肢瘫痪为 4 分;濒临死亡或死亡为 5 分。当临床症状介于2个评分之间时以±0.5记。
3.5小鼠免疫 将小鼠随机分为正常对照(control)组、T细胞免疫(CALR+T)组、CALR封闭(CALR-T)组及PBS组,每组10只。正常对照组不做处理;CALR+T组和CALR-T组分别采用5×105~1×106CALR+T和CALR-T(100 μL)于EAE诱导前14 d尾静脉免疫,EAE诱导后7 d,以相同剂量T细胞再次尾静脉免疫 1 次;PBS组仅给予100 μL PBS。
3.6血清中细胞因子检测 免疫后第15天尾根部取血,ELISA检测血清中细胞因子IFN-γ、IL-4、IL-10和IL-17含量, 依试剂盒说明书操作。
3.7流式细胞术分析小鼠脾中Foxp3+调节性T细胞(regulatory T cells, Treg)的比例 磁珠分离CD25+细胞,首先与FITC 标记的anti-mouse CD4 抗体孵育30 min,洗涤后破膜,与PE 标记的anti-mouse Foxp3 抗体孵育30 min(按试剂盒说明书操作), 洗涤后加流式缓冲液重悬细胞, 上流式细胞仪检测。
4 统计学分析
所有数据都表示为均数±标准误(mean±SEM)。 采用统计软件为SPSS 19.0。单因素方差分析(one-way AVONA)作总体差异显著性分析, 各组间两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 射线照射诱导活化CD4+ T细胞CALR膜转位
我们首先通过[3H]-TdR掺入法及流式细胞术对用于免疫的T细胞系的抗原特异性及活化状态进行了检测。结果表明所用T细胞具有MOG特异性,见图1A,且为活化态T细胞,见图1B。另经流式细胞术分析显示,经20 Gy γ射线照射后,T细胞表面表达的CALR明显升高,并具有时间依赖性,见图1C。 而静息的T细胞表面CALR并未有明显变化,见图1D。

Figure 1.The expression of CALR on the surface of MOG-T cells. A: antigen-specificity of T cells; B: activation stage of T cells; C: activated T cell group; D: resting T cell group. T: T cells; F: feeder. Mean±SEM.n=3.**P<0.01vsT+MOG+F group.
图1MOG-T细胞表面CALR的表达
2 封闭CALR表达,降低TCV对EAE小鼠的免疫效果
为观察CALR表达对TCV治疗效果的影响,于免疫前,我们将所用T细胞与特异性抗体4 ℃反应30 min以封闭CALR。结果表明CALR+T免疫组的临床评分与PBS免疫组比较显著降低(P<0.01),而CALR-T细胞的免疫临床评分与PBS免疫组比较差异无统计学显著性,见图2。这说明封闭CALR降低了TCV对EAE小鼠的治疗效果。
3 封闭CALR影响EAE小鼠血清中细胞因子的分泌格局
CD4+的Th1和Th17细胞过度活化是导致多发性硬化症的关键因素。CALR+T细胞接种可抑制EAE小鼠Th1和Th17细胞因子IFN-γ和IL-17A的产生及上调Th2和Treg细胞因子IL-4和IL-10。封闭TCV表面CALR后,IFN-γ和IL-17A的水平明显上升,而IL-4和IL-10的水平明显下降(P<0.01),见图3。这一结果表明CALR细胞膜异位表达在TCV诱导的Th1/Th2和Th17/Treg转换中发挥重要作用。
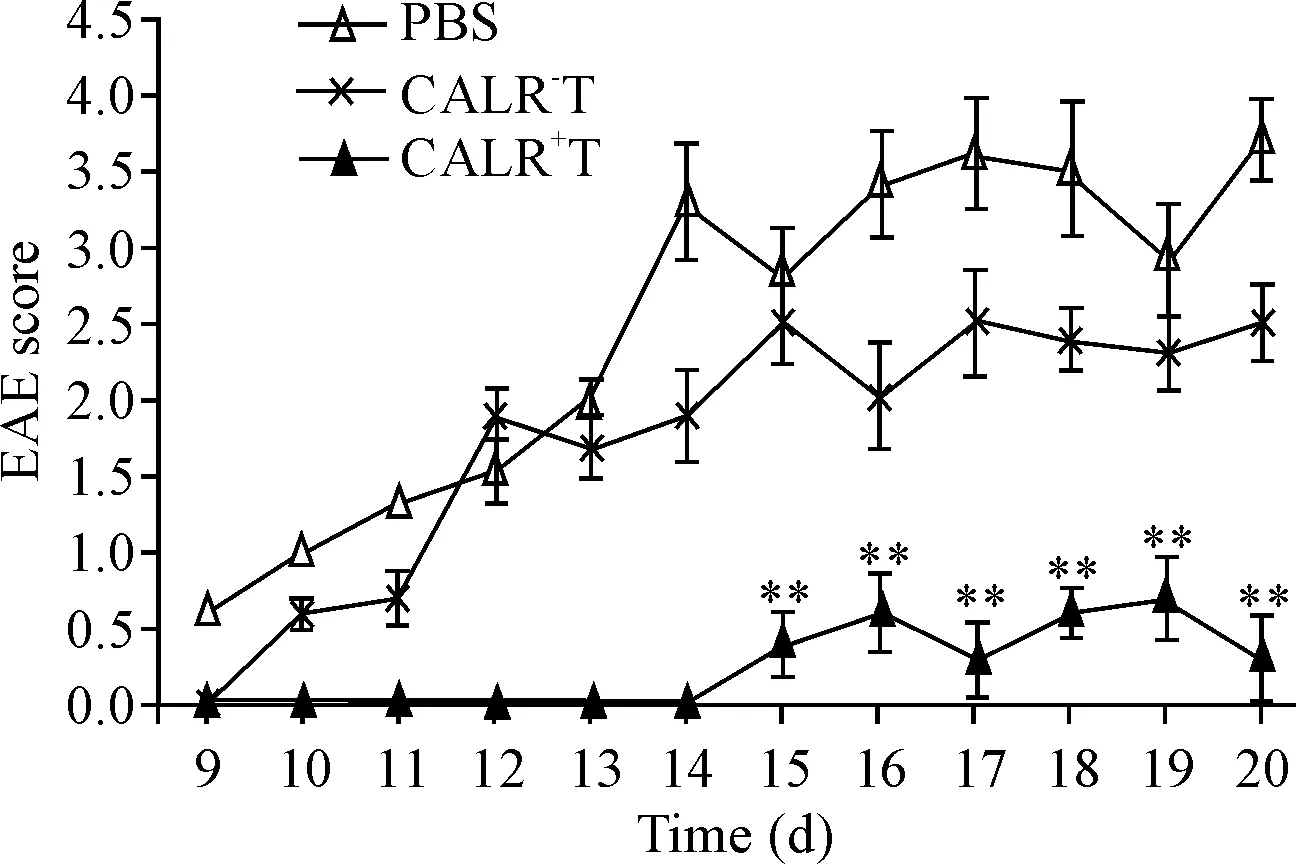
Figure 2.Blockade of CALR decreased the protective effect of TCV in the EAE mice. Mean±SEM.n=6.**P<0.01vsPBS group.
图2小鼠临床症状评分
4 封闭CALR下调小鼠体内Treg的数量
由于Treg在TCV诱导的保护性免疫中发挥关键作用,我们进一步检测了封闭CALR对TCV诱导Treg能力的影响。在疾病高峰期(免疫后第15天)取脾细胞用流式细胞术分析CD4+Foxp3+T细胞数。结果表明封闭CALR显著下调EAE小鼠外周淋巴组织中Foxp3+调节性T细胞的数量,与CALR+T细胞接种组比较差异有统计学意义(P<0.01),见图4。
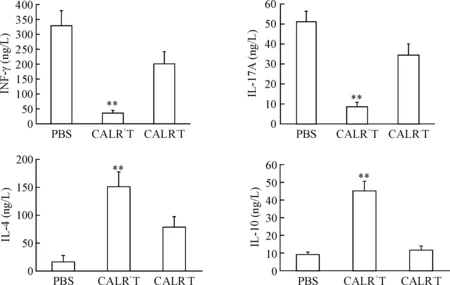
Figure 3.Blockade of CALR affected the cytokine patterns in the serum. Mean±SEM.n=6.**P<0.01vsPBS group.
图3封闭CALR对血清细胞因子表达的影响

Figure 4.The changes of the number of Treg analyzed by flow cytometry. Mean±SEM.n=4.**P<0.01vscontrol group.
图4流式细胞术分析小鼠脾Treg的数量
讨 论
自身反应性CD4+T细胞是MS等多种疾病的主要致病因素。借鉴传统疫苗的制备方法,将自身反应性CD4+T细胞当作致病物质,体外灭活后用作疫苗(TCV),已成功用于此类疾病的治疗,其机制主是诱导机体产生针对自身反应T细胞独特型表位(如TCR CDR3表位)的抗独特型及针对活化型表位(如CD25、HSP90等)的抗活化型CD4+Foxp3+调节性T细胞(Treg),从而抑制致病性Th1、Th17反应,达到预防/治疗自身免疫病的目的[6]。然而为什么照射后的T细胞具有此种效应仍不清楚。本研究表明射线照射可诱导活化T细胞表面异位表达CALR,从而赋予TCV诱导Treg产生及抑制炎症反应的能力。
CALR是一种主要存在于内质网的Ca2+结合蛋白,具有作为分子伴侣和调节细胞内钙浓度等多种生物学功能。有研究表明,射线照射及某些化疗药物可诱导CALR从胞质异位转位到胞膜。膜型CALR可作为“eat me ”信号促进树突状细胞对靶细胞的吞噬及加工抗原加工提呈能力[7]。
由于未经射线照射处理的活化自身反应T细胞不能作为TCV使用,因此我们推测射线照射可能诱导了CALR细胞膜的异位表达从而赋予其诱导保护性免疫应答的能力。为证实该假设,我们首先运用流式细胞术检测CALR在T细胞膜上的动态表达。结果显示射线照射可诱导CALR在活化而非静息T细胞膜上异位表达,并具有时间依赖性。之所以射线只诱导活化而非静息的T细胞异位表达CALR,可能是机体存在一种与活化相关的死亡方式[8]。研究表明射线照射及某些化疗药物可诱导肿瘤细胞细胞免疫原性凋亡,免疫原性凋亡的肿瘤细胞以细胞表面异位表达CALR、Erp57及释放HGMB1等损伤相关模式分子为特征[9]。我们的研究表明射线照射的活化T细胞具有免疫原性凋亡的特征。为证明在TCV诱导的保护性免疫与CALR上调表达有关,我们以EAE小鼠为模型,观察封闭CALR对TCV诱导保护性免疫效果的影响。与预期结果相一致,封闭CALR显著下调TCV对EAE小鼠的治疗作用。由于细胞在免疫原性凋亡过程中会表达多种损伤相关模式分子,因此并不排除这些分子与CALR共同发挥保护效应。
Th1和Th17及其细胞因子IFN-γ和IL-17等细胞因子的异常变化与多发性硬化发病密切相关。CD4+CD25+Foxp3+Treg可抑制Th1和Th17异常活化,在自身免疫病、肿瘤和器官移植等免疫病理发生中发挥重要作用[10]。本实验通过干预CALR表达显示CALR 与TCV诱导Treg的能力相关,下调CALR表达则EAE 小鼠外周免疫器官(脾脏)中Treg 细胞数量减少,炎性细胞因子IFN-γ和IL-17A水平明显升高,而抗炎细胞因子IFN-γ和IL-4下降,进一步证实了CALR在TCV诱导的调节性保护免疫中的作用。
综上所述,射线照射通过诱导活化T细胞表面异位表达CALR,从而赋予TCV诱导Treg、抑制免疫反应而缓解EAE 小鼠临床症状的能力。
