敲减NOB1基因表达对人结肠癌SW480细胞药物敏感性及侵袭和迁移能力的影响*
2019-04-22马立志陈江伟
窦 艳, 邱 鹏, 马立志, 陈江伟
(邢台市人民医院, 河北医科大学附属医院病理科, 河北 邢台 054000)
结肠癌是最为常见的消化道恶性肿瘤,其好发于直肠与乙状结肠交界处,发病率占到胃肠道肿瘤的第3位,但其早期症状多不明显,大约20%的病人在获得确诊时肿瘤细胞已发生转移,严重影响结肠癌患者的治疗和预后[1]。同时,随着人们生活水平的提高和饮食结构的改变,结肠癌在我国大部分城市的发病率和死亡率也呈渐上升趋势。因此,对结肠癌进行早期诊治并防止其发生侵袭转移是当前医学的研究重点之一[2]。
NOB1(Nin one binding 1)基因也称为锌带蛋白基因,是一个重要的编码结合蛋白4基因;NOB1的异常表达能够导致蛋白酶体和核糖体的合成异常,进而调节细胞的增殖和凋亡等功能活动[3]。NOB1在人类不同组织器官中均有表达,但表达量各有差异。近年研究发现,NOB1在肿瘤组织中表达量不同于正常组织,其在肝癌、乳腺癌和非小细胞肺癌等恶性肿瘤中呈高表达,而人为敲除NOB1基因能够阻碍肿瘤细胞的增殖生长,提示NOB1参与到肿瘤的发生发展中[4];吴东平等[5]研究发现,NOB1基因在胃癌组织中表达高于边缘胃黏膜,并且NOB1高表达促进胃癌细胞生长转移;同时Misale等[6]发现,NOB1在人类前列腺恶性肿瘤中表达水平升高,其在前列腺癌成瘤过程中起正相关作用;武月等[7]的研究已揭示NOB1在结直肠癌中表达明显高于正常大肠黏膜及息肉中的表达水平,并且NOB1的表达水平与结直肠癌细胞分化程度呈正相关。上述研究均提示NOB1可能在结直肠癌的发生发展中起到重要作用,但关于NOB1具体如何发挥作用及其能否成为抑制并治疗高侵袭性结肠癌疾病的新靶向分子,尚有待进一步研究。因此,本研究利用小干扰RNA(small interfering RNA,siRNA)技术敲减人结肠癌SW480细胞中NOB1基因的表达,并揭示敲减NOB1表达对SW480细胞活力、化疗药物敏感性、凋亡、细胞周期及侵袭和转移能力的影响,以探索NOB1基因能否作为结肠癌诊治的新靶点。
材 料 和 方 法
1 材料和主要试剂
人结肠癌细胞系SW480购自中国科学院上海生命科学研究所。RPMI-1640细胞培养基、胎牛血清和0.25% EDTA胰酶购自Gibco;Lipofectamine 3000脂质体购自Invitrogen;NOB1 siRNA及阴性对照无义siRNA(control siRNA)由上海生工公司合成;RNAiso Plus提取试剂、cDNA逆转录试剂盒和SYBR Green荧光Real-Time PCR试剂盒购自TaKaRa;Transwell小室购自Corning;Matrigel购自Sigma;蛋白提取试剂盒和BCA蛋白浓度测定试剂盒购自北京碧云天公司;多克隆兔抗人NOB1和β-actin抗体购自Abcam;HRP标记多克隆山羊抗兔IgG II抗和ECL化学发光试剂盒购自北京中杉金桥公司。
2 方法
2.1细胞培养及NOB1 siRNA转染 将人结肠癌细胞系SW480细胞复苏后培养于含10%胎牛血清的RPMI-1640培养基中,并置于37 ℃、5% CO2的培养箱中培养。当细胞生长至70%以上后进行消化传代以进行后续实验。取对数生长期的SW480细胞,接种于6孔细胞培养板中,当细胞贴壁生长至80%以上后进行细胞转染。根据GenBank上NOB1基因序列和siRNA设计原则,由上海生工公司设计合成NOB1 siRNA和control siRNA,序列见表1。采用Lipofectamine 3000脂质体进行转染,转染分组为未做任何处理的空白对照组(control组)、control siRNA组和NOB1 siRNA组。在转染24~48 h后收集各组细胞进行后续实验。
2.2Real-time PCR和Western blot检测NOB1 siRNA的沉默效率 在SW480细胞转染24 h后,消化收集各组细胞,利用TRIzol方法提取各组细胞中的总RNA,并按照TaKaRa的逆转录盒逆转录得到各组cDNA。根据人NOB1 cDNA和内参照β-actin序列设计real-time PCR引物(由上海生工公司合成,见表1)。利用Bio-Rad公司的real-time PCR仪检测各组细胞转染前后NOB1基因相对表达量。同时在各组SW480细胞转染24 h后,收集细胞用RAPI强细胞裂解液提取各组细胞中总蛋白。利用BCA试剂盒测定各组蛋白浓度后每组取30 μg总蛋白进行SDS-PAGE。在电泳结束后半干法转PVDF膜,封闭30 min后,4 ℃孵育多克隆兔抗人NOB1和β-actin抗体(1∶1 000)过夜,TBST洗涤3次,室温孵育山羊抗兔IgG II 抗(1∶5 000)2 h,TBST洗涤3次后,利用ECL化学发光法曝光显影并拍照。利用QualityOne软件分析各组细胞中NOB1蛋白相对表达量。
2.3MTT法检测转染后各组SW480细胞活力和不同药物的敏感性 将各转染组的SW480细胞按照每孔1×107/L种植于96孔培养板中,分别在0、12、24、36、48、60和72 h时,每孔中加入20 μL的MTT(5 g/L)溶液,在37 ℃时孵育4 h后弃去上清,每孔中加入150 μL的DMSO混匀10 min后,在酶标仪上测定550 nm处各孔的吸光度(A)值以反映各组细胞的活力。每组细胞设置6个复孔,并进行3次重复实验。按照上述MTT方法对转染后各组SW480细胞对相关药物的敏感性,取转染24 h对数期生长的各组SW480细胞种植于96孔板中,分别加入0.625、1.25、2.5、5、10和20 μmol/L的化疗药物(顺铂、5-氟尿嘧啶、奥沙利铂、卡培他滨)培养24 h后,每孔加入5 g/L的MTT溶液,按照上述方法测定各孔的A值。利用Prism 5.02软件计算每种化疗药物的半数抑制浓度(half maximal inhibitory concentration,IC50)。
2.4流式细胞术检测转染后各组SW480细胞周期分布和细胞凋亡 各组SW480细胞在分别转染培养24 h后,消化离心收集细胞,用预冷的乙醇固定3 h后,每组细胞中加入10 μL的PI避光孵育30 min,结束后用PBS洗1次后,利用BD Caliber 4色流式细胞仪检测各组细胞周期变化。同时,根据上述实验结果将各组转染24 h的SW480细胞,不更换培养基继续连续培养48 h,消化离心收集细胞。分别用5 μL的FITC标记的Annexin V和10 μL的PI室温孵育20 min,后用PBS洗涤2次,上样流式细胞仪检测各组转染后的SW480细胞在DDP作用下的细胞凋亡率变化。
2.5Transwell实验检测转染后各组SW480细胞的侵袭和迁移能力 将各组转染24 h后的SW480细胞调整浓度为1×108/L,用含2%的胎牛血清的RPMI-1640培养基稀释。在各组Transwell板上室膜上均匀涂抹1 g/L的Matrigel 50 μL,置于37 ℃培养箱中30 min,使形成基底膜结构。上述稀释的SW480细胞各取100 μL加入到Transwell上室中,而下室中加入600 μL含10%胎牛血清的培养基,同时设置未转染对照组,每组3个重复。将Transwell板置于37 ℃、5% CO2培养箱中继续培养48 h。培养结束用4%多聚甲醛固定小室滤膜,并用棉签擦去上表面细胞。用结晶紫染色滤膜10 min后PBS洗涤2遍,在显微镜下观察各组穿过滤膜侵袭的细胞,拍照并计算各组SW480细胞侵袭率。侵袭率(%)=各组平均侵袭细胞数/未处理对照组侵袭细胞数×100%。而细胞迁移实验即为上述实验步骤中在Transwell小室中不加入Matrigel,培养时间为24 h,其它步骤同侵袭实验。
3 统计学分析
采用SPSS 13.0软件进行统计学分析。数据以均数±标准误(mean±SEM)表示。多组间数据的比较采用单因素方差分析(one-way ANOVA)及Bonferroni校正后两组间均数比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 NOB1 siRNA转染SW480细胞后NOB1的mRNA和蛋白表达情况
通过real-time PCR和Western blot检测发现,与control组和control siRNA组相比,NOB1 siRNA转染SW480细胞后,细胞中NOB1的mRNA和蛋白表达水平均显著降低(P<0.01),见图1。这说明通过NOB1 siRNA转染能够沉默SW480细胞中NOB1基因表达。

Figure 1.The expression of NOB1 at mRNA (A) and protein (B) levels determined by real-time PCR and Western blot after transfected withNOB1 siRNA. Mean±SEM.n=6.*P<0.05vscontrol group and control siRNA group.
图1Real-timePCR和Westernblot检测NOB1siRNA转染后细胞中NOB1的mRNA和蛋白表达变化
2 NOB1 siRNA转染对SW480细胞活力的影响
MTT法检测发现NOB1 siRNA转染SW480细胞后细胞活力显著下降。在转染12 h时,NOB1 siRNA组SW480细胞的A值与control组和control siRNA组相比差异无统计学显著性;而在转染24~72 h时,NOB1 siRNA组SW480细胞的A值显著低于control组和control siRNA组(P<0.05),见图2。这说明敲减NOB1基因表达对SW480细胞活力具有明显抑制作用。
3 NOB1 siRNA转染SW480细胞对不同化疗药物敏感性的影响
通过MTT法检测发现NOB1 siRNA转染SW480细胞能够显著提高细胞对顺铂、5-氟尿嘧啶、奥沙利铂和卡培他滨等化疗药物的敏感性与control组和control siRNA组相比,顺铂、5-氟尿嘧啶、奥沙利铂和卡培他滨对NOB1 siRNA组SW480细胞的IC50均显著下降(P<0.05),见表2。

Figure 2.The viability of SW480 cells after transfection with NOB1 siRNA were detected by MTT assay. Mean±SEM.n=6.*P<0.05vscontrol group and control siRNA group.
图2MTT检测NOB1siRNA转染后SW480细胞活力的变化
表2NOB1siRNA转染SW480细胞对不同化疗药物敏感性IC50的影响
Table 2.The effect ofNOB1 siRNA transfection on the IC50of different chemotherapeutic agents for SW480 cells (μmol/L. Mean±SEM.n=6)

GroupCisplatin5-fluorouracilOxaliplatinCapecitabineControl6.35±0.257.14±0.4713.21±0.429.45±0.38Control siRNA6.11±0.317.05±0.3512.96±0.459.13±0.29NOB1 siRNA3.02±0.22∗5.18±0.33∗4.36±0.29∗6.96±0.17∗
*P<0.05vscontrol group and control siRNA group.
4 NOB1 siRNA转染对SW480细胞凋亡的影响
流式细胞术检测发现NOB1 siRNA转染SW480细胞能够显著促进细胞凋亡。与control组和control siRNA组相比,NOB1 siRNA转染SW480细胞后细胞凋亡率显著上升(P<0.05),见图3。
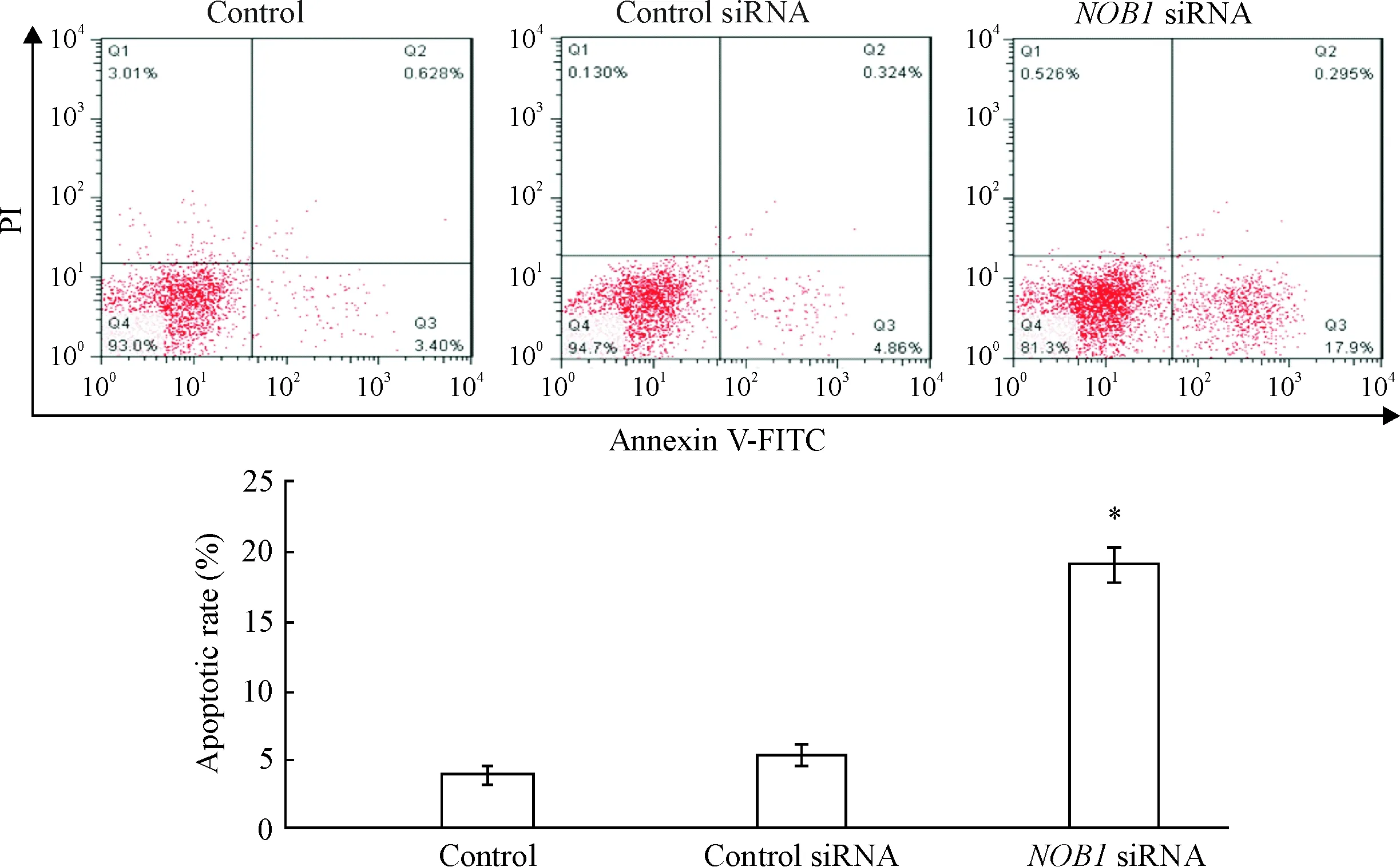
Figure 3.Flow cytometry was used to detect the apoptosis of SW480 cells after transfection withNOB1 siRNA. Mean±SEM.n=6.*P<0.05vscontrol group and control siRNA group.
图3流式细胞术检测NOB1siRNA转染后SW480细胞凋亡的变化
5 NOB1 siRNA转染对SW480细胞周期的影响
流式细胞术检测发现NOB1 siRNA转染SW480细胞能够阻滞其细胞周期于G0/G1期。与control组和control siRNA组相比,NOB1 siRNA组G0/G1期比值显著上升(P<0.05);与control组和control siRNA组相比,NOB1 siRNA组S期比值显著下降(P<0.05);与control组和control siRNA组的G2期比值相比,NOB1 siRNA组G2期比值显著下降(P<0.05),见图4。

Figure 4.Flow cytometry was used to detect the changes of cell cycle distribution in the SW480 cells after transfection withNOB1 siRNA. Mean±SEM.n=6.*P<0.05vscontrol group and control siRNA group.
图4流式细胞术检测NOB1siRNA转染后SW480细胞周期的变化
6 NOB1 siRNA转染后对SW480细胞侵袭和迁移能力的影响
Transwell实验检测发现NOB1 siRNA转染能够显著抑制SW480细胞侵袭和迁移能力。与control组和control siRNA组细胞相比,NOB1 siRNA组SW480细胞的侵袭率显著下降(P<0.05);与control组和control siRNA组细胞相比,NOB1 siRNA组SW480细胞的迁移率显著下降(P<0.05),见图5。
讨 论
结肠癌作为人类常见的恶性消化道肿瘤之一,其具有易复发、转移且死亡率高的特点[8]。近年结肠癌在我国的发病率逐年上升,晚期患者容易发生耐药性导致生存率降低,但其作用机制尚未完全研究清楚,因此,针对结肠癌增殖、侵袭转移和耐药性的研究一直是临床研究中的热点[9]。NOB1基因是一个新发现的核蛋白基因,已有研究确定NOB1对基因转录调控起重要作用,其在多种恶性肿瘤的癌变信号通路传导中发挥功能,并与多种恶性肿瘤发生发展密切相关[10]。武月等[7]利用免疫组化技术检测了多例结直肠癌组织和正常结直肠黏膜组织中NOB1表达特征,发现NOB1蛋白在结直肠癌组织中表达率显著升高,并且与结直肠癌细胞分化程度呈正相关。为进一步研究NOB1基因如何在结直肠癌发生发展中发挥作用,我们成功利用siRNA技术敲减结肠癌SW480细胞中NOB1基因表达,并利用MTT方法检测发现敲减NOB1表达后,SW480细胞活力显著下降。本研究中结果与Lin等[11]在卵巢癌、乳腺癌和食管鳞状细胞癌中所发现NOB1低表达能够有效抑制肿瘤细胞增殖的结论相一致。
据临床统计确诊为结肠癌的病人中,有20%~30%的患者已经是IV期,仅靠手术无法完全根治,而需要化学药物进行化疗[12]。同时研究表明消化道肿瘤中,结肠癌较胃癌具有强的多药耐药性,而结肠癌细胞对一般化疗药物的敏感性降低会严重影响其治愈率和复发性[13]。研究发现NOB1基因在C端编码一个保守的锌带结构域,而锌带结构域在ZNRD1等肿瘤耐药性相关的转录分子中均存在,因此推测NOB1基因在肿瘤细胞多药耐药性中发挥作用[14]。同时已有研究表明抑制NOB1表达可以显著改善食管癌的药物敏感性,其对多药耐药性的调控作用可成为新的基因疗法[15]。本研究首次发现,siRNA技术抑制结肠癌SW480细胞中NOB1基因表达后,其对5-氟尿嘧啶、顺铂、奥沙利铂和卡培他滨等常规化疗药物的半数致死浓度均显著降低,证实抑制NOB1表达能够提高结肠癌细胞对化疗药物的敏感性,其可能成为未来结肠癌潜在治疗手段之一。

Figure 5.The invasion and migration abilities of SW480 cells after transfection withNOB1 siRNA detected by Transwell assays. Mean±SEM.n=6.*P<0.05vscontrol group and control siRNA group.
图5Transwell检测NOB1siRNA转染后SW480细胞侵袭和迁移能力的变化
上述研究已证实NOB1基因在结肠癌的病理进展中发挥重要作用,但关于其能否成为结肠癌新的基因诊断和治疗靶点尚未见。有研究发现NOB1在真核生物核糖体26S蛋白酶的合成和20S蛋白酶成熟中扮演重要的角色,而26S蛋白酶会影响到肿瘤细胞的发生发展[16]。NOB1高表达可促进26S蛋白酶的合成和20S蛋白酶成熟,进而促进肿瘤细胞增殖并抑制凋亡[17].。为了具体揭示NOB1如何影响结肠癌细胞相关功能,本研究利用流式细胞术检测发现,结肠癌SW480细胞中抑制NOB1表达后,肿瘤细胞凋亡率会显著上升,说明NOB1低表达可促进结肠癌细胞凋亡。细胞增殖和凋亡均受到细胞周期的影响,当细胞周期受到阻滞后会影响其增殖活力和凋亡能力,而细胞周期中G0+G1期细胞对凋亡信号更为敏感[18]。同时本研究也利用流式细胞术检测了敲减NOB1表达后结肠癌SW480细胞的周期变化,结果表明其能够阻滞细胞周期于G0/G1期,说明NOB1能够通过抑制细胞周期来调控结肠癌细胞增殖和凋亡。肿瘤患者是否容易复发及预后与癌细胞侵袭和转移能力密切相关。有研究显示NOB1表达与食管鳞状细胞癌的转移侵袭能力相关,但其如何影响结肠癌细胞侵袭和转移尚未知[19]。本研究中同时利用Transwell方法检测发现敲减NOB1表达后SW480细胞相对侵袭率和转移率均显著降低,证实NOB1低表达可抑制结肠癌侵袭和转移能力,其对于晚期结肠癌病人治疗和预后具有重要意义。
综上所述,本研究证实NOB1参与了结肠癌细胞的发生发展,用siRNA沉默NOB1表达可抑制结肠癌细胞增殖、侵袭及转移并促进结肠癌细胞凋亡和药物敏感性。NOB1可能是一个结肠癌肿瘤标志物或促癌蛋白,在结肠癌分子靶向治疗中具有较好的临床价值。
