miR-139-3p在低氧诱导凋亡的心肌细胞中的表达及其作用研究*
2019-04-22杨晓敏屈双丽王占黎
于 慧, 杨晓敏, 屈双丽, 秦 磊, 冯 月, 王占黎, 孙 刚△
(包头医学院第二附属医院 1高血压研究所, 2检验科, 内蒙古 包头 014030; 3天津市宁河区医院心内科, 天津 301504; 4包头医学院研究生学院, 内蒙古 包头 014040)
心血管疾病严重危害人类健康。心肌肥大是许多心血管疾病终末期共同的病理生理表现,也是导致慢性心力衰竭的主要原因之一[1]。研究显示,心肌细胞凋亡在心力衰竭的发生、发展过程中扮演着关键作用,可能是引起心力衰竭的主要原因之一[2];体内实验表明,抑制心肌细胞凋亡可以改善心脏收缩功能[3]。与正常心肌细胞相比,肥大心肌细胞凋亡率显著增高,且对凋亡刺激因子的敏感性增加。心脏肥大细胞通过脱颗粒作用,释放多种炎症介质,直接参与心肌凋亡的过程[4]。以往研究显示,p38 MAPK在肥大心肌细胞凋亡的信号转导途径中起关键作用[5-7]。Budak等[5]证实,抑制p38 MAPK能显著上调Bcl-2蛋白的表达,进而抑制肥大心肌细胞凋亡。
微小RNA(microRNAs, miRNAs, miR)是一类长度约19~24个核苷酸分子组成的内源性非编码小分子RNA, 通过特异性结合靶基因mRNA的3′-端非翻译区,抑制靶基因mRNA 的翻译或促进其降解,从而发挥基因调控作用[8]。miR-139-3p是miR-139家族的主要成员之一,该家族在肿瘤细胞增殖和侵袭的调控中起关键作用[9-10]。研究证实,miR-139-3p在多种肿瘤中差异表达,并参与了细胞凋亡的病理生理过程[11]。本课题组首次检测到,在两肾一夹高血压大鼠心肌组织中miR-139-3p表达上调[12]。但是,miR-139-3p在肥大心肌细胞中的表达情况及其是否与心肌细胞凋亡相关,目前尚不完全清楚。本研究通过建立低氧诱导原代心肌细胞凋亡模型,观察miR-139-3p的表达情况,并探讨其与心肌细胞凋亡的关系。
材 料 和 方 法
1 实验动物及主要仪器试剂
高糖DMEM培养液、胎牛血清、II型胶原酶和5-溴-2′-脱氧尿苷(5-bromo-2′-deoxyuridine,BrdU)购自Gibco;缺氧盒购自日本三菱公司;MirVana miRNA提取试剂盒、TaqMan MicroRNA Reverse Transcription逆转录试剂盒、TaqMan Universal PCR Master Mix II扩增试剂盒、miR-139-3p引物 (002546)和U6 snRNA引物(001973)购自Applied Biosystems;Wistar乳大鼠(出生1~3 d)购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2012-0001];Annexin V-FITC细胞凋亡检测试剂盒购自BD;兔抗大鼠cleaved caspase-3 Ⅰ抗购自Cell Signaling Technology;兔抗大鼠GAPDH Ⅰ抗购于杭州贤至生物科技有限公司;山羊抗兔Ⅱ抗购自北京中杉金桥生物技术有限公司;miR-139-3p抑制剂(micrOFFTMrno-miR-139-3p inhibitor)和miR-139-3p抑制剂阴性对照(micrOFFTMinhibitor negative control)由广州锐博生物科技有限公司合成。XRS+化学发光凝胶成像仪购自BIO-RAD;ABI7500实时荧光定量PCR仪购自Applied Biosystems。
2 方法
2.1细胞凋亡模型制备及实验分组 参照Drawnel等[13]的方法,取1~3 日龄Wistar乳大鼠,无菌操作取出心脏以无血清DMEM高糖培养液洗3次,并剪成1 mm×1 mm×1 mm组织块。使用0.6 g/L II型胶原酶5 mL消化10 min,37 ℃水浴中共消化7次,弃去首次消化液,以含20%胎牛血清的DMEM高糖培养液终止消化。收集细胞悬液,1 000×g离心10 min, 吸出上清液,加入含10%胎牛血清的DMEM高糖培养液,经200目细胞筛网过滤后,置于37 ℃、5% CO2培养箱中差速贴壁90 min。细胞上清液以约5×108/L细胞密度接种于6孔板中。加入0.1 mmol/L BrdU抑制成纤维细胞生长,24 h后换液。参照文献报道[14],通过低氧诱导方法建立新生大鼠原代心肌细胞凋亡模型。心肌细胞培养48 h后,将细胞分为低氧(hypoxia)组和正常培养(normal control)组,每组设置3个平行孔。低氧组细胞置于37 ℃密闭的缺氧盒中(95% N2和 5% CO2)培养12 h,正常培养组细胞于37 ℃、5% CO2培养箱中培养12 h。
2.2心肌细胞凋亡的检测 各组细胞造模后(每组3个平行孔),使用流式细胞仪检测心肌细胞凋亡率,使用Annexin V-FITC细胞凋亡检测试剂盒(BD Pharmingen),按照试剂说明书进行操作。使用PBS洗涤2次,消化收集细胞后,加入100 μL binding buffer缓冲液重悬细胞,每个培养孔细胞均制成1×109/L的细胞悬液,再加入5 μL Annexin V-FITC和5 μL PI混匀,室温避光孵育15 min,再加入400 μL binding buffer缓冲液混匀后,使用流式细胞仪 (Canto II, BD) 检测分析。此外各组细胞(每组3个平行孔)造模后,通过Western blot检测凋亡模型中cleaved caspase-3的表达,使用M-PER哺乳动物细胞总蛋白抽提试剂盒(Thermo)抽提每孔细胞总蛋白,SDS-PAGE后,PVDF膜湿转(100 V,90 min),5%脱脂奶粉封闭2 h,分别加入兔抗大鼠cleaved caspase-3抗体(1∶1 000)和兔抗大鼠GAPDH抗体(1∶1 000),4 ℃孵育过夜。TBST洗膜3次,每次10 min;加入山羊抗兔Ⅰ抗(1∶4 000)室温孵育2 h后,TBST洗膜3次,每次10 min。ECL化学发光显色,使用化学发光凝胶成像仪检测目的条带,采用Bio-Rad Image LabTM软件分析结果,以目的蛋白与GAPDH内参照的比值表示蛋白相对表达量。
2.3RT-qPCR检测miR-139-3p的表达 各组细胞造模后(每组3个平行孔),使用PBS洗涤2次,采用MirVana miRNA提取试剂盒提取每个培养孔细胞总miRNAs,按产品说明书步骤操作。使用TU1900紫外分光光度计检测miRNAs的纯度和浓度,紫外分光光度计检测抽提得到的miRNAs的A260/A280为1.9,使用相对定量比较Ct法对miR-139-3p的表达水平进行定量分析。采用TaqMan MicroRNA Reverse Transcription逆转录试剂盒将miRNAs逆转录为cDNA,按产品说明书步骤操作,采用15 μL反应体系:dNTP mix 0.15 μL;MultiscribeTMRT enzyme 1.0 μL;10×RT buffer 1.5 μL;RNase Inhibitor 0.19 μL;Nuclease free water 4.16 μL;RT primer 3 μL;miRNA样品5 μL (10 ng)。反应条件:16 ℃ 30 min; 42 ℃ 30 min; 85 ℃ 5 min。逆转录产物的实时荧光定量扩增采用TaqMan Universal PCR Master Mix II 试剂盒,以U6 snRNA为内参照(Applied Biosystems)。扩增效率一致性实验采用5个倍比稀释的逆转录产物cDNA(最高浓度的cDNA样本为1 ng microRNA逆转录产物),以cDNA浓度稀释度作为横坐标,ΔCt(miR-139-3p Ct值-内参照U6 snRNA Ct值)为纵坐标,绘制关系曲线,数据采用线性回归分析,结果显示,直线斜率的绝对值为0.009,接近于0,说明目的基因与内参照基因的扩增效率一致性好,见图1。实时荧光定量扩增采用20 μL反应体系:2×TaqMan Universal Master Mix II 10 μL;miR-139-3p 或U6 snRNA探针引物20×TaqMan Assay 1.0 μL;cDNA模板与dH2O共9 μL(cDNA模板约为100 ng)。反应条件按产品说明书步骤操作,每个反应设3个复孔。相对定量反应结果采用2-ΔΔCt方法分析[15]。

Figure 1.A plot of cDNA dilution ratio versus ΔCt in RT-qPCR.
图1RT-qPCR中cDNA稀释度与ΔCt的关系曲线
2.4miR-139-3p抑制剂转染 心肌细胞培养48 h后,将细胞分为miR-139-3p抑制剂组(miR-139-3p inhibitor)和miR-139-3p抑制剂阴性对照组(negative control),每组设置3个平行孔。miR-139-3p抑制剂组,应用Lipofectamine 3000 (Opti-MEM配制)转染miR-139-3p抑制剂,置于37 ℃密闭的缺氧盒中(95% N2和 5% CO2)继续培养12 h; miR-139-3p抑制剂阴性对照组转染miR-139-3p抑制剂阴性对照,置于37 ℃密闭的缺氧盒中(95% N2和 5% CO2)继续培养12 h。各组细胞给药造模后,采用流式细胞术和Western blot实验检测细胞凋亡情况(具体实验操作方法同上)。
3 统计学方法
使用统计软件SPSS 17.0进行统计学处理。计量资料以均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 原代心肌细胞的形态观察
心肌细胞培养24 h后,呈贴壁生长,可见少数细胞开始搏动,但搏动微弱,且节律不规则。48 h后观察到心肌细胞呈梭形或多边形,有伪足伸出,细胞之间可以相互接触交织成网,多数心肌细胞出现自发性节律性搏动,见图2。

Figure 2.Micrograph of cultured rat neonatal cardiomyocytes after 48 h.
图2培养48h后的原代心肌细胞形态
2 流式细胞术检测心肌细胞凋亡情况
低氧诱导12 h后,流式细胞术结果显示,与正常培养组比较,低氧组心肌细胞凋亡率显著升高(P<0.05),见图3。
3 Western blot检测凋亡模型中cleaved caspase-3表达
低氧诱导12 h后,采用Western blot检测凋亡模型中cleaved caspase-3的表达。结果显示,与正常培养组相比,低氧组细胞中凋亡蛋白cleaved caspase-3表达显著升高(P<0.05),见图4。
4 低氧培养对miR-139-3p表达的影响
以RT-qPCR方法检测miR-139-3p的表达情况。结果显示,低氧培养12 h后,与正常培养组比较,低氧组心肌细胞中miR-139-3p的表达水平显著上升(P<0.05),见图5。

Figure 3.The apoptosis rate of cardiomyocytes detected by flow cytometry. Mean±SD.n=3.*P<0.05vsnormal control group.
图3流式细胞术检测心肌细胞凋亡率

Figure 4.The expression of cleaved caspase-3 detected by Western blot. Mean±SD.n=3.*P<0.05vsnormal control group.
图4Westernblot检测cleavedcaspase-3的表达情况
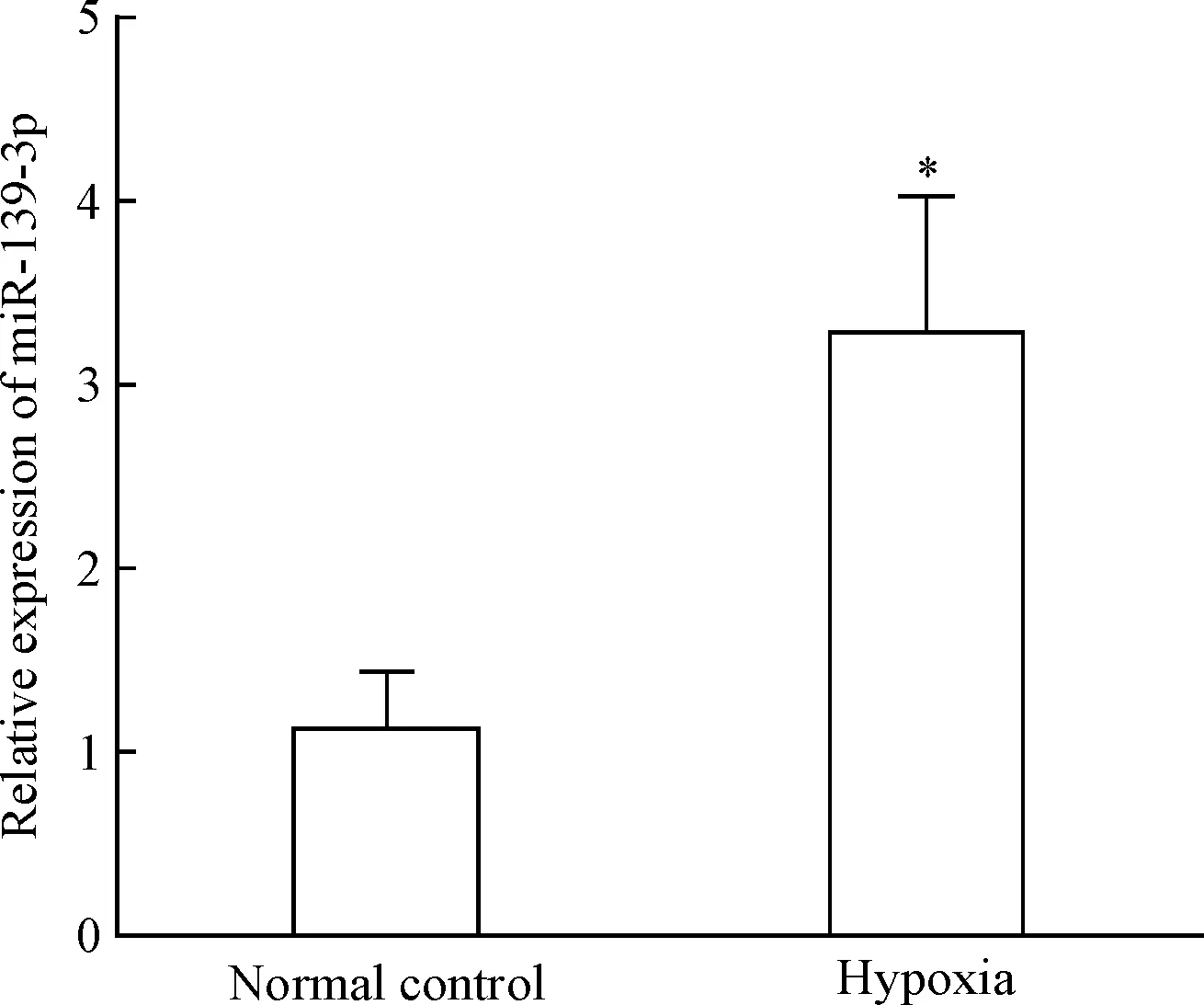
Figure 5.The relative expression of miR-139-3p detected by RT-qPCR. Mean±SD.n=3.*P<0.05vsnormal control group.
图5RT-qPCR检测miR-139-3p的表达情况
5 miR-139-3p抑制剂转染后原代心肌细胞凋亡水平的变化
低氧诱导12 h后,流式细胞结果显示,与miR-139-3p抑制剂阴性对照组相比, miR-139-3p抑制剂组心肌细胞凋亡率显著降低(P<0.05),见图6。

Figure 6.miR-139-3p inhibitor decreased the apoptosis rate of cardiomyocytes. Mean±SD.n=3.*P<0.05vsnegative control group.
图6miR-139-3p抑制剂转染后心肌细胞凋亡率的变化
Western blot结果显示,miR-139-3p抑制剂组凋亡蛋白cleaved caspase-3表达也显著降低(P<0.05),见图7。
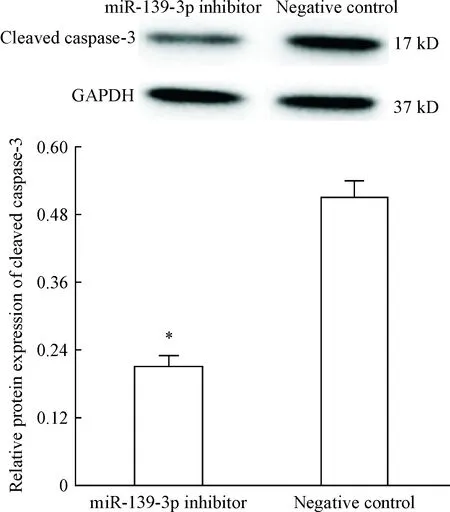
Figure 7.miR-139-3p inhibitor decreased the expression of cleaved caspase-3. Mean±SD.n=3.*P<0.05vsnegative control group.
图7miR-139-3p抑制剂转染后cleavedcaspase-3的表达情况
讨 论
miR-139位于11号染色体PDE2A基因的第2外显子上,在乳腺癌、胃癌、肝细胞癌和结肠癌等多种肿瘤细胞中异常表达[16-19],进而参与调控肿瘤细胞的增殖、侵袭和转移[20-21]。课题组前期研究观察到,miR-139-3p在两肾一夹高血压大鼠心肌组织中表达显著上调,推测其可能参与了高血压大鼠心肌肥厚的病理过程。信号通路分析软件IPA(经典通路数据库)分析显示,MAPK1是miR-139-3p的靶基因之一[12],Budak等[5]进一步通过实验证实了这一结论。已知MAPK1与心肌细胞凋亡关系密切,因此,推测miR-139-3p可能与心肌细胞凋亡相关。针对miR-139-3p表达调控机制,过去的研究大多围绕着肿瘤等疾病。Huang等[22]的研究显示,miR-139-3p能通过下调NOB1基因表达来显著诱导宫颈癌细胞凋亡。但miR-139-3p与心肌细胞凋亡的关系,尚不清楚。
为了证实这一推测,本实验构建了原代心肌细胞的凋亡模型。目前,低氧诱导的心肌细胞凋亡模型已被广泛应用。Tanaka 等[23]在体外培养的新生大鼠心肌细胞中观察,在不更换细胞培养液的情况下低氧诱导12 h即可出现心肌细胞凋亡,并且随着低氧时间的延长逐渐加重。本实验结果也证实,低氧诱导心肌细胞凋亡,且促进cleaved caspase-3蛋白的表达。Cleaved caspase-3蛋白为caspase-3蛋白相对分子量约为17 kD的活性亚单位,一般认为,当细胞被凋亡信号激活时,无活性的caspase-3酶原被裂解为有活性的cleaved caspase-3,标志着凋亡过程进入到不可逆转阶段[24]。上述结果表明,通过低氧诱导的方法成功地建立了原代心肌细胞凋亡模型。
本实验采用RT-qPCR方法检测miR-139-3p的表达水平,观察到低氧组心肌细胞中miR-139-3p表达上调,抑制miR-139-3p表达能降低低氧诱导的心肌细胞凋亡及cleaved caspase-3的表达,提示miR-139-3p可能与心肌细胞凋亡有关。近期Diaz等[25]的研究显示,在Wistar 大鼠心肌缺血再灌注损伤模型中,miR-139-3p的表达水平显著增高,尿皮质素多肽(Urocortin)能通过下调miR-139-3p的表达水平发挥其对缺血再灌注心肌的保护作用,推测miR-139-3p的异常表达可能通过下调FoxO1等因子的表达参与了心肌缺血再灌注损伤中细胞凋亡过程。本研究中,miR-139-3p在低氧诱导心肌细胞凋亡模型中表达水平显著升高,miR-139-3p的表达被抑制后,心肌细胞的凋亡率也明显下降,这一结果也在一定程度上证实了Diaz等[25]的研究推测。本研究着重探讨了miR-139-3p与心肌细胞凋亡的关系及可能机制,所获结果有助于阐明心肌细胞凋亡的分子机制。但低氧诱导是否会引起心肌细胞的细胞周期变化和凋亡相关基因bcl-2、bax和FoxO1的表达,以及miR-139-3p如何通过调控靶基因影响心肌细胞凋亡等,这些问题还有待今后进一步深入研究。
