HMGA2在胃癌细胞上皮-间充质转化中的作用*
2019-04-22符亮,潘锐,陈钊
符 亮, 潘 锐, 陈 钊
(三亚市人民医院消化内科, 海南 三亚 572000)
胃癌是常见的恶性肿瘤之一,严重威胁着人类的健康和生存质量。临床上,胃癌转移是导致胃癌患者治疗失败和不良预后的主要因素之一[1]。近年来的研究证实,上皮-间充质转化(epithelial-mesenchymal transition,EMT)参与多种肿瘤的转移过程,肿瘤细胞发生EMT的典型特点是上皮细胞表型缺失,其上皮标志蛋白上皮型钙黏蛋白(E-cadherin)的表达降低,失去极性,并且表现出间质细胞的特性,间质标志蛋白神经型钙黏蛋白(N-cadherin)和波形蛋白(vimentin)的表达增加[2]。
高迁移率族蛋白(high-mobility group protein,HMG)是在真核生物中广泛存在的一类染色质相关蛋白,主要包括HMGA、HMGB和HMGN家族成员。HMGA2是HMGA家族成员之一,在胚胎期及分化程度低的组织中大量表达,而在分化程度高的组织中几乎不表达[3]。在胃癌组织中,HMGA2呈现高表达状态,并且与胃癌患者的不良预后密切相关[4-5],但具体机制尚有待进一步探讨。本研究探讨胃癌细胞EMT过程中,HMGA2的作用及可能机制。
材 料 和 方 法
1 材料
人胃癌细胞株MKN45(低分化)、MKN28(高分化)和SGC7901(中分化)以及人永生化胃黏膜上皮细胞株GES-1购自中国上海科学院细胞库;脂质体Lipofectamine®3000(Invitrogen);HMGA2 siRNA(si-HMGA2)和siRNA阳性对照(siRNA negative control,si-NC)由上海生工生物工程技术服务有限公司合成;TRIzol(Thermo);RNA提取试剂盒(Invitrogen);紫外分光光度计(Thermo);逆转录试剂盒(大连宝生物工程有限公司);RT-qPCR引物由上海生工生物工程股份有限公司合成;定量PCR扩增仪(ABI 7500,Applied Biosystems);RIPA蛋白裂解液(上海碧云天生物技术有限公司);BCA蛋白定量试剂盒(Thermo);兔抗人HMGA2多克隆抗体(ab97276)、兔抗人E-cadherin单克隆抗体(ab11512)、兔抗人vimentin多克隆抗体(ab92547)和兔抗人N-cadherin单克隆抗体(ab18203)均购自Abcam;兔抗人GAPDH单克隆抗体(sc-367714,Santa); HRP标记的羊抗鼠 II 抗(上海英基生物科技有限公司);CCK-8试剂(上海翊圣生物科技有限公司);ECL发光液(Millipore)。凝胶成像仪(GelDoc-It,UVP);显微镜(BX61,Olympus)。
2 方法
2.1细胞培养 4种细胞株均培养于含10% 胎牛血清的RPMI-1640培养基中(青霉素1×105U/L,链霉素100 mg/L),37 ℃、5% CO2条件下中培养,细胞融合度值80%~90%时,进行消化传代。
2.2脂质体转染 聚合酶链式反应(polymerase chain reaction,PCR)扩增HMGA2基因编码区(NM_001300918.1),BamH I和EcoR I酶切后,插入pcDNA3.0真核表达载体,经酶切、PCR和测序鉴定,构建pcDNA3.0-HMGA2表达载体。取4×105个处于对数生长期的MKN28细胞,接种于3.5 cm培养皿中,24 h后,采用脂质体Lipofectamine®3000将pcDNA3.0-HMGA2及空载体对照pcDNA3.0-empty分别转染至MKN28细胞中,操作步骤参照试剂说明书。
取4×105个处于对数生长期的MKN45细胞,接种于3.5 cm培养皿中,24 h后,采用脂质体Lipofectamine®3000将si-HMGA2(见表1)及si-NC(阴性对照组)分别转染至MKN45细胞中,操作步骤参照试剂说明书。
2.3RT-qPCR实验 收集1×105细胞,各细胞样品中加入1 mL TRIzol,抽提细胞总RNA,按照RNA提取试剂盒的说明书操作。紫外分光光度计检测总RNA浓度及纯度(A260/A280),逆转录试剂盒进行逆转录。HMGA2、E-cadherin、N-cadherin、vimentin、β-catenin、c-Myc、Cyclin D1及内参照GAPDH的RT-qPCR引物序列见表1。定量PCR扩增仪检测各目的基因的mRNA表达水平。qPCR扩增体系为10 μL,反应条件为:50 ℃ 2 min;95 ℃ 10 min、95 ℃ 15 s、60 ℃ 1 min,进行35个循环。采用2-ΔΔCt方法表示各目的基因的相对表达量,实验重复3次后,进行统计分析。

表1 si-HMGA2序列及RT-qPCR引物序列
2.4Western blot实验 收集(2~5)×105个细胞,加入RIPA蛋白裂解液,抽提细胞全蛋白,BCA蛋白定量试剂盒检测蛋白浓度。10% SDS-PAGE分离蛋白后,湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温震荡封闭1 h,TBS-T洗膜,加入Ⅰ抗[兔抗人HMGA2多克隆抗体(1 ∶1 000稀释)、兔抗人E-cadherin单克隆抗体(1 ∶1 000稀释)、兔抗人vimentin多克隆抗体(1 ∶1 000稀释)、兔抗人N-cadherin单克隆抗体(1∶1 000稀释)和兔抗人GAPDH单克隆抗体(1∶2 000稀释)],4 ℃孵育过夜。TBS-T洗膜后,加入HRP标记的羊抗鼠II 抗(1 ∶10 000稀释),室温孵育1 h,加ECL发光液进行化学发光显影,凝胶成像仪对蛋白条带进行观察,获取图像,并对图像进行灰度分析(Image Lab软件),计算目的蛋白与内参蛋白的灰度比值。
2.5细胞划痕实验(would healing assay) 取对数生长期细胞(5~7)×105个,接种于6孔板中,24 h后,细胞汇合度达90%以上;使用移液器枪头,垂直于6孔板底部,均匀划线,每孔3条平行线;PBS洗涤3次,去除漂浮的细胞,加入无血清RPMI-1640培养基,37 ℃、5% CO2培养箱中正常培养,分别于0 h和24 h时在显微镜下拍照,并计算细胞间距离。重复3次独立实验后,进行统计分析。
2.6细胞侵袭实验(Transwell assay) 24孔板中放置Transwell小室,在小室上层加入4.0 g/L Matrigel 50 μL,37 ℃、5% CO2培养箱中过夜,使Matrigel凝固;在24孔板下室中加入500 μL的含10% FBS的RPMI-1640培养液,Transwell小室中加入100 μL的各实验组细胞悬液(细胞总数约1×105个);48 h后,去除24孔板下室中的培养液,棉签擦去Transwell小室内室膜上的细胞,0.1%结晶紫溶液染色,室温5 min,显微镜下观察,每孔随机选取3个视野拍照,并记录每个视野的细胞数目。实验重复3次后,进行统计分析。
2.7细胞存活实验 处于对数生长期的各实验组细胞,接种于96孔板中,每孔接种(0.8~1)×104个细胞,设置3个复孔,继续培养48 h。弃去上清,加入CCK-8试剂,继续培养4 h,测定450 nm波长的吸光度(A)值。进行3次独立实验后,进行统计分析。
3 统计学分析
采用SPSS 17.0统计软件分析。计量资料以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,多重比较采用经Bonferroni法校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 胃癌细胞和胃黏膜上皮细胞中HMGA2的表达水平
RT-qPCR和Western blot 结果显示,HMGA2在低分化的MKN45胃癌细胞中表达水平最高,而在永生化的GES-1胃黏膜上皮细胞中表达水平最低(P<0.05),见图1。
2 转染效率的测定
RT-qPCR和Western blot结果显示,在MKN28细胞中,与空白对照(MKN28-control)组和空载体(MKN28-empty)组相比,HMGA2过表达(MKN28-HMGA2)组细胞中HMGA2的mRNA和蛋白水平均显著升高(P<0.05),而空白对照组和空载体组之间的差异无统计学显著性,见图2A、B。在MKN45细胞中,与空白对照(MKN45-control)组和阴性对照(MKN45-NC)组相比,HMGA2干扰(MKN45-si-HMGA2)组HMGA2的mRNA和蛋白水平均显著降低(P<0.05),而空白对照组和阴性对照组比较差异无统计学意义,见图2C、D。
3 HMGA2表达水平对胃癌细胞活力的影响
CCK-8实验结果显示,与MKN28-control组和MKN28-empty组相比,MKN28-HMGA2组的细胞活力在第4天和第5天均显著下降(P<0.05),见图3A;与此同时,与MKN45-control组和MKN45-NC组相比,MKN45-si-HMGA2组的细胞活力在第3天、第4天和第5天均显著增加(P<0.05),见图3B。

Figure 1.The expression of HMGA2 at mRNA (A) and protein (B) levels in the gastric cancer cell lines and gastric epithelial cell line. Mean±SD.n=3.*P<0.05vsMKN28, SGC7901 and GES-1 cells;#P<0.05vsMKN45, MKN28 and SGC7901 cells.
图1胃癌细胞和胃黏膜上皮细胞中HMGA2的表达水平

Figure 2.The transfection efficiency of liposomes in the MKN28 (A and B) and MKN45 cells (C and D). Mean±SD.n=3.*P<0.05vsMKN28-control group and MKN28-empty group;#P<0.05vsMKN45-control group and MKU45-NC group.
图2脂质体转染MKN28及MKN45细胞的效率测定

Figure 3.The effects of HMGA2 up- or down-regulation on the viability of MKN28 cells (A) and MKN45 cells (B). Mean±SD.n=3.*P<0.05vsMKN28-control group and MKN28-empty group;#P<0.05vsMKN45-control group and MKN45-NC group.
图3上调或下调HMGA2对MKN28和MKN45细胞活力的影响
4 HMGA2过表达对胃癌细胞迁移和侵袭能力的影响
划痕和侵袭小室实验结果显示,MKN28-HMGA2组的迁移和侵袭能力均显著高于空白对照组和空载体组(P<0.05),见图4。
5 HMGA2对胃癌细胞EMT相关标志蛋白表达的影响
Western blot结果显示,MKN28-HMGA2组细胞中E-cadherin的蛋白表达量相对于MKN28-control组和MKN28-empty组均明显降低(P<0.05),而N-cadherin及vimentin的蛋白表达水平均明显升高(P<0.05);E-cadherin、N-cadherin及vimentin的蛋白表达水平在MKN28-control组和MKN28-empty组之间比较的差异无统计学显著性,见图5A。
在MKN45-si-HMGA2组的细胞中,E-cadherin蛋白的表达量相对于MKN45-control组和MKN45-NC组均明显增加(P<0.05),而N-cadherin及vimentin蛋白的表达水平明显降低(P<0.05);E-cadherin、N-cadherin及vimentin蛋白表达水平在MKN45-control组和MKN28-NC组之间的差异无统计学显著性,见图5B。
6 HMGA2过表达对胃癌细胞Wnt/β-catenin通路相关分子mRNA表达的影响
RT-qPCR结果显示,β-catenin的mRNA相对表达水平在MKN28-control组和MKN28-empty组之间比较差异无统计学显著性,而MKN28-HMGA2组较这2组均明显增加(P<0.05);MKN28-HMGA2组c-Myc的mRNA相对表达水平较MKN28-control组和MKN28-empty组有明显增加(P<0.05),后2组之间比较差异无统计学显著性;MKN28-HMGA2组cyclin D1的mRNA相对表达水平较MKN28-control组和MKN28-empty组明显增加(P<0.05),后2组之间比较差异无统计学显著性,见图6。
讨 论
胃癌是死亡率仅次于肝癌和肺癌的恶性肿瘤之一,我国每年新发胃癌病例数约占全球每年新发病例数的41%,且每年因胃癌死亡人数约占全球因胃癌死亡人数的35%[6]。目前临床上胃癌的治疗采用的是以手术为主,化疗、放疗、分子靶向治疗以及免疫治疗相结合的综合治疗方案。
EMT在多种生理病理过程中发挥着关键作用,如胚胎形成、伤口愈合以及肿瘤转移等[7];此外,EMT在膀胱癌[8]和非小细胞肺癌[9]等多种肿瘤的转移中也发挥着极其重要的作用。上皮细胞发生EMT时,细胞失去极性,并出现间充质细胞的表型,表现出更强的移动性,然而诱导细胞发生EMT的具体分子机制仍未完全明确。HMGA2最早是在间充质来源的肿瘤中发现的[10],作为一种转录因子,在多种恶性肿瘤的发生发展中发挥作用,因此,HMGA2与肿瘤发生转移过程中的EMT有关。事实上,多项研究也证实了此观点,如HMGA2参与了前列腺癌[11]、乳腺癌[12]和直肠癌[13]等肿瘤的侵袭和转移。
本研究比较了不同分化程度的胃癌细胞和胃黏膜上皮细胞中HMGA2的表达水平,发现在低分化的胃癌MKN45细胞中,HMGA2的表达水平最高,而在永生化胃黏膜上皮GES-1细胞中,HMGA2表达水平最低。在MKN28细胞内过量表达HMGA2后,细胞的活力显著下降,而在MKN45细胞内干扰HMGA2的表达后,明显提高了细胞的活力。以上结果说明,HMGA2在胃癌细胞中可能参与了细胞生长的调控,并可能存在负相关的联系。进一步研究发现,HMGA2过量表达之后,MKN28细胞的迁移和侵袭能力显著增强,以上实验结果表明,HMGA2的高表达能够促进胃癌细胞发生迁移和侵袭。Zhang等[14]在舌癌中发现,过表达HMGA2能够通过EMT途径促进细胞发生迁移和侵袭。

Figure 4.The effects of HMGA2 over-expression on the migration (A, ×40) and invasion (B,×200) of MKN28 cells. Mean±SD.n=3.*P<0.05vsMKN28-control group and MKN28-empty group.
图4HMGA2过表达对MKN28细胞迁移和侵袭能力的影响
关于HMGA2是否参与胃癌细胞的EMT过程,本研究结果发现过表达HMGA2所诱导的标志蛋白的表达水平变换与EMT过程相一致,如上皮标志蛋白E-cadherin表达降低,间充质标志蛋白N-cadherin和vimentin表达增加;而在HMGA2表达被抑制后,E-cadherin表达增加,N-cadherin和vimentin表达降低。以上结果验证了本研究的推测,HMGA2参与并且促进了胃癌细胞的EMT过程。本研究结果还发现,在MKN28细胞中过表达HMGA2后,细胞内的Wnt/β-catenin信号通路被激活,即β-catenin及其下游分子c-Myc和cyclin D1的mRNA表达水平显著增加。而多项研究证实,Wnt/β-catenin信号通路的激活,能够促进细胞发生EMT,所以HMGA2可能是通过激活Wnt/β-catenin信号通路,诱导胃癌细胞发生EMT,从而促进了胃癌细胞的迁移和侵袭。本研究通过增加或抑制胃癌细胞中HMGA2表达,发现细胞中β-catenin、c-myc和cyclin D1发生相应变化,初步证实HMGA2参与调控Wnt/β-catenin信号转导通路中主要分子β-catenin以及下游靶分子c-Myc和cyclin D1表达,为HMGA2作为胃癌靶向治疗基因提供了依据。
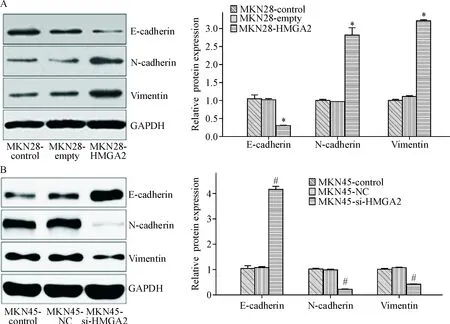
Figure 5. The effects of HMGA2 up- or down-regulation on the expression of EMT-related proteins in MKN28 cells (A) and MKN45 cells (B). Mean±SD.n=3.*P<0.05vsMKN28-control group and MKN28-empty group;#P<0.05vsMKN45-control group and MKN45-NC group.
图5上调或下调HMGA2对EMT标志蛋白表达的影响

Figure 6. The effects of HMGA2 over-expression on the mRNA expression of Wnt/β-catenin signal pathway-related molecules in the MKN28 cells. Mean±SD.n=3.*P<0.05vsMKN28-control group and MKN28-empty group.
图6HMGA2过表达对Wnt/β-catenin信号通路相关分子mRNA表达的影响
综上所述,本研究结果证实,HMGA2在胃癌细胞中的高表达,能够促进细胞恶性表型的发生,即增强细胞的迁移和侵袭能力,并且HMGA2有可能是通过激活细胞内的Wnt/β-catenin信号通路,参与了胃癌细胞EMT的发生。本研究的局限性在于没有对Wnt/β-catenin信号通路的其他相关基因及下游基因进行检测,而且HMGA2是通过何种机制诱导激活Wnt/β-catenin信号通路,将在今后的研究中进一步探究。
