三种噬菌体裂解基因对大肠杆菌致死效果的比较
2019-04-17张远星李统战余子豪李倩文余旭平
张远星,李统战,余子豪,查 帆,李倩文,余旭平
(浙江大学 动物科学学院,浙江 杭州310058)
细菌性疫病严重危害畜牧业健康发展,也威胁着人类健康,杀死或抑制细菌生长是控制细菌性疫病的主要手段,但随着抗生素和抗菌药物的广泛使用特别是滥用,细菌耐药性问题变得越来越突出和严重,寻找新的药物和解决方法成了刚需。人们尝试探索应用抗菌肽、微生态制剂、甚至噬菌体等来解决耐药性问题。1980年瑞典科学家在研究北美天蚕的免疫机制时,将细菌注入滞育蛹后发现血淋巴中产生了具抑菌作用的多肽类物质,由此发现了第一个动物源抗菌肽天蚕素[1]。此外,研究人员还从细菌、真菌、两栖类、昆虫、高等植物、哺乳动物乃至人类中发现并分离获得多种具有抗菌活性的多肽[2-3]。
噬菌体也用于治疗人类、动物的细菌性疾病[4-5]。噬菌体按子代释放方式可分为丝状噬菌体和裂解噬菌体。用于治疗的噬菌体为裂解噬菌体,按裂解因子组份它们可进一步分为单裂解肽噬菌体和双组份裂解噬菌体。前者通过单一裂解肽插入细胞膜并损害细胞壁来裂解细菌;后者表达裂解酶(Virolysin)和穿孔素(Holin)两个组份,其中穿孔素在细胞膜上形成孔洞,协助裂解酶分泌到周间质,水解细胞壁肽聚糖,裂解细菌[5]。然而,噬菌体治疗具有局限性,存在抗菌谱窄、易被免疫系统快速清除等问题[6],人工表达或直接应用这些产物或许可以减轻和解决上述问题,应用重组的双组份噬菌体裂解酶进行动物耐药菌的防治目前已有报道[7]。
单裂解肽噬菌体包括DNA噬菌体φX174以及RNA噬菌体M和Qβ等,它们表达的裂解肽分子量比裂解酶小,而且一些裂解肽具有类似抗菌肽的结构,包括含有一段疏水肽段及带较多正电荷氨基酸残基,并且采用同样的破坏细胞膜方式裂解细菌[8]。噬菌体φX174、M和Qβ均感染大肠杆菌,其中φX174裂解肽E和噬菌体M裂解肽M-lysis的结构和大小与抗菌肽类似,而Qβ噬菌体编码的裂解肽A2无疏水跨膜区,不同于抗菌肽[8-9]。Yu等发现表达裂解肽E衍生物mE对大肠杆菌和沙门氏菌有更好的溶菌效果[10]。因此本实验选择和人工合成了φX174的E及其衍生mE基因和噬菌体M的裂解基因M-lysis,克隆于pN15E6高效表达载体,转化配套宿主菌DH31soplacI和实验室常规菌株JM109,经IPTG诱导表达,观察并比较这3种噬菌体裂解肽致死这两种大肠杆菌宿主的程度,探索它们成为“抗菌肽”的可能性。
1 材料与方法
1.1 主要试剂 ExTaqDNA聚合酶、TaqDNA聚合酶、dNTP、DL2000 DNA Marker均购自TaKaRa公司;快速抽提型质粒DNA小量试剂盒、快速抽提型基因组DNA小量试剂盒均购自爱思进生物公司;T4 DNA连接酶购自New England BioLabs公司;异丙基硫代半乳糖苷(IPTG)、卡那霉素(Kan)、氯霉素(Chl)、甘油均购自生工生物工程(上海)有限公司;胰蛋白胨(Tryptone)和酵母浸出粉购自Oxoid公司。
1.2 质粒与菌株 pN15E6质粒及其宿主菌DH31soplacI由俄罗斯科学院Ravin惠赠[11];DH31soplacI菌株是pN15E6质粒的配套菌株,包含lacIq基因并具有氯霉素抗性;JM109菌株由本实验室保存。
1.3 引物设计及合成 参照文献合成M-lysis[9]、mE、E[10]3个基因。分别对应于噬菌体M(NC_019707)序列的2 991 bp~3 104 bp位置(M-lysis)和噬菌体φX174(NC_001422)序列的643 bp~843 bp和568 bp~843 bp位置(mE和E基因),设计合成引物,通过重叠延伸PCR(SOE-PCR)[12]合成对应的3个基因。为获得较好的表达效率,本研究在设计引物时进行了密码子优化。结合载体酶切位点,设计引物,PCR扩增M-lysis、mE、E基因片段,亚克隆至pN15E6表达载体。参照pN15E6载体序列,设计用于鉴定构建的重组质粒的引物。具体引物名称、扩增片段长度以及序列见表1,引物合成由华大生物科技有限公司完成。
1.4 目的基因的合成与测序鉴定 应用SOE-PCR方法将引物M_lysis12_Bgl、M lysis2-4、M lysis3bb和M lysis4bbNco混合,经SOE-PCR合成M-lysis基因;将引物mE1Bgl1、mE-2、mE-3、mE-4、mE-5、mE6和mE-7NcoA'混合,应用SOE-PCR合成mE基因;将mE-7NcoA'更换成E-7+v,并进一步加入E-8v、E-9vT引物,经SOE-PCR合成E基因。将SOE-PCR合成的3个基因片段分别克隆于pMD18-T载体,PCR鉴定阳性质粒送华大基因公司测序,鉴定正确的重组质粒分别命名为pMD_Mlysis、pMD_mE和pMD_E。

表1 目的基因合成、片段扩增对应引物Table 1 Primers for synthesis and amplification of target genes
1.5 重组表达质粒的构建与鉴定 以M_lysis12_Bgl和M lysis4bbNco、mE-1Bgl1和mE-7NcoA'、mE-1Bgls和E-9vTNcoAs为引物,应用PCR分别以pMD_Mlysis、pMD_mE和pMD_E质粒为模板扩增M-lysis、mE、E基因,将回收的基因片段与pN15E6质粒经NcoⅠ/BglⅡ双酶切,酶切的基因片段分别与质粒pN15E6连接后转化JM109,以pN15-insChKUp3和pN15-insChKDn2为引物进行PCR鉴定,阳性质粒由华大基因公司测序,确认序列的正确性。正确的重组表达质粒分别命名为pN15E6-M-lysis、pN15E6-mE、pN15E6-E。
1.6 M-lysis、mE、E基因过表达对JM109菌株和DH31soplacI菌株的致死性测定 将pN15E6-M-lysis、pN15E6-mE、pN15E6-E分别转化至JM109和DH31soplacI感受态细胞,将得到的重组菌过夜培养后稀释106倍(约1.0×103个细菌/mL),分别涂布于含和不含IPTG诱导剂的Kan+LB平板或Chl+Kan+LB平板培养基上,将平板置37℃过夜培养,观察细菌菌落生长。
1.7 M-lysis、mE、E基因过表达对DH31soplacI菌株的致死效率测定 将含pN15E6-M-lysis、pN15E6-mE、pN15E6-E质粒的DH31soplacI重组菌过夜培养物分别稀释103倍(约1.0×106个细菌/mL),分别涂布于含IPTG诱导剂的Chl+Kan+LB平板培养基上,同时将稀释106倍(约1.0×103个细菌/mL)的过夜培养物分别涂布于不含IPTG诱导剂的Chl+Kan+LB平板上,将平板置于37℃过夜培养,进行平板计数,结合稀释倍数计算过表达M-lysis、mE和E基因对大肠杆菌的致死效率。
1.8 各基因过表达重组菌的生长曲线测定 将pN15E6-M-lysis、pN15E6-mE、pN15E6-E分别转化DH31soplacI感受态细胞,将获得的各重组菌震荡培养至OD600nm约为0.5后加IPTG(终浓度为0.4 mmol/L)诱导,每隔30 min测定OD600nm值;以不加IPTG诱导剂为对照,同时培养,同样时间点测定OD600nm值,将测定值绘制生长曲线图。
2 结果
2.1 目的基因的合成与测序鉴定 应用SOE-PCR经引物重叠延伸,合成M-lysis、mE和E基因。PCR合成产物均出现一条明显的与目标大小相符的目的条带,但目的条带前后存在较明显的拖尾现象。将SOE-PCR合成的3个基因片段回收后分别克隆于pMD18-T载体,用PCR筛选到插入片段长度正确的目标质粒。以pMD_Mlysis、pMD_mE和pMD_E为模板,PCR扩增相应的插入片段,结果显示扩增的目的基因片段大小分别约为100 bp、200 bp、300 bp,与各自预期目的基因相符(图1)。相应重组质粒进一步测序结果显示与预期一致。表明正确合成了M-lysis、mE和E基因。

图1 重组质粒中M-lysis、mE、E基因的PCR扩增Fig.1 Amplification of M-lysis,mE and Egenes from recombinant plasmids by PCR
2.2 重组表达质粒的鉴定 应用PCR从pMD_Mlysis、pMD_mE和pMD_E质粒中扩增相应基因片段,亚克隆于pN15E6表达质粒,获得目标表达质粒。以pN15-insChKUp3和pN15-insChKDn2为引物,对目标质粒进行PCR扩增。结果显示,从pN15E6-M-lysis、pN15E6-mE、pN15E6-E质粒分别扩增得到370 bp、456 bp和532 bp的基因片段,与预期大小相符(图2)。相应重组质粒经进一步测序显示,已获得正确的重组表达质粒。
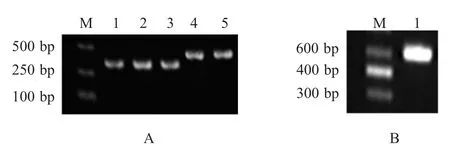
图2 重组表达质粒pN15E6-M-lysis、pN15E6-mE和pN15E6-E的PCR鉴定Fig.2 Identification of recombinant pN15E6-M-lysis,pN15E6-mE and pN15E6-E plasmids by PCR
2.3 M-lysis、mE、E基因过表达对JM109菌株的致死性测定 将各基因重组表达质粒分别转化JM109,经稀释后涂布于含和不含IPTG诱导剂的Kan+LB平板培养基上培养,结果显示,在不含IPTG诱导剂的平板上各重组菌生长良好(图3),与之比较,在含IPTG的平板上,pN15E6-M-lysis/JM109重组菌菌落形态变小,但仍有少量与原始菌大小一致的耐受菌(图3A),表明绝大部分细菌生长受到过表达M-lysis基因的抑制,个别细菌具有耐受性。pN15E6-mE/JM109重组菌菌落形态变小且数量减少(图3B),表明部分重组菌被过表达的mE基因所杀灭,有部分菌仍存活,但生长受到抑制。而pN15E6-E/JM109重组菌在含IPTG的平板上菌落数目明显减少,仅有少量耐受菌生长(图3C),表明过表达E基因杀灭了大部分细菌,但仍有少量耐受菌存活。
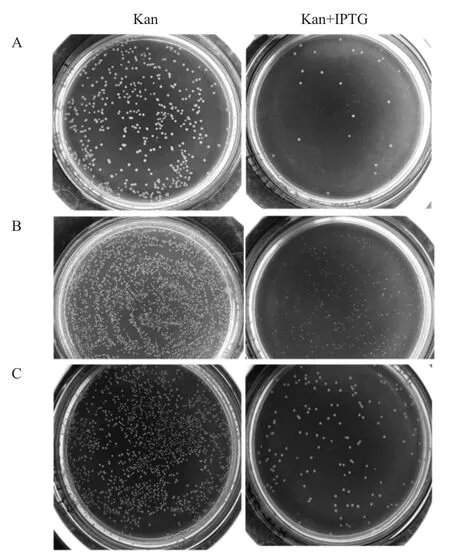
图3 M-lysis、mE、E基因过表达对大肠杆菌JM109菌株的致死性测定Fig.3 Analysis of lethality to Escherichia coliJM109 strains whenM-lysis,mE and Egenes were over-expressed respectively
2.4 M-lysis、mE、E基因过表达对DH31soplacI菌株的致死性测定 将3种DH31soplacI重组菌过夜培养,培养液分别稀释106倍,涂布于含和不含IPTG诱导剂的Chl+Kan+LB平板培养基上培养,结果显示在不含IPTG诱导剂的平板上重组菌生长状态均良好(图4),与之比较,在含IPTG的平板上的含pN15E6-M-lysis和pN15E6-mE的重组菌数量明显减少,但有少量菌耐受(图4A、4B),而含pN15E6-E质粒的重组菌在含IPTG的平板上则无菌落生长(图4C)。表明E基因过表达致死作用最强。
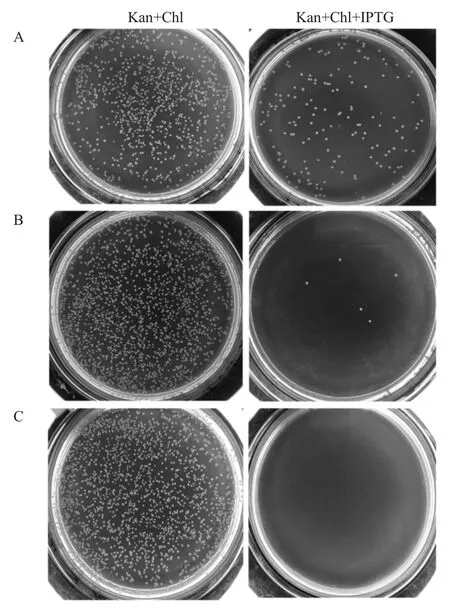
图4 M-lysis、mE、E基因过表达对大肠杆菌DH31soplacI菌株的致死性测定Fig.4 Analysis of lethality to Escherichia coliDH31soplacI strain when M-lysis,mE and Egenes were over-expressed respectively
2.5 M-lysis、mE、E基因过表达对DH31soplacI菌株的致死率测定 将3种DH31soplacI重组菌过夜培养物分别稀释103倍,涂布于含IPTG诱导剂的Chl+Kan+LB平板培养基上培养,进行平板菌落计数;同时稀释106倍涂布于不含IPTG诱导剂的Chl+Kan+LB固态培养基平板上培养,进行平板计数;最后结合稀释倍数计算过表达相应基因的致死效率。结果显示,过表达M-lysis、mE、E基因对DH31soplacI菌株的致死率分别为99.03%、99.68%、99.9998%(表2)。进一步表明E基因过表达对细菌的致死作用最强。

表2 M-lysis、mE和E基因过表达对DH31soplacI菌株的致死效率测定Table 2 Quantification of the lethality of M-lysis,mE and Egenes over-expressed in DH31soplacI strain
2.6 各基因过表达重组菌的生长曲线测定 将转化pN15E6-M-lysis、pN15E6-mE、pN15E6-E质粒的DH31soplacI重组菌经诱导培养后定时测定其OD600nm值,绘制曲线图,结果显示,E基因过表达后重组菌OD600nm值明显下降;M-lysis和mE基因过表达后重组菌OD600nm值与对照相比略有下降(图5)。表明E基因过表达能够迅速致死并裂解细菌,而M-lysis和mE基因过表达裂解细菌能力较弱。

图5 DH31soplacI过表达重组菌的生长曲线图Fig.5 The growth curves of E.coliDH31soplacI strains when M-lysis,mEandEgenes were over-expressed respectively
3 讨论
一些噬菌体在生长后期通过调控表达裂解酶和裂解肽在细胞膜上形成孔洞,裂解细菌并释放子代噬菌体。T4、T7、λ等噬菌体裂解细菌需要穿孔素和裂解酶两种组分,而φX174、M、MS2等噬菌体仅需要单一的裂解肽。其中φX174噬菌体的裂解肽E和mE以及M噬菌体的裂解肽M-lysis,均包含疏水区段及较高比例的精氨酸和赖氨酸,长度分别为91、66和37个氨基酸,其大小和结构与抗菌肽(AMPs)相当。有报道应用噬菌体治疗细菌性疾病,但噬菌体治疗存在抗菌谱窄、易被免疫系统快速清除等问题[6]。抗菌肽作为新型抗菌药物,不易产生耐药性,可以弥补噬菌体药物治疗的不足并缓解传统抗生素耐药性问题。抗菌肽是原核和真核生物中先天免疫防御系统的多功能组分,其长度通常少于100个氨基酸,一些甚至在50个氨基酸以内[13]。抗菌肽主要通过与细胞膜结合改变膜通透性而起作用,绝大部分抗菌肽含有疏水肽段,并带正电荷[14]。因此,本研究尝试表达大小和结构与抗菌肽相当、功能与抗菌肽相似的噬菌体裂解肽基因M-lysis、E和mE,测定其致死宿主细菌的能力,为探索开发噬菌体来源的“抗菌肽”奠定基础。
本研究将噬菌体φX174的E基因及其衍生mE基因和噬菌体M的裂解基因M-lysis克隆至高效表达载体pN15E6上,诱导过表达,观察其对宿主大肠杆菌JM109菌株和DH31soplacI菌株的致死作用,结果发现过表达3种噬菌体基因对DH31soplacI菌株的致死作用比对JM109菌株的致死作用强。DH31soplacI菌株由DH10B菌株整合入pCD11-31soplacI质粒构建而成,因此DH31soplacI菌株染色体中整合了PBAD启动子控制下的antA基因,经诱导表达后可提高pN15E6表达载体拷贝数,加强外源基因的表达[11],而JM109菌株没有该结构,这可能是造成对二者致死差异的原因,当然,不同实验菌株间的差异本身可能也是造成这种差异的原因。本研究首次发现,M-lysis、E以及mE基因过表达后对宿主JM109菌株和宿主DH31soplacI菌株影响效果不同,而二者同为大肠杆菌,推测过表达产生致死作用的原因可能存在差异。
本研究还发现过表达E基因的致死作用最强,生长曲线测定结果也显示过表达E基因能迅速致死和裂解细菌。mE基因是E基因起始密码ATG缺失单碱基A的结果,正由于少了这个碱基导致起始密码子缺失,最前面的25个密码子编码序列变成了74 bp的非编码区,原来编码的91个氨基酸的E裂解肽缩短为66个氨基酸的mE[10]。有研究认为裂解肽E的N末端前51个氨基酸是裂解活性所必需的[15],裂解活性定位N末端前29个氨基酸[16],也有研究认为,N末端前35个氨基酸多肽是裂解活性所必需的,它包含一段疏水序列,在裂解的过程中可能起到跨膜作用[17]。Yu等发现,表达N末端缺失25密码子的裂解基因E(即mE)对大肠杆菌和沙门氏菌有更好的溶菌效果[10]。本研究结果显示,尽管缺失25密码子的mE基因过表达具有裂解活性,但mE对大肠杆菌DH31soplacI致死作用不如全长的E。这个结果差异有可能是由于第一个起始密码子缺失有利于mE基因表达造成的,也有可能是由于合成基因对密码子进行了优化,导致表达效率发生变化的结果,但结合以往对活性区域的研究结果[15-16],推测N末端缺失25个氨基酸影响到杀菌功能的可能性比较大。
本研究比较了3种噬菌体裂解基因M-lysis、mE和E对大肠杆菌的致死效果,其中过表达φX174噬菌体的E基因致死效果最好,这为进一步开发噬菌体裂解肽奠定基础。相对于真核生物,对细菌致死机制的许多方面有待进一步探索、研究和完善。本研究的噬菌体裂解肽是通过直接裂解细菌而发挥致死作用,这不同于抗生素、毒素与抗毒素系统和细菌类凋亡等目前已报道的细菌致死方式[18],因此筛选的噬菌体裂解基因过表达系统还可能为致死机理探索提供一种新模型。
