磷脂酶D参与冬小麦对干旱胁迫的响应*
2019-04-17王雅静张欣莹黄桂荣钟秀丽
王雅静,张欣莹,黄桂荣,封 富,钟秀丽
磷脂酶D参与冬小麦对干旱胁迫的响应*
王雅静,张欣莹,黄桂荣,封 富,钟秀丽**
(中国农业科学院农业环境与可持续发展研究所/农业部旱作节水农业重点实验室,北京 100081)
磷脂酶D(phospholipase D,PLD)通过水解细胞膜磷脂产生信使物质磷脂酸(PA),并介导多种激素与逆境的信号转导过程。为探讨PLD在参与干旱信号转导调控细胞膜稳定性方面的作用及其途径,采用在培养液中加入PEG-6000模拟干旱胁迫,用PLD抑制剂正丁醇(n-butanol,BA)抑制PLD产生PA,对比PEG+BA处理与PEG处理下小麦抗旱性、膜稳定性以及抗氧化酶类的变化。结果表明,与PEG处理相比,PEG+BA处理下,冬小麦幼苗叶片生长受抑制,净光合速率下降,光合非气孔限制作用增强,细胞膜离子渗漏率显著升高,膜脂过氧化产物丙二醛(malonaldehyde,MDA)升高,抗氧化酶POD活性下降,表明PLD参与干旱胁迫下过氧化物酶(peroxidase,POD)活性的调控。由此揭示出一条潜在的由PLD介导的干旱信号转导途径,即干旱胁迫—PLD激活—POD活性增强—保护膜脂过氧化损伤—提高细胞膜稳定性—植物抗旱性增强。
磷脂酶D;干旱;信号转导;过氧化;抗氧化系统;PLD
干旱是限制植物生长和作物产量最重要的因素之一。小麦(L.)是世界上广为种植的粮食作物,为中国第二大作物[1]。冬春季节干旱灾害已成为制约中国小麦持续增产的关键生态因素[2],小麦从种子萌发到灌浆成熟的各个时期都可能遭受干旱的危害。因此,揭示小麦对干旱胁迫的响应特性与机理,对于品种抗旱性的遗传改良以及抗旱品种鉴选均有重要意义。
干旱胁迫引起植物的多种生理响应,包括降低光合速率,关闭气孔减少蒸腾失水,增强代谢从而提高渗透调节能力,合成抗脱水蛋白,激活抗氧化系统,减轻氧化损伤以保护生物膜稳定性等。这些生理响应事件需要通过信号转导过程诱发。植物感受胞外信号,启动级联反应传递并放大信号,引发各种生物化学反应以及蛋白间相互作用,改变细胞内的某些代谢过程和细胞功能,使机体在整体上对外界环境的变化发生适应性反应,这个过程被称为细胞信号转导(Cellular signal transduction)[3]。植物细胞信号转导机理的研究不断深入,ABA、Ca2+、H2O2、NO、乙烯、茉莉酸类物质(Jasmonic acid,JAs)等信使物质,以及G蛋白[4]、磷脂酶C[5−6]、磷脂酶D[7−8]等信号转导蛋白相继被发现。信号转导并非依靠单一途径,而是多条途径交互作用构成复杂的信号转导网络。重要信号途径的阻断会显著降低植物的适应性反应[9]。
磷脂酶D是重要的跨膜信号转导酶[10],在拟南芥上已鉴定出多个同种型,根据基因序列和酶学特性,这些PLD被分为12类,分别是α(3类)、β(2类)、γ(3类)、δ、ε、ζ(2类)。PLD通过水解磷脂产生磷脂酸(Phosphotidic acid,PA)和一个自由头部。PA已被大量研究证实是重要的信使物质,PLD通过产物PA参与多种激素与逆境的信号转导过程。如PLD参与ABA诱导气孔关闭的信号转导过程[11−14]。Sang等[15]在拟南芥和烟草上发现PLD参与水分胁迫诱导气孔关闭的信号途径,Li等[16]发现PLD参与低温信号的转导过程。另外,还发现PLD参与氮和磷等养分胁迫的信号转导[17−19]。
逆境胁迫下细胞内部产生大量的活性氧(Reactive oxygen species,ROS)。ROS主要攻击对象为细胞膜甘油骨架上的多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA),导致膜脂不饱和度下降。同时,大量脂质被过氧化生成复杂的脂质氢过氧化物。这些脂质氢过氧化物极不稳定,极易分解为小片段的碳氢化合物,如MDA、4-羟基壬烯醛(4-hydroxynonenal, HNE)、羟基脂肪酸和酮类脂肪酸以及它们的衍生物。膜脂过氧化以及膜脂不饱和度降低引起细胞膜的流动性和稳定性下降[20],离子大量外渗,同时影响膜结合酶类活性,最终导致细胞结构受损和功能下降[21]。抗氧化系统是清除活性氧保护细胞膜稳定性的直接机制,包括超氧化物歧化酶(superoxide dismutase,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)和POD等抗氧化酶类和抗坏血酸等抗氧化剂类[22]。逆境胁迫下抗氧化系统被大量激活[23−24],抗逆性强的品种较逆境敏感品种增强显著[25−26]。而且,不同胁迫类型以及不同植物上激活的抗氧化酶及其激活程度有差异[27−30]。干旱信号的转导涉及多种途径,但跨膜信号转导酶PLD是否参与抗氧化系统的调节,主要参与调控哪一类抗氧化酶均未见报道。加之PLD信号功能的研究主要集中在模式植物上,在小麦作物上报道很少。因此,本研究针对小麦作物探讨PLD调控抗氧化系统活性调节植物抗旱性的信号转导途径,以期探究干旱胁迫的信号转导机制,为揭示植物抗旱机理提供理论依据。
1 材料与方法
1.1 试验设计
选取冬小麦品种晋麦47为实验材料。将1000颗冬小麦种子用10%的次氯酸钠溶液浸泡10min,再用蒸馏水冲洗数遍,腹沟朝下摆放在培养皿中,培养皿上铺有两层用蒸馏水浸湿的滤纸,将所有培养皿统一移入设置好的气候培养箱内。培养箱设置条件为,日间6:00−22:00,温度23℃,光照辐射强度300μmol·m−2·s−1,空气相对湿度65%;夜间22:00− 6:00,温度20℃,光照辐射强度0μmol·m−2·s−1,空气相对湿度65%。每天固定时间10:00与22:00浇蒸馏水使滤纸保持湿润,第7天开始改用1/2 Hoagland营养液浇灌,第10天麦苗长高后将培养皿换成29cm×14cm×6cm的水培缸继续培养,水培缸中加入营养液800mL,每缸培养84株小麦,第16天开始处理。处理设置:将9个水培缸分为三组,第一组用营养液继续培养,为营养液组(CK);第二组为干旱胁迫处理组(PEG):在480g PEG-6000中加入1/2 Hoagland营养液,定容至2400mL,配置成20% PEG(W/V)溶液,每个重复加入800mL至水培缸;第三组为干旱胁迫+抑制剂组(PEG+BA):将480g PEG-6000溶于1/2 Hoagland营养液,再加入12mL正丁醇(BA),BA通过其转酰基作用抑制PLD介导的PA产生,再加入1/2 Hoagland营养液定容至2400mL,配置成含有0.5%BA的20% PEG(W/V)溶液,搅拌均匀,每个重复加入800mL。培养至第16天时,CK组的培养液保持不变,PEG组和PEG+BA组的培养液分别换成含有20%PEG的营养液和含有20%PEG+0.5%BA的营养液,继续培养6d,每3d更换一次培养液,每个处理3个培养缸,即3个重复。
1.2 指标测定
1.2.1 株高根长测定
处理4d后,9:00在每个培养缸中选择一株叶片长短一致、长势均匀的小麦幼苗完整取出,用直尺测量植株的根长和株高,植株基部至最上部展开叶的距离即为株高。
1.2.2 光合参数
分别在处理前和处理1、2、3、4d后每日9:00− 11:00,于每个培养缸中选择叶片长短一致、长势均匀的3个植株,选取植株的第二片完全展开叶,采用光合系统(Li-6400,USA)测试叶片光合参数,包括净光合速率(Net photosynthesis rate,Pn)、胞间CO2浓度(Intracellular CO2concentration,Ci)、气孔导度(Stomatal conductance,Gs)。设置CO2浓度(Ca)为400μmol·mol−1,荧光强度为1200μmol·m−2·s−1。
气孔限制值(stomatal limitation index, LS)
LS=1−Ci/Ca(1)
非气孔限制值(Non-stomatal limitation index)
NLS=Ci/GS(2)
1.2.3 丙二醛含量
丙二醛采用硫代巴比妥酸法测定[31]。从试验处理第一天起,每天于每个处理中取小麦第二片完全展开叶0.5g,连续取6d。叶片取下后用锡纸包好置于液氮中,待冷冻完全置于−80℃冰箱保存,测定时取出。将0.5g叶片剪碎,加入10mL10%(w/v)三氯乙酸和少量石英砂,冰浴研磨成匀浆,匀浆在3000g下离心10min,取上清液为提取液。取10mL刻度试管2支,1支加入上清液2mL,另一支加入蒸馏水2mL(空白),各加 0.5%(w/v)的硫代巴比妥酸2mL,摇匀。混合液置于沸水浴中15min,取出后迅速冷却(冰上),室温下离心(3000g,10min),以空白作为对照,取上清液分别测定450nm、532nm和600nm下吸光值。
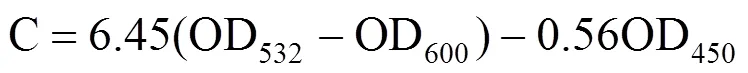
式中,C为MDA浓度(mmol·L−1),利用提取液总体积(Vt,mL)值和叶片鲜重(FW,g),换算得到MDA含量(mmol·g−1)

每个处理设计3个重复。
1.2.4 细胞膜离子渗漏率
细胞膜离子渗漏率采用电导仪法进行测定[31]。从试验处理第1−7天,每日取每个处理小麦第二片完全展开叶5片,3组重复,用去离子水冲洗,剪成1cm小段,浸没于10mL去离子水中,用真空泵抽气20min,再缓缓放入空气,接着在摇床上震荡3h,测定电导率C1。再将溶液和叶片转至试管中,放置于100°C水浴锅煮沸15min,待降至室温后,测第二次电导率C2。
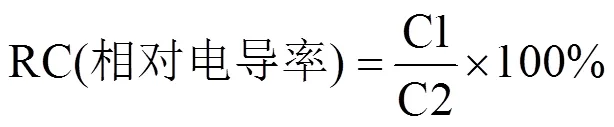
1.2.5 抗氧化酶
分别在处理前和处理2d、4d、6d后每日9:00选择大小一致、长势均匀的叶片,每个处理取0.2g叶片进行酶液提取,3组重复。超氧化物歧化酶(SOD)采用氮蓝四唑法测定[32],过氧化物酶(POD)采用愈创木酚显色法测定[33],过氧化氢(CAT)采用紫外吸收法测定[34]。
1.3 数据处理
采用SAS软件进行数据统计分析,用单因素方差分析差异显著性。利用Origin软件作图。
2 结果与分析
2.1 抑制PLD对植物抗旱性的影响
2.1.1 植物生长
由图1可知,3种处理之间小麦根长差异不显著,但是株高存在显著差异。PEG(干旱)处理株高显著低于CK,PEG+BA(干旱胁迫中加入PLD抑制剂BA)处理显著低于PEG处理。表明PLD抑制剂BA处理降低了干旱胁迫下小麦叶片的生长速度,但是对苗期小麦根的生长速度无显著影响。

图1 处理4d后小麦株高和根长比较
注:小写字母表示处理间在0.05水平上的差异显著性。
Note: Lowercase indicates the difference significance among treatments at P<0.05 level.
2.1.2 光合参数
由图2可知,CK处理冬小麦叶片光合参数随时间并未发生明显的变化,而PEG和PEG+BA两个处理的各项光合参数均表现出显著的变化。净光合速率整体呈降低趋势,降低速率逐渐增大,降至低点后保持平缓。处理2d后,PEG+BA处理下净光合速率极显著低于PEG处理(P<0.01)。3个处理下气孔导度的变化情况与净光合速率相近。PEG和PEG+BA两个处理的胞间CO2浓度在干旱胁迫1d后开始升高,气孔限制值在胁迫1d后开始降低,非气孔限制值开始升高。由此可见,在没有经过任何干旱锻炼的情况下,用20%PEG处理冬小麦幼苗仅1d后,光合作用限制因素就从气孔限制转向非气孔限制,即光合相关酶类的活性开始降低。PEG+BA处理与PEG处理相比,在干旱胁迫2d和3d时达到极显著差异(P<0.01),PEG+BA处理的小麦叶片胞间CO2浓度更高,气孔限制值更低,非气孔限制值则更高。这表明加入正丁醇抑制PLD,导致光合相关酶类的活性和光合器官受到了更严重的损害,光合作用能力显著降低。
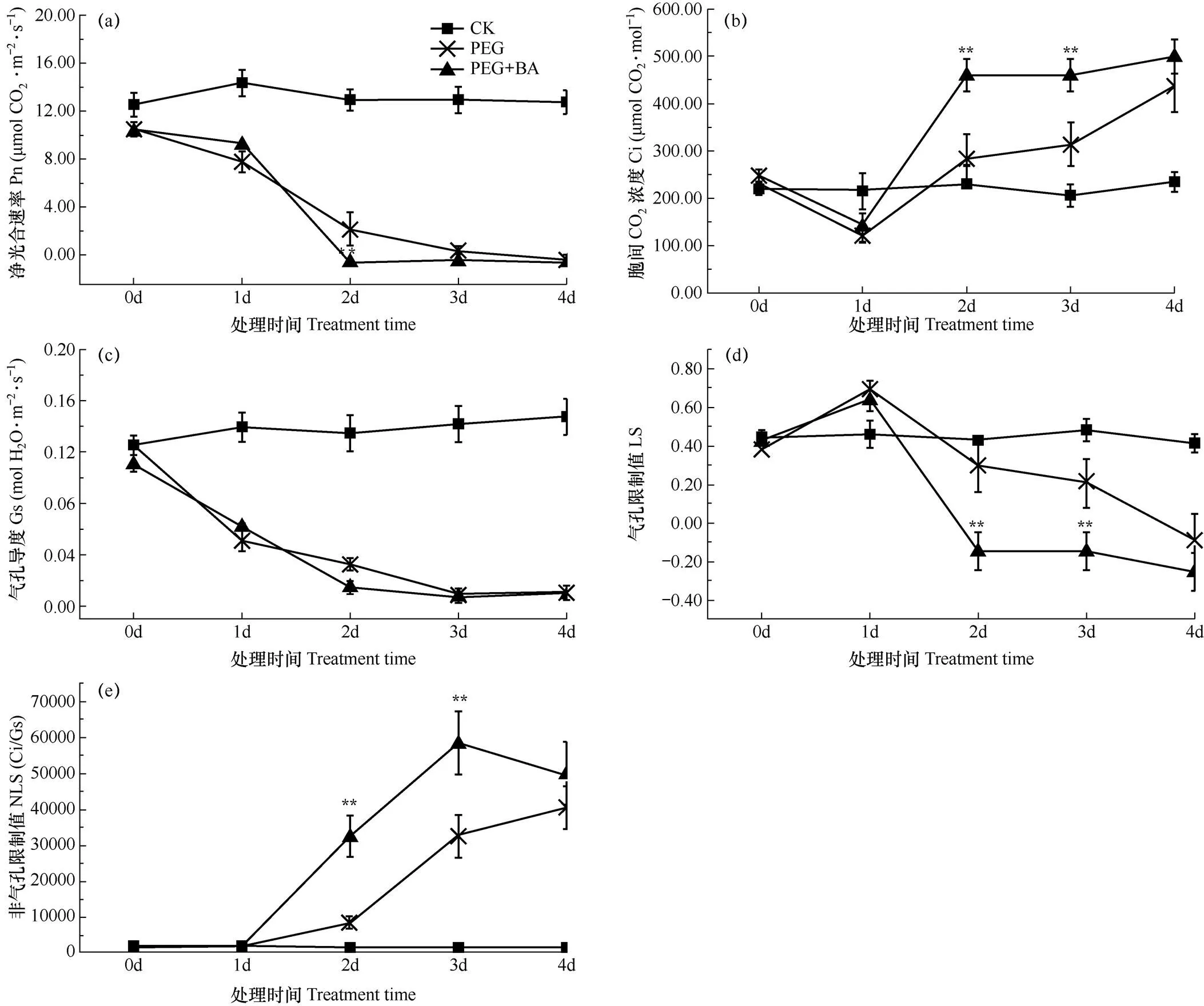
图2 不同处理下小麦光合参数的变化过程
注:*和**分别表示PEG 与PEG+BA处理在0.05和0.01水平上差异显著。下同。
Note:*and**indicate that there are significant differences between plants treated by PEG and PEG+BA at P<0.05 and P<0.01, respectively. The same as below.
2.1.3 细胞膜稳定性
胁迫程度由胁迫强度和胁迫持续时间共同决定,在处理的6d时间里,PEG浓度维持在20%,表明小麦承受的干旱程度随时间逐渐加强。细胞膜离子渗漏率是反映细胞膜稳定性的重要指标。由图3可知,未经干旱处理的CK,小麦叶片细胞膜离子渗漏率维持在4%~7%,而PEG和PEG+BA处理下,膜离子渗漏率随胁迫时间延长不断上升。胁迫持续6d时,PEG和PEG+BA处理,膜离子渗漏率分别增加2.45和2.98倍。从处理后2d开始,除5d外,PEG+BA处理均显著高于PEG处理,其中处理3d、6d时,二者呈显著差异(P<0.05),处理2d、4d时二者呈极显著差异(P<0.01)。处理6d时,PEG+BA处理下膜离子渗漏率较PEG处理高27%。说明加入BA抑制PLD作用导致干旱胁迫下冬小麦的细胞膜稳定性降低,离子大量外渗。

图3 不同处理下叶片细胞膜离子渗漏率变化过程的比较
2.2 抑制PLD对干旱胁迫下细胞膜脂质过氧化作用的影响
由图4可见,CK处理中叶片丙二醛(MDA)含量随时间的变化幅度较小,但是PEG和PEG+BA处理下MDA含量随着胁迫时间延长均呈上升趋势,特别是从处理4d后,PEG+BA处理中MDA含量显著高于PEG处理。MDA是胁迫下产生的活性氧对膜系统脂质过氧化的产物。该结果表明正丁醇处理抑制PLD,加剧了胁迫下活性氧对细胞膜脂质的过氧化作用,导致胁迫下细胞膜稳定性下降,多种生理代谢过程受到影响。
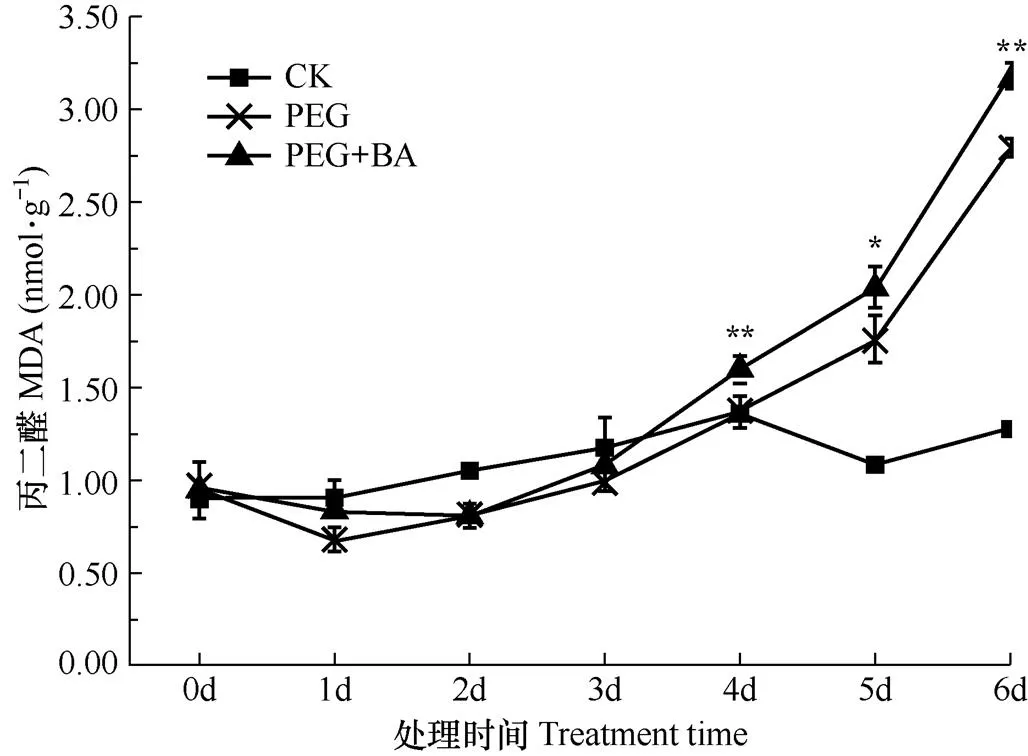
图4 不同处理下叶片MDA变化过程的比较

图5 不同处理下叶片抗氧化酶类活性变化过程比较
2.3 抑制PLD对抗氧化酶类的影响
为探究PLD是否介导干旱胁迫下几种主要抗氧化酶活性的调节,测定了冬小麦叶片SOD、CAT和POD三种典型抗氧化酶的活性。由图5可见,干旱胁迫下植物的SOD显著升高,但PEG+BA处理与PEG处理之间无显著差异,表明BA处理不影响SOD的活性,PLD不参与干旱胁迫下SOD活性的调节。CAT在干旱胁迫处理4d后表现出降低趋势,PEG+BA处理与PEG处理之间变化趋势一致,二者无显著差异,表明用正丁醇处理抑制PLD也未影响CAT的活性。但是,POD的情况则不同,PEG处理与PEG+BA处理下小麦幼苗中POD活性具有升高趋势。PEG+BA处理在处理2d和4d时显著低于PEG处理(P<0.05),到处理6d时二者已无显著差异。表明PLD参与干旱胁迫下POD活性的调节。
可以看出,抑制剂BA抑制了干旱胁迫下PLD产生PA,使抗氧化酶POD活性降低,膜脂过氧化产物MDA升高,细胞膜离子渗漏率升高,膜稳定性下降,光合酶活性下降,叶片生长受抑制。揭示了PLD通过调控抗氧化酶POD活性调节植物抗旱性的途径。
3 结论与讨论
3.1 讨论
PEG胁迫处理2d开始,PEG+BA处理下膜离子渗漏率较PEG处理显著升高。同时,胞间CO2浓度升高,光合作用非气孔限制值较PEG处理显著增强,说明光合作用相关酶类的功能下降。许多生理功能相关酶类分布于生物膜上,在生物膜的稳定性与流动性受到损伤时,膜上功能酶的活性就受到影响。因此,可能是膜稳定性受到损伤,使光合相关酶类的功能受到了影响。另外,根据信号转导具有多途径交互作用的特性,也可能PLD直接参与干旱胁迫下光合作用的调节,即可能存在PLD参与调控某种光合作用关键酶类活性的信号途径。具体哪一种为关键作用机理,尚待进一步揭示。PLD抑制下,抗氧化酶POD活性显著降低,细胞膜离子渗漏率升高,表明PLD通过调控抗氧化酶活性影响细胞膜稳定性进而调节植物的抗旱性。
Ghars等在小盐芥/盐芥(/)上研究发现,重度盐胁迫(400mM NaCl或400mM甘露醇)下,PLD对脯氨酸积累有正向作用,但在未胁迫情况下无作用[35]。脯氨酸的积累是植物应答胁迫的最重要策略之一,它已被证明在胁迫中作为OH·分解者,通过与其它酶互作,从而保持蛋白质结构和活性,并维持pH和氧化还原平衡,起限制或修复损伤的作用[35]。说明PLD对植物在严重胁迫下抗氧化剂的合成起正向调节作用,这一定程度上支持了本研究“PLD对抗氧化系统的正向调节维持细胞膜稳定性”的结论。
PLD参与信号转导激发植物对干旱胁迫的抗御反应,不是仅依靠单一途径,而是激活多条交互途径构成复杂的信号转导网络[36]。Sang等利用在烟草和拟南芥上获得的PLDα被抑制和过表达的突变体材料证实,PLD参与干旱诱导气孔关闭的过程,即通过气孔调节途径调控植物的抗旱性[15]。本研究在小麦上揭示出PLD参与干旱胁迫下抗氧化系统的激活,减轻活性氧对生物膜脂质的过氧化损伤,即通过抗氧化系统调节途径调控植物的抗旱性,而气孔调节途径与抗氧化系统调节途径均是干旱信号转导网络中的途径。
PLD是多基因家族,不同的PLD同种型特异性地参与不同胁迫信号的转导过程。多种逆境胁迫均诱导ABA的合成,PLDɑ1、PLDδ和PLDɑ3正向调节ABA信号的应答,其中PLDɑ1和PLDδ参与ABA诱导的气孔关闭的正向调节,而PLDɑ3的作用机制不同于前二者,不参与气孔关闭的调节[15,37−38]。盐胁迫下,PLDɑ1、PLDδ、PLDɑ3和PLDε参与应答[7,39−42]。磷缺失下,PLDζ1和PLDζ2正向调节根生长[17,43]。Li等敲除PLDδ后发现植物抗冻性降低,证明PLDδ正向调节植物的抗冻性[16]。本研究中PLD参与干旱胁迫下抗氧化酶POD的激活,保护生物膜的过氧化损伤。但终究是哪一类PLD特异性地参与干旱胁迫诱导POD激活的信号途径尚待进一步揭示。
3.2 结论
采用药理手段对PLD活性进行抑制后,干旱胁迫处理下冬小麦幼苗叶片生长受抑制,净光合速率下降,光合非气孔限制作用加强,抗旱性较对照显著下降,表明跨膜信号转导酶PLD参与冬小麦干旱胁迫的信号转导,抗氧化酶POD活性显著降低,细胞膜离子渗漏率升高,表明PLD通过调控抗氧化酶活性影响细胞膜稳定性进而调节植物的抗旱性。由此揭示出一条PLD介导的干旱信号转导途径:干旱胁迫—PLD激活—POD活性增强—保护膜脂过氧化损伤—提高细胞膜稳定性—植物抗旱性增强。
[1] Sui N,Li M,Meng Q,et al.Photosynthetic characteristics of a super high yield cultivar of winter wheat during late growth period[J].Agricultural Sciences in China,2010,9(3):346-354.
[2] 吕妍,王让会,蔡子颖.我国干旱半干旱地区气候变化及其影响[J].干旱区资源与环境,2009,(11):65-71.
Lv Y,Wang R H,Cai Z Y.Climatic change and influence in arid and semi-arid area of China[J].Journal of Arid Land Resources and Environment,2009,(11):65-71.(in Chinese)
[3] Lincolntaiz,Eduardozeiger.植物生理学[M].北京:科学出版社,2015:618.
Lincolntaiz,Eduardozeiger.Plant physiology[M].Beijing:Science Press,2015:618.(in Chinese)
[4] Urano D,Jones A M.Heterotrimeric G protein-coupled signaling in plants[M].Annual Review of Plant Biology, Merchant S S,2014:65,365-384.
[5] Zheng S,Liu Y,Li B,et al.Phosphoinositide-specificC9 is involved in the thermotolerance of Arabidopsis[J].Plant Journal,2012,69(4):689-700.
[6] Kim Y J,Kim J E,Lee J H,et al.The Vr-PLC3 gene encodes a putative plasma membrane-localized phosphoinositide- specific phospholipase C whose expression is induced by abiotic stress in mung bean (L.)[J].Febs Letters,2004,556(1-3):127-136.
[7] Munnik T,Meijer H J,Ter Riet B,et al.Hyperosmotic stress stimulates phospholipase D activity and elevates the levels of phosphatidic acid and diacylglycerol pyrophosphate[J].Plant Journal,2000,22(2):147-154.
[8] Wang X.Phospholipase D in hormonal and stress signaling[J]. Current Opinion in Plant Biology,2002,5(5):408-414.
[9] Hetherington A M,Woodward F I.The role of stomata in sensing and driving environmental change[J].Nature,2003, 424(6951):901-908.
[10] Wang X,Xu L,Zheng L.Cloning and expression of phosphatidylcholine-hydrolyzing phospholipase D fromL[J].Journal of Biological Chemistry, 1994,269(32):20312-20317.
[11] Sang Y M,Cui D C,Wang X M.Phospholipase D and phosphatidic acid-mediated generation of superoxide in[J].Plant Physiology,2001,126(4):1449-1458.
[12] Distefano A M,Scuffi D,Garcia-Mata C,et al.Phospholipase D delta is involved in nitric oxide-induced stomatal closure[J].Planta,2012,236(6):1899-1907.
[13] Mishra G,Zhang W H,Deng F,et al.A bifurcating pathway directs abscisic acid effects on stomatal closure and opening in[J].Science,2006,312(5771):264-266.
[14] Guo L,Devaiah S P,Narasimhan R,et al.Cytosolic glyceraldehyde-3-phosphate dehydrogenases interact with phospholipase D delta to transduce hydrogen peroxide signals in theresponse to stress[J].Plant Cell,2012,24(5):2200-2212.
[15] Sang Y,Zheng S,Li W,et al.Regulation of plant water loss by manipulating the expression of phospholipase dalpha[J]. Plant Journal,2001,28(2):135-144.
[16] Li W Q,Li M Y,Zhang W H,et al.The plasma membrane- bound phospholipase D delta enhances freezing tolerance in[J].Nature Biotechnology,2004,22(4): 427-433.
[17] Cruz-Ramirez A,Oropeza-Aburto A,Razo-Hernandez F,et al.Phospholipase DZ2 plays an important role in extraplastidic galactolipid biosynthesis and phosphate recycling inroots[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(17):6765-6770.
[18] Li M,Qin C,Welti R,et al.Double knockouts of phospholipases Dzeta1 and Dzeta2 inaffect root elongation during phosphate-limited growth but do not affect root hair patterning[J].Plant Physiology,2006,140(2):761-770.
[19] Hong Y,Devaiah S P,Bahn S C,et al.Phospholipase D epsilon and phosphatidic acid enhancenitrogen signaling and growth[J].Plant Journal,2009,58(3):376-387.
[20] Liljenberg C,Kates M.Changes in lipid composition of oat root membranes as a function of water-deficit stress[J]. Canadian Journal of Biochemistry and Cell Biology,1985, 63(2):77-84.
[21] Moller I M,Jensen P E,Hansson A.Oxidative modifications to cellular components in plants[J].Annual Review of Plant Biology,2007,58:459-581.
[22] Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[23] Turan O,Ekmekci Y.Activities of photosystem II and antioxidant enzymes in chickpea (L.) cultivars exposed to chilling temperatures[J].Acta Physiologiae Plantarum,2011,33(1):67-78.
[24] Jiang M Y,Zhang J H.Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves[J].Journal of Experimental Botany, 2002,53(379):2401-2410.
[25] Zhang J,Kirkham M B.Drought-stress-induced changes in activities of superoxide dismutase,catalase,and peroxidase in wheat species[J].Plant and Cell Physiology,1994,35(5): 785-791.
[26] 毛浩田,陈梦莹,吴楠,等.干旱胁迫对不同倍性小麦和八倍体小黑麦苗期光合能力与抗氧化系统的影响[J].麦类作物学报,2018,(10):1246-1254.
Mao H T,Chen M Y,Wu N,et al.Effects of drought stress on photosynthetic capacity and antioxidant system in wheat with different ploidy levels and octoploid triticale at seedling stage[J].Journal of Triticeae Crops,2018,(10): 1246-1254.(in Chinese)
[27] Alexieva V,Sergiev I,Mapelli S,et al.The effect of drought and ultraviolet radiation on growth and stress markers in pea and wheat[J].Plant Cell and Environment,2001,24(12): 1337-1344.
[28] Devi R,Kaur N,Gupta A K.Potential of antioxidant enzymes in depicting drought tolerance of wheat (L.)[J].Indian Journal of Biochemistry & Biophysics,2012, 49(4):257-265.
[29] Barakat N A M.Oxidative stress markers and antioxidant potential of wheat treated with phytohormones under salinity stress[J].Journal of Stress Physiology & Biochemistry,2011, 7(4):250-267.
[30] Caverzan A,Casassola A,Brammer S P.Antioxidant responses of wheat plants under stress[J].Genetics and Molecular Biology,2016,39(1):1-6.
[31] Hong Y,Zheng S,Wang X.Dual functions of phospholipase dalpha1 in plant response to drought[J].Molecular Plant, 2008,1(2):262-269.
[32] Cakmak I,Marschner H.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase,and glutathione reductase in bean leaves[J].Plant Physiology,1992,98(4):1222-1227.
[33] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2009:298.
Zhang Z L,Ju W J,Li X F.Plant physiology experiment instrument[M].Beijing:Higher Education Press,2009:298.(in Chinese)
[34] 孔祥生,易现锋.植物生理学实验技术[M].北京:中国农业出版社,2008:351.
Kong X S,Yi X F.Plant physiology experimental technology [M].Beijing:China Agriculture Press,2008:351.(in Chinese)
[35] Ghars M A,Richard L,Lefebvre-De Vos D,et al.Phospholipases C and D modulate proline accumulation in/differently according to the severity of salt or hyperosmotic stress[J].Plant and Cell Physiology, 2012,53(1):183-192.
[36] 钟秀丽,崔德才,李玉中.磷脂酶D的细胞信号转导作用[J].植物生理与分子生物学学报,2005,31(5):451-460.
Zhong X L,Cui D C, Li Y Z.The role of phospholipase D in cellular signaling[J].Journal of Plant Physiology and Molecular Biology,2005,31(5):451-460.(in Chinese)
[37] Zhang W,Qin C,Zhao J,et al.Phospholipase D alpha 1-derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling[J].Proc Natl Acad Sci U S A,2004,101(25):9508-9513.
[38] Hong Y,Pan X,Welti R,et al.Phospholipase D alpha 3 is involved in the hyperosmotic response in[J]. Plant Cell,2008,20(3):803-816.
[39] Zhang Q,Lin F,Mao T,et al.Phosphatidic acid regulates microtubule organization by interacting with MAP65-1 in response to salt stress in[J].Plant Cell,2012, 24(11):4555-4576.
[40] Bargmann B O,Laxalt A M,ter Riet B,et al.Multiple PLDs required for high salinity and water deficit tolerance in plants[J].Plant and Cell Physiology,2009,50(1):78-89.
[41] Othman A B,Ellouzi H,Planchais S,et al.Phospholipases Dζ1 and Dζ2 have distinct roles in growth and antioxidant systems inresponding to salt stress[J]. Planta,2017,246(4):721-735.
[42] Katagiri T,Takahashi S,Shinozaki K.Involvement of a novelphospholipase D,AtPLD delta,in dehydration- inducible accumulation of phosphatidic acid in stress signalling[J].Plant Journal,2001,26(6):595-605.
[43] Li M,Welti R,Wang X.Quantitative profiling ofpolar glycerolipids in response to phosphorus starvation.Roles of phospholipases D zeta 1 and D zeta 2 in phosphatidylcholine hydrolysis and digalactosyldiacylglycerol accumulation in phosphorus-starved plants[J].Plant Physiology,2006,142(2): 750-761.
Phospholipase D of Winter Wheat is Involved in Responses to Drought Stress
WANG Ya-jing, ZHANG Xin-ying, HUANG Gui-rong, FENG Fu, ZHONG Xiu-li
(Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences/ Key Laboratory of Dryland Agriculture, Ministry of Agriculture, Beijing 100081)
Phospholipase D (PLD) mediate signaling processes of various hormones and adversities by hydrolyzing phospholipids in cellular membrane and producing phosphotidic acid (PA), a messenger. In order to investigate the roles and pathways of PLD in regulation of the stability of cellular membrane, PEG-6000 was adopted to mimic drought stress, and n-butabol (BA) was applied to inhibit PLD-derived PA. Drought resistance, stability of cellular membrane, antioxidant enzymes of wheat seedlings treated by PEG and PEG added BA were compared. The results showed that inhibition of PLD by BA induced slower seedling growth, lower net photosynthesis rate, higher non-stomatal limitation, higher membrane ion leakage and malonaldehyde (MDA), a peroxidation product, and lower POD activity. The results indicated that PLD played its role in regulating POD activity. Thus, a potential signal transduction pathway under drought stress mediated by PLD was explored: drought stress—activation of PLD—enhancement of POD—impairation of membrane lipids peroxidation damage—improvement of stability of cellular membrane—increasing drought resistance of plants.
Phospholipase D; Drought; Signal transduction; Peroxidation; Antioxidant enzyme; PLD
10.3969/j.issn.1000-6362.2019.04.003
2018−11−25
。E-mail:zhongxiuli@caas.cn
“十三五”国家重点研发计划课题“化肥减施增效共性技术与评价研究(2017YFD0201702)”
王雅静(1994-),女,硕士生,研究方向为作物水分生理生态学。E-mail:wyj8664@126.com
王雅静,张欣莹,黄桂荣,等.磷脂酶D参与冬小麦对干旱胁迫的响应[J].中国农业气象,2019,40(4):222-229
