外源甜菜碱对低温胁迫下紫花苜蓿幼苗生理特性的影响
2019-04-16董文科周学文路旭平马晖玲
董文科, 马 祥, 周学文, 路旭平, 王 佳, 何 娟, 王 岩, 马晖玲*
(1. 甘肃农业大学草业学院,草业生态系统教育部重点实验室, 甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070;2. 青藏高原优良牧草种质资源利用重点实验室,青海省畜牧兽医科学院, 青海 西宁 810016)
紫花苜蓿(Medicagosativa)是栽培面积最广的多年生豆科牧草之一,其品质优良、营养成分丰富、适口性佳且易于栽培,被誉为“牧草之王”[1]。低温胁迫是影响植物正常生长的重要因素,严重时可以引起植株死亡,给农业生产带来严重损失[2]。在我国北方高纬度、高海拔地区,苜蓿受低温影响发生冻害和死亡的现象时常发生,导致苜蓿产量降低,严重限制了苜蓿产业化发展[3-4]。因此,苜蓿的抗寒性和抗寒机理的研究已引起人们的广泛重视。
甘氨酸甜菜碱(glycine betaine,GB,简称甜菜碱)是一种广泛存在于动植物及微生物体内的季铵型水溶性生物碱,是维持细胞稳定的重要渗透调节物质[5]。在逆境条件下,植物体内大量积累甜菜碱,以降低渗透胁迫对细胞膜的损伤,保护三羧酸循环的主要酶活性以及稳定光合作用中多肽的功能等[6-7],从而提高植物适应不良环境的能力。现有研究表明甜菜碱有提高植物抗寒性的作用,低温胁迫可以诱导小麦(Triticumaestivum)、草莓(Fragariaananassa)、大麦(Hordeumvulgare)等作物体内甜菜碱的积累[8-10]。目前,提高植物体内甜菜碱的研究主要有两种方式,一是利用转基因技术将甜菜碱合成酶基因导入植株体内,筛选获得抗逆性较强的转基因植株;二是通过叶面喷施或根部浇灌外源甜菜碱,提高植物抗逆能力[11-12]。由于转基因技术其稳定性和安全性仍存在较大争议,因此外源甜菜碱的研究和应用显得尤为重要。研究表明,外源甜菜碱易于被植物叶片或根系吸收,且不易被快速降解[12],因此通过施加外源甜菜碱提高植物抗寒能力是一种切实可行的手段之一。目前对于提高苜蓿抗寒能力的研究主要在改良栽培措施和施肥方式方面[13-14],施加外源甜菜碱能否有效提高苜蓿的抗寒性的研究均鲜见报道。为此,本研究选取抗寒性较弱的‘甘农5号’紫花苜蓿为材料,研究叶施和根施不同浓度的甜菜碱对低温胁迫下苜蓿幼苗抗逆相关指标以及内源甜菜碱积累的影响,旨在为甜菜碱在苜蓿抗寒性的研究与应用中提供有益参考。
1 材料与方法
1.1 试验材料
本实验于2017年9月-11月在甘肃农业大学草业学院培养室中进行。供试材料为‘甘农5号’紫花苜蓿(MedicagosativaL ‘Gannong No.5’),该品种具有产量高、高抗蚜虫兼抗蓟马等特点,对寒冷环境的耐受性较差,属于非秋眠类型[15],由甘肃省农业科学院提供。外源甜菜碱购自上海源叶生物科技有限公司。
1.2 试验设计
选取颗粒饱满、大小一致的苜蓿种子,经20 % NaClO消毒后,均匀播种在含营养土(营养土∶蛭石=2∶1)的育苗钵(直径25 cm×高度20 cm)中,每个处理6盆。在人工培养箱内培养,昼夜温度为25(±1)℃;时长为白天16 h,夜晚8 h;光照强度为6 000 lx;相对湿度50~70%。待苜蓿幼苗长至20 cm左右时,每盆选取长势一致的5株幼苗定植并进行下一步试验。
试验共设置6个外源甜菜碱浓度,即0 (清水对照CK0),10,20,30,40,50 mmol·L-1和2种施加方式,即叶面施加和根部施加,同时设置常温对照(CK),共13个处理。叶面施加时在外源甜菜碱溶液中加入0.1% Tween-20,以所有叶片均喷施到溶液并且液体自然滴落为止,每株约50 mL,根部施加外源甜菜碱时,使用注射器将外源甜菜碱溶液均匀的注于苜蓿幼苗根部周围,每株约50 mL,常温对照(CK)以等体积的蒸馏水代替;连续施加3 d后,将各处理的育苗钵放置在4℃的低温光照培养箱中进行低温处理,除温度外其他培养条件同前,常温对照(CK)为25(±1)℃,处理7 d后取样和测定分析。
1.3 测定指标及方法
1.3.1株高、根长及干重测定 随机从各处理中选取10株苜蓿幼苗,测量幼苗从地面到植株最高部位的绝对高度;用去离子水将根系冲洗干净,测量根基部到根尖的长度;测量结束后,将苜蓿幼苗按地上部和地下部分开,吸干表面水分,放入烘箱105℃杀青30 min,65℃烘干至恒重后用电子天平称重。
1.3.2叶绿素含量测定 采用乙醇提取法测定[16]。
1.3.3可溶性糖和脯氨酸含量测定 可溶性糖(soluble sugar,SS)含量采用蒽酮比色法测定[16];游离脯氨酸(proline,Pro)含量采用茚三酮显色法测定[16]。
1.3.4相对电导率和丙二醛含量测定 叶片相对电导率采用电导仪法[16]测定;丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸(thiobarbituric acid,TBA)显色法[16]测定。
1.3.5抗氧化酶活性测定 粗酶液的提取,称取苜蓿幼苗叶片0.5 g放入研钵中,加入液氮研磨组织破碎后加入2 mL预冷的磷酸缓冲液和2% PVP(polyvinyl pyrrolidone)充分研磨,然后转入离心管中,用2 mL缓冲液充分清洗研钵,转入离心管中,4℃下15 000 r·min-1离心20 min,所得上清液即为粗酶提取液。将粗酶液分装入各管中进行抗氧化酶的活性和抗氧化物质含量测定。超氧化物歧化酶(superoxide dismutase,SOD)采用氮蓝四唑显色法(nitro blue tetrazolium chloride mono-hydrate,NBT)测定[16];过氧化氢酶(catalase,CAT)活性采用紫外比色法测定[16];过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定[16];抗坏血酸过氧化物酶(ascorbate perxidase,APX)活性的测定参照Nakano等[17]的方法。
1.3.6非酶抗氧化物质含量测定 粗酶液提取同1.3.5。脱氧抗坏血酸(reduced ascorbic acid,AsA)测定参照Jin等[18]的方法;氧化型谷胱甘肽(oxidized glutathione,GSH)参照Gossett等[19]的方法测定。
1.3.7内源甜菜碱含量和甜菜碱醛脱氢酶(betaine aldehyde dehydrogenase,BADH)活性测定 内源甜菜碱含量测定参照杨双龙等[20]的方法;BADH酶活性参照Yang等[21]的方法测定。
1.4 数据分析
SPSS 19.0软件进行统计分析,采用单因素ANOVA进行分析处理,Duncan’s新复极差法进行显著性方差分析;采用Microsoft Excel 2010进行绘图与数据处理。应用模糊数学中隶属函数值法,对各处理紫花苜蓿幼苗与抗寒性相关的生理指标进行综合分析。隶属函数公式为:
指标性状与抗寒性呈正相关时,公式为:U(Xi)=(Xi-Xmin)/(Xmax-Xmin)
指标性状与抗寒性呈负相关时,公式为:U(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
式中,U(Xi)是隶属函数值;Xi为某一处理水平某指标测定值;Xmax和Xmin为所有参试水平系中某一指标中的最大值和最小值。最后将每个处理各抗寒指标的隶属函数值相加,求出平均值(D值),进行抗寒性排序。
2 结果与分析
2.1 低温胁迫下外源甜菜碱对紫花苜蓿幼苗生长的影响
低温胁迫抑制了苜蓿幼苗的正常生长,外源甜菜碱浓度为0 mmol·L-1(CK0)时的幼苗株高、根长、地上及地下部分干重均显著低于CK(P<0.05),分别为CK的85.65%,71.08%,68.64%和50.40%(图1)。与CK0相比,叶施30 mmol·L-1的外源甜菜碱时对株高、根长和地上部分干重在低温胁迫下的缓解作用最强,分别较CK0处理提高了14.16%,33.75%和42.82%;叶施40 mmol·L-1的外源甜菜碱时对地下部分干重胁迫的缓解作用最强,较CK0处理提高69.84%。
与CK0相比,根施30和40 mmol·L-1的外源甜菜碱对株高胁迫的缓解作用最强,较CK0处理提高了10.45%和10.50%;根施40 mmol·L-1的外源甜菜碱对根长胁迫的缓解作用最强,较CK0处理提高了12.30%;根施外源甜菜碱对地上部分干重胁迫的缓解作用和对株高胁迫的缓解作用相似,在外源甜菜碱浓度为30 mmol·L-1和40 mmol·L-1处理时缓解作用最强,较CK0处理提高了32.76%和33.05%;对地下部分干重胁迫的缓解作用随根施外源甜菜碱浓度增加而逐渐增强,在本试验最大浓度50 mmol·L-1处理时缓解效果最好,较CK0处理提高了82.54%。
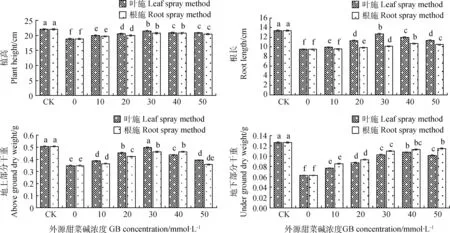
图1 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗生长特性的影响Fig. 1 Effects of exogenous glycine betaine with different concentrations on growth characteristics of alfalfa seedlings under low-temperature stress注:同一喷施处理不同浓度下小写字母表示在0.05水平上差异显著。下同Note:Different lowercase letters in same treatment and different concentrations indicate significant difference at the 0.05 level. The same as below
2.2 低温胁迫下外源甜菜碱对紫花苜蓿幼苗叶绿素含量的影响
由图2可知,在低温胁迫下CK0处理的叶绿素a、叶绿素b及叶绿素a+b含量和叶绿素a/b的值均显著低于CK(P<0.05),分别较CK下降了43.01%,38.01%,41.08%和9.32%,说明低温胁迫抑制了苜蓿幼苗叶片叶绿素的合成和积累。叶施不同浓度甜菜碱时,叶绿素a、叶绿素b及叶绿素a+b含量随甜菜碱浓度的增加呈先升后降的趋势,在30和40 mmol·L-1的浓度时对低温抑制的缓解作用最强,较CK0相比,对叶绿素a含量最大提高了34.04%,对叶绿素b含量最大提高了55.66%,对叶绿素a+b含量最大提高了50.96%;对于叶绿素a/b的值随外源甜菜碱浓度的增加呈逐渐上升的趋势,当外源甜菜碱浓度为50 mmol·L-1时叶绿素a/b的值达到最大。
根施外源甜菜碱对低温胁迫下苜蓿幼苗叶片的叶绿素a、叶绿素b及叶绿素a+b的合成和积累也具有一定促进作用,且随甜菜碱浓度的增加呈逐渐上升的趋势,均在50 mmol·L-1处理时达到最大,分别较CK0提高了49.03%,48.11%和49.43%;对于叶绿素a/b的值随外源甜菜碱浓度的增加呈先上升后下降的趋势,当浓度为10和20 mmol·L-1时,由于和CK0相比对叶绿素a的合成与积累有显著的促进作用,而对叶绿素b的影响不显著,导致叶绿素a/b的值达各处理最大,且两浓度处理差异不显著;当浓度为30~50 mmol·L-1时,对叶绿素b的合成与积累作用的增强,使叶绿素a/b的值逐渐降低。
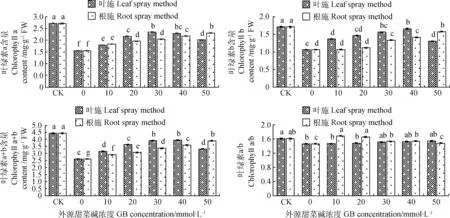
图2 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗叶绿素含量的影响Fig. 2 Effects of exogenous glycine betaine with different concentrations on chlorophyll content of alfalfa seedlings under low-temperature stress
2.3 低温胁迫下外源甜菜碱对紫花苜蓿幼苗渗透调节物质含量的影响
由图3可知,在CK0处理下,苜蓿幼苗叶片SS和Pro含量分别比CK提高了30.87%和66.60%,与CK差异显著。叶施甜菜碱时,SS和Pro的含量随甜菜碱浓度的增加而呈先上升后下降的趋势,均在40 mmol·L-1处理时达到最大,分别较CK0提高了53.76%和91.32%。当根施外源甜菜碱浓度为20~50 mmol·L-1时,SS和Pro的含量呈逐渐上升趋势,当浓度为50 mmol·L-1时两种物质含量达到最大,分别比CK0提高了37.37%和77.94%,与CK0差异显著。

图3 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗渗透调节物质含量的影响Fig. 3 Effects of exogenous glycine betaine with different concentrations on osmotic adjustment substance content of alfalfa seedlings under low-temperature stress
2.4 低温胁迫下外源甜菜碱对紫花苜蓿幼苗叶片相对膜透性和MDA含量的影响
由图4可知,与CK0相比,叶施外源甜菜碱可以显著降低幼苗叶片相对膜透性和MDA含量,并随外源甜菜碱浓度的增加呈先下降后上升的趋势,其中30 mmol·L-1处理时对低温胁迫的缓解作用最强,分别较CK0降低了23.09%和50.00%。当根施外源甜菜碱浓度为20~50 mmol·L-1时,叶片相对膜透性呈逐渐下降的趋势,当浓度为50 mmol·L-1时叶片相对膜透性最低,与CK0相比降低了21.32%;而MDA含量随外源甜菜碱浓度的增加呈先下降后上升的趋势,在40 mmol·L-1处理时MDA含量最低,与CK0相比降低了20.00%。
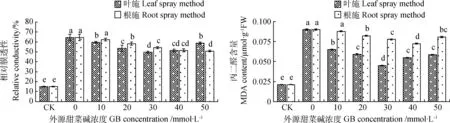
图4 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗叶片相对电导率和MDA含量的影响Fig. 4 Effects of exogenous glycine betaine with different concentrations on relative conductivity and MDA content of alfalfa seedlings under low-temperature stress
2.5 低温胁迫下外源甜菜碱对紫花苜蓿幼苗抗氧化系统的影响
2.5.1对SOD 活性的影响 叶施和根施外源甜菜碱处理的叶片SOD活性均显著高于CK0,说明10~50 mmol·L-1的甜菜碱可以促进叶片SOD活性,减少活性氧损伤,增强抗氧化能力,两种外施方式下叶片SOD活性随外源甜菜碱浓度的增加而均呈先上升后下降的趋势,其中叶施20 mmol·L-1和30 mmol·L-1的甜菜碱时SOD活性最大,与CK0处理相比,分别提高了104.15%和115.81%;对根施而言,30 mmol·L-1和40 mmol·L-1的甜菜碱处理时SOD活性最大,与CK0处理相比,分别提高了52.87%和51.75% (图5)。
2.5.2对POD活性的影响 与CK0相比,叶施和根施外源甜菜碱处理均显著提高了低温胁迫下叶片POD活性,说明外源甜菜碱可以通过增强叶片POD活性提高苜蓿幼苗抗氧化能力,缓解低温冷害损伤。叶施30 mmol·L-1和40 mmol·L-1的甜菜碱时POD活性最大,与CK0处理相比,分别提高了50.38%和51.17%;根施40 mmol·L-1和50 mmol·L-1的甜菜碱处理时POD活性最大,与CK0处理相比,分别提高了28.20%和25.78% (图5)。
2.5.3对CAT活性的影响 由图5可知,叶施外源甜菜碱时CAT活性随浓度的增加呈先上升后下降的趋势,在40 mmol·L-1的处理时活性最强,与CK0相比提高了374.38%;根施40 mmol·L-1和50 mmol·L-1的甜菜碱时CAT活性最强,较CK0提高了263.75%和264.38%。
2.5.4对APX活性的影响 由图5可知,CK0处理与CK相比,幼苗叶片APX活性显著增强(P<0.05)。与CK0相比,叶施和根施不同浓度甜菜碱均使幼苗叶片APX活性显著增强。叶施外源甜菜碱时APX活性随浓度的增加呈先上升后下降的趋势,在40 mmol·L-1的处理时活性最强,与CK0相比提高了38.73%;根施外源甜菜碱时APX活性呈逐渐上升的趋势,在40 mmol·L-1的处理时活性最强,与CK0相比提高了28.87%。
图5 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗抗氧化酶活性的影响Fig. 5 Effects of exogenous glycine betaine with different concentrations on antioxidant enzyme activity of alfalfa seedlings under low-temperature stress
2.6 低温胁迫下外源甜菜碱对紫花苜蓿幼苗还原性抗坏血酸(AsA)和还原性谷胱甘肽(GSH)的影响
由图6可知,叶施外源甜菜碱时AsA和GSH含量随浓度的增加呈先上升后下降的趋势,均在40 mmol·L-1的处理时达到最大值,两种物质含量较CK0分别提高了85.02%和33.47%;根施外源甜菜碱时AsA和GSH含量随浓度的增加呈逐渐上升的趋势,均在50 mmol·L-1的处理时达到最大值,两种物质含量较CK0分别提高了61.53%和29.32%。

图6 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗AsA和GSH含量的影响Fig. 6 Effects of exogenous glycine betaine with different concentrations on AsA and GSH contents of alfalfa seedlings under low-temperature stress
2.7 低温胁迫下外源甜菜碱对紫花苜蓿幼苗内源甜菜碱积累的影响
2.7.1对甜菜碱含量的影响 由图7可知,叶施外源甜菜碱时内源甜菜碱含量随浓度的增加呈先上升后下降的趋势,在40 mmol·L-1的处理时含量最高,与CK0相比提高了6.99倍;根施外源甜菜碱时内源甜菜碱含量随浓度的增加呈逐渐上升的趋势,在50 mmol·L-1的处理时含量最高,与CK0相比提高了3.21倍。
2.7.2对BADH活性的影响 由图7可知,CK0处理下苜蓿幼苗叶片的BADH活性与CK差异不显著。而叶施和根施不同浓度的外源甜菜碱对苜蓿幼苗叶片的BADH活性均有提高,且变化趋势与内源甜菜碱含量的变化基本一致。叶施40 mmol·L-1外源甜菜碱时BADH活性最高,与CK0相比提高了55.65%;根施外源甜菜碱以50 mmol·L-1的处理时活性最高,此时叶片BADH活性比CK0提高了15.32%。
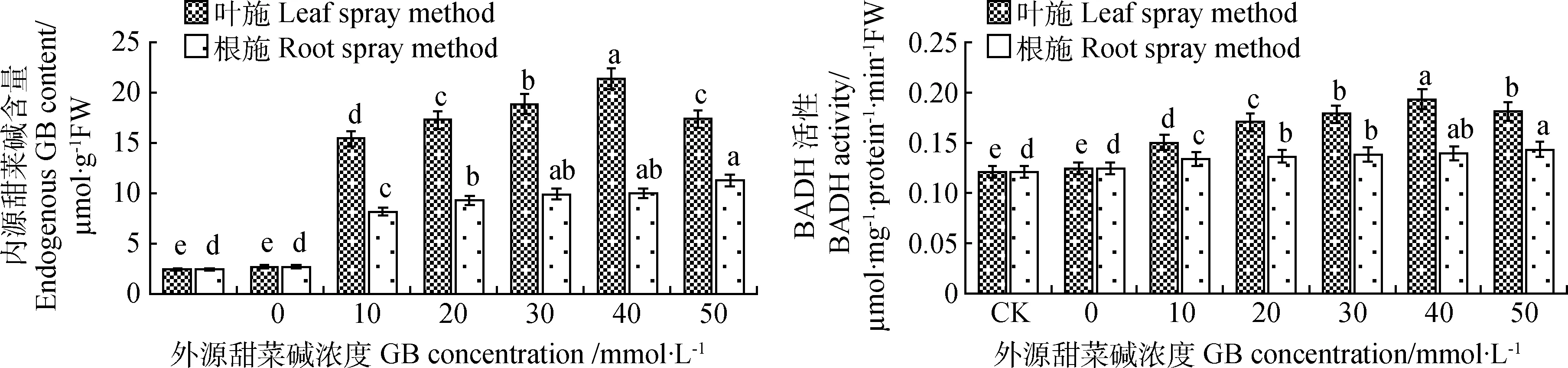
图7 不同浓度外源甜菜碱对低温胁迫下紫花苜蓿幼苗内源甜菜碱含量和BADH活性的影响Fig. 7 Effects of exogenous glycine betaine with different concentrations on endogenous glycine betaine content and BADH activity of alfalfa seedlings under low-temperature stress
2.8 隶属函数均值抗寒性分析
采用模糊隶属函数法对所测的19个生理指标进行计算分析,综合评价不同施加方式和不同浓度甜菜碱处理缓解低温胁迫的能力。如表1所示,叶施外源甜菜碱对缓解低温胁迫的能力为30 mmol·L-1>40 mmol·L-1>50 mmol·L-1>20 mmol·L-1>10 mmol·L-1>0 mmol·L-1;根施外源甜菜碱对缓解低温胁迫的能力为40 mmol·L-1>50 mmol·L-1>30 mmol·L-1>20 mmol·L-1>10 mmol·L-1>0 mmol·L-1。由此可知,叶施30 mmol·L-1和根施40 mmol·L-1的外源甜菜碱对缓解苜蓿幼苗低温胁迫的效果最佳。
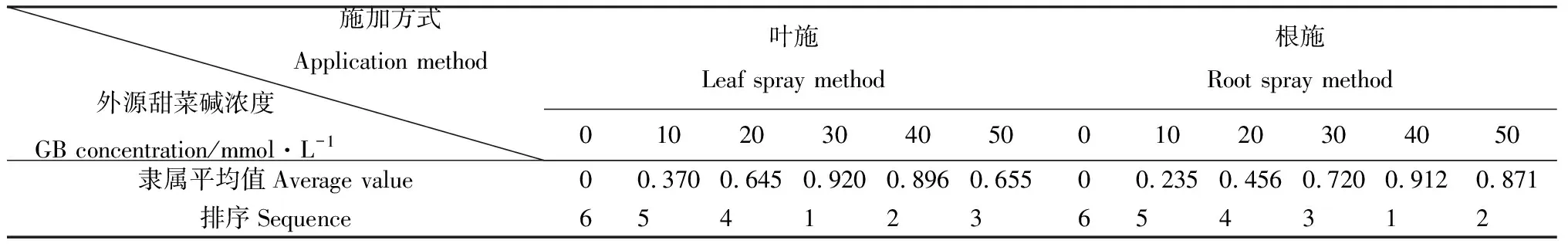
表1 抗寒指标隶属函数值及综合评价Table 1 Subordinate function value and comprehensive evaluation of chilling resistance index
3 讨论
温度是植物生长发育的关键环境因素之一,低温胁迫会抑制植物株高、根长及生物量的积累[22]。杨德光等对玉米的研究中发现,低温胁迫对玉米幼苗株高、根长、地上和地下生物量均有影响[23]。陈胜萍等研究发现,番茄幼苗株高、茎粗、根长、干物质4个生长指标随温度的降低而减少[24]。叶和根是植物光合作用和营养物质运输的主要器官,可见低温胁迫会造成各植物器官发育延缓,植物代谢速度降低,光合速率下降,进而影响生物量的积累。本试验结果表明,低温胁迫明显抑制了苜蓿幼苗的生长,且经低温处理的幼苗,其株高、根长及地上和地下部分干重均显著低于正常水平下生长的幼苗。叶施和根施外源甜菜碱对低温胁迫下幼苗株高、根长及地上和地下部分干重均有明显增加,说明外源甜菜碱能够缓解低温胁迫对幼苗生长的抑制作用。这与前人研究表明施加外源甜菜碱可以显著缓解低温胁迫对植物的伤害,增加植物株高、根长及生物量的结果一致[25-26]。这可能是由于甜菜碱提高了叶片光合作用效率和新陈代谢强度,从而缓解了低温胁迫对生物量积累的抑制作用。
光合作用是植物最基本且最重要的代谢过程,是植物合成有机质和转化能源的根本途径,它对植物生长及其抗逆性都具有十分重要的意义。叶绿素是植物光合作用中最重要的物质之一,也是反映叶片损伤程度最直接的指标之一[27]。崔翠等研究发现,低温胁迫后烤烟幼苗叶绿素a、叶绿素b和叶绿素a+b含量均显著下降,光合能力降低,导致净光合速率、气孔导度、蒸腾速率等显著下降,并且多数叶绿素相关基因处于下调[28]。王宁等研究发现,温度急剧下降时,叶绿素合成受到阻碍,光合色素和叶绿体结构受到破坏,导致樟树叶绿素a、叶绿素b和叶绿素总量快速下降[29]。本试验结果也表明,低温胁迫下苜蓿幼苗叶绿素a、叶绿素b及叶绿素a+b含量和叶绿素a/b的值均显著低于对照。研究表明,甜菜碱在叶绿体中含量较为丰富,可以在逆境胁迫下保护类囊体膜结构,维持光系统Ⅱ复合体蛋白的稳定性,从而保持较高的光合速率[30-31]。此外,甜菜碱还能维持逆境条件下植物叶绿体体积,增加叶绿素a/b的值,降低类胡萝卜素和叶绿素的比值,保持Ca2+-ATPase活性和希尔反应活力,以维持植物的光合能力[32-33]。梁小红等研究发现,在低温条件下通过外施100 mmol·L-1的外源甜菜碱可以阻止结缕草叶绿素含量的下降,缓解低温胁迫对植物光合作用的抑制[34]。本试验中,叶施30,40 mmol·L-1和根施50 mmol·L-1外源甜菜碱能显著缓解低温胁迫下苜蓿幼苗叶绿素含量的降低,说明外源甜菜碱可以保护苜蓿叶绿体结构不受低温损伤,从而使苜蓿幼苗的叶绿素含量保持较高水平。
SS和Pro是植物体内两种重要的渗透调节物质,低温胁迫下,植物体内SS和Pro含量增加,从而提高了细胞内束缚水的含量,增大了胞液浓度,降低胞液渗透压,防止细胞因脱水而死亡,减缓低温胁迫对植物的损伤[35]。徐锦海等研究发现,低温胁迫后水稻幼苗SS和Pro含量显著下降,但经外源甜菜碱处理后幼苗体内SS和Pro含量得到显著提高,缓解了低温胁迫对幼苗造成的伤害[36]。本研究也表明,低温胁迫显著增加了苜蓿的SS和Pro含量,并且叶施和根施外源甜菜碱可以进一步增加这两种物质的含量,说明外源甜菜碱能够增强苜蓿幼苗的抗寒能力。这可能是由于外源甜菜碱提高了SS和Pro合成途径中关键酶的活性,促进SS和Pro的合成,增强了苜蓿幼苗的渗透调节能力。植物细胞膜系统是调控细胞内外物质交换的重要部位,也是感受低温胁迫最敏感的部位[37]。相对膜透性和MDA含量是反映细胞膜系统受到伤害程度和膜脂过氧化程度的重要指标[38-39]。本研究表明,低温胁迫下苜蓿幼苗叶片相对膜透性和MDA含量较CK处理显著增加,说明低温胁迫加快了膜脂过氧化程度,破坏了苜蓿叶片的细胞膜系统。甜菜碱不仅是一种渗透调节物质,它还起到防止细胞膜的热变形,降低原生质膜由液晶相变为凝胶相的温度,稳定膜系统完整性的作用[40]。李芸瑛[41]以黄瓜为材料,探究了外源甜菜碱对幼苗抗冷性的影响,结果表明外源甜菜碱处理幼苗可以缓解相对膜透性的增加,抑制MDA合成,通过防止膜脂过氧化加剧,保护了细胞膜系统的稳定性,从而提高黄瓜幼苗抗冷能力。本研究表明,低温胁迫下叶施和根施外源甜菜碱可以显著降低苜蓿的相对膜透性和MDA含量,说明外源甜菜碱能够缓解膜脂过氧化反应,保证了苜蓿细胞膜系统的稳定性和完整性,从而提高了苜蓿抗寒性。
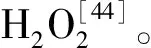
逆境胁迫下,植物内源甜菜碱的积累对于细胞渗透调节作用至关重要。目前,植物内源甜菜碱的积累主要有三种途径:一是在干旱、盐以及低温胁迫下诱导植物内源甜菜碱的积累[53];二是利用转基因技术将甜菜碱合成关键酶基因(如BADH基因)导入植物体内,是植物具备合成内源甜菜碱的能力[11];三是通过化学诱导剂,如通过叶施或根施外源甜菜碱诱导植物内源甜菜碱的合成与积累[12]。李茂福等研究发现,低温胁迫和外源甜菜碱均可以诱导香蕉内源甜菜碱的积累,而外源甜菜碱的诱导效应更加显著[54]。本研究结果表明,仅低温胁迫对苜蓿内源甜菜碱的积累无显著的诱导效果,这可能是由于苜蓿品种差异或自身甜菜碱合成途径较少所导致;而叶施和根施外源甜菜碱可以显著提高苜蓿内源甜菜碱含量,这可能是因为外源甜菜碱能被迅速转移到植物各组织器官中,导致苜蓿内源甜菜碱的积累。甜菜碱醛脱氢酶(BADH)是植物内源甜菜碱合成的关键酶之一[7],植物内源甜菜碱的合成主要是在叶绿体中进行,而BADH主要分布在叶绿体和细胞质中[55]。BADH酶活性受逆境胁迫诱导显著,有学者认为调控BADH的基因可能有两种,即诱导型和组成型,并且在海榄雌中发现这两种不同的BADH基因[56]。也有研究报道,低温胁迫下外源甜菜碱对香蕉叶片内源甜菜碱的积累主要不是通过渗透,而是通过诱导BADH活性促进叶片内源甜菜碱的合成与积累[57]。本研究发现,叶施外源甜菜碱可以有效提高BADH活性,并且其变化趋势和内源甜菜碱含量基本一致;而根施外源甜菜碱虽然也可以提高BADH活性,但提升幅度低于叶施处理。这可能是因为叶施时外源甜菜碱更易被转运至叶绿体中,促进了BADH活性,从而提高了内源甜菜碱的合成与积累;而根施时,外源甜菜碱转运到叶绿体的过程较为缓慢且存在损失,因此导致BADH活性和内源甜菜碱含量均低于叶施处理。
4 结论
本研究表明,叶施和根施外源甜菜碱均能有效缓解低温胁迫下苜蓿幼苗株高、根长、地上及地下生物量和叶绿素含量的降低,增加可溶性糖(SS)和游离脯氨酸(Pro)的含量,减少叶片相对膜透性和MDA含量的升高,显著提高SOD、POD、CAT和APX的活性以及AsA、GSH含量,并促进了苜蓿幼苗内源甜菜碱的积累和BADH酶活性,缓解了低温胁迫对苜蓿幼苗光合作用的抑制,增强了渗透调节能力,保护了细胞膜结构的稳定性,提高了抗氧化代谢能力,进而提高苜蓿幼苗对低温胁迫的抗性。其中,叶施30 mmol·L-1和根施40 mmol·L-1的外源甜菜碱对缓解苜蓿幼苗低温胁迫的效果最佳。
