干扰整合素转接激酶表达对口腔鳞癌细胞迁移侵袭影响研究
2019-04-12宋玮华刘月华
宋玮华 刘月华 关 超 李 强
口腔鳞癌是一种发生于口腔的常见恶性肿瘤,据统计在所有的口腔癌患者中有80%为口腔鳞癌,其在世界范围内的发生率仍然呈现逐年上升的趋势。随着医学的不断发展,口腔鳞癌的治疗取得了一定的进步,但由于口腔鳞癌具有早期发病隐匿等特点,提高口腔鳞癌患者的生存率仍然是目前研究的热点[1]。随着基因技术的不断发展,靶向基因治疗已经成为癌症治疗的主要研究方向。整合素转接激酶(integrin-linked kinase,ILK)属于丝氨酸/苏氨酸激酶,主要分布于细胞质中[2]。有研究表明,ILK在膀胱癌、舌鳞癌等多种癌症中高表达,具有促进癌细胞的增殖、影响癌细胞的转移的作用[3,4]。本研究通过下调口腔鳞癌细胞中ILK的转录和表达水平,用MTT法、Western blot法等多种实验方法研究沉默ILK对口腔鳞癌细胞转移潜能的影响,为靶向ILK治疗口腔鳞癌提供新的思路。
材料与方法
1.实验材料:ILK多克隆抗体购自于武汉艾美捷生物科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自于北京普利莱基因技术有限公司;基质金属蛋白酶-9(matrix metalloprotease 9,MMP-9)单克隆抗体购自于英国Santa Cruz公司;Lipofectamine 2000、Realtime PCR 试剂盒均购自于美国Invitrogen公司;ILK、GAPDH引物均由上海生工生物公司合成;基质金属蛋白酶-2(matrix metalloprotease 2,MMP-2)单克隆抗体购自于英国Abcam公司;ILK小干扰RNA(ILK siRNA)和小干扰RNA阴性对照(siRNA control)购自于上海吉玛生物制药有限公司;胎牛血清、RPMI1640培养基、胰蛋白酶均购自于美国Gibco公司;口腔鳞癌细胞SCC-25购自于中国科学院细胞库。
2.细胞培养:口腔鳞癌SCC-25细胞培养条件为:37℃,5%CO2培养箱,饱和湿度。细胞培养液用含有10%胎牛血清的RPMI1640。取出保存于液氮中的SCC-25细胞,在37℃融化后,接种到细胞瓶中,观察细胞密度超过90%时,用0.25%的胰蛋白酶消化传代培养。
3.细胞转染及分组:在转染前的24h,将对数生长期的SCC-25细胞以每孔5×104个细胞接种到6孔细胞培养板中。将250μl的Lipofectamine 2000与7.5μl的siRNA control和ILK siRNA分别混合后,在室温条件下孵育20min。加入到6孔细胞培养板中,在37℃,5% CO2培养箱中培养48h。分别将转染siRNA control和ILK siRNA后的SCC-25细胞记为si-NC组和ILK siRNA组,同时以没有转染的SCC-25细胞作为对照组。
4.RT- PCR 检测转染后细胞中ILK mRNA表达:取对照组、si-NC组和ILK siRNA组细胞,培养48h后,按照每两个6孔细胞培养板中的细胞加入1mL Trizol进行裂解。充分裂解后,加入1/5裂解液体积的氯仿溶液,混合后,12000r/min,4℃离心10min。吸取上层水相溶液,加入1/2体积的异丙醇,在室温条件下静置15min,4℃离心10min,12000r/min,将上清液吸除后,加入1ml的75%的乙醇洗涤RNA两次后,放在室温环境下干燥,用无RNase的水溶解RNA,紫外分光光度计检测RNA浓度。反转录合成cDNA,按RT-PCR 试剂盒说明书检测ILK水平,每组设置5个复孔,实验重复3次。反应程序为:95℃,5min;95℃,15s;65℃,35s,40个循环周期。ILK上游引物:5′-GACGACATTTTCACTCAGTGCC-3′,下游引物:5′-ACGGTTCATTACATTGATCCGTG-3′。GAPDH上游引物:5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游引物:5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。
5.Western blot法检测转染后细胞中ILK蛋白表达:取对照组、si-NC组和ILK siRNA组细胞,加入1ml的裂解液,在冰上裂解20min后,吸取匀浆液到离心管中,超声后,9000r/min,离心10min,吸取上清液,用BCA法对蛋白样品进行定量检测。按照蛋白样品:5×Loading Buffer=5∶1的体积比例混合后,煮沸3min。按照每孔加入50μl的样品进行蛋白电泳,电泳电压为120V恒压。转膜:300mA,转膜70min。在5% 脱脂奶粉中封闭60min,与1∶1000倍稀释的一抗在4℃过夜反应后,1∶2000倍稀释的二抗在室温反应60min。显色后,以目的蛋白灰度值÷GAPDH灰度值表示蛋白水平,实验重复3次,取均值。
6.MTT检测细胞增殖:取对照组、si-NC组和ILK siRNA组细胞,接种到96孔板中,每孔加入103个细胞,培养48h。在每孔中加入MTT溶液20μl(5mg/ml),在37℃孵育4h后,弃去上清液,加入150μl的二甲基亚砜溶液,摇床反应10min。酶标仪分析570nm的吸光度值(A值)。每组设置6个复孔,实验重复3次。分别按照下面的公式计算分析各组细胞的存活率。ILK siRNA组或si-NC组存活率(%)=(ILK siRNA组或si-NC组A值÷对照组A值)×100%。
7.Transwell小室检测细胞侵袭:在侵袭实验前在6孔Transwell小室中加入基质胶在37℃孵育30min。将对照组、si-NC组和ILK siRNA组细胞用无血清的培养液配制成5×104个/毫升的细胞悬浮液。取1ml的含血清细胞培养液加入到下室中,同时在上室中添加2ml的上述细胞悬液。培养48h后,用棉签把没有穿膜的细胞擦掉,用乙醇固定20min,结晶紫染色后,在显微镜下随机选取5个视野进行细胞计数,实验重复3次,取均值。
8.细胞划痕实验检测细胞迁移:取对照组、si-NC组和ILK siRNA组细胞,接种到6孔细胞培养板中,每孔中加入2×104个细胞。培养24h后,取移液枪枪头,在长满细胞的瓶壁上小心的划出一条细痕,再加入磷酸盐缓冲液(phosphate buffered saline,PBS)将划下来的细胞洗掉后,继续培养48h。分别在0h和48h观察划痕宽度。每组设置3个复孔,实验重复3次,取均值。迁移率(%)=100%×(0h宽度-48h宽度)÷0h宽度。
9.Western blot法测定各组MMP-2、MMP-9蛋白水平:分别取上述的对照组、si-NC组及ILK siRNA组细胞,培养48h后,检测MMP-2和MMP-9蛋白水平。

结 果
1.转染后细胞中ILK表达检测结果:结果见表1、图1中所示,对照组、si-NC组、ILK siRNA组ILK mRNA水平依次为1.02±0.08、0.99±0.11、0.45±0.04,蛋白水平依次为0.45±0.05、0.46±0.07、0.18±0.03。si-NC组ILK mRNA水平及ILK 蛋白水平同对照组比较,差异无统计学意义(tmRNA=0.382,PmRNA=0.722,t蛋白= 0.201,P蛋白=0.850)。ILK siRNA组ILK mRNA水平及ILK 蛋白水平较对照组和si-NC组明显下降(tmRNA=11.038、7.991,PmRNA=0.000、0.001,t蛋白=8.020、6.368,P蛋白=0.001、0.003)。

表1 转染后的口腔鳞癌SCC-25细胞中ILK mRNA和蛋白水平

图1 转染后细胞中ILK表达
2.细胞增殖检测结果:对照组、si-NC组、ILK siRNA组细胞存活率依次为:99.94%±7.35%、100.01%±6.98%、52.64%±2.06%(F=62.829,P=0.000)。si-NC组细胞存活率与对照组比较,差异无统计学意义(t存活率= 0.012,P存活率=0.991)。ILK siRNA组细胞存活率明显低于对照组和si-NC组,差异有统计学意义(t存活率=10.733、11.274,P存活率=0.000、0.000)。
3.细胞侵袭迁移检测结果:结果见图2中所示,对照组、si-NC组、ILK siRNA组细胞迁移率依次为45.32%±5.25%、46.02%±4.10%、16.87%±3.72%,侵袭细胞数目依次为136.69±12.54、138.25±11.05、62.38±8.64。si-NC组细胞迁移率、侵袭细胞数目与对照组比较差异无统计学意义(t迁移率=0.182,P迁移率=0.864,t侵袭数目=0.162,P侵袭数目=0.879)。ILK siRNA组口腔鳞癌细胞的迁移率和侵袭细胞的数目都低于对照组和si-NC组(t迁移率=7.658、9.120,P迁移率=0.002、0.001 ,t侵袭数目= 8.452、9.369,P侵袭数目=0.001、0.001)。

图2 细胞迁移和侵袭结果(×40)
4.细胞中MMP-2、MMP-9表达检测结果:结果见图3中所示,对照组、si-NC组、ILK siRNA组MMP-2水平依次为0.25±0.05、0.26±0.04、0.08±0.01,MMP-9水平依次为0.43±0.08、0.42±0.09、0.09±0.02。si-NC组MMP-2、MMP-9与对照组比较差异无统计学意义(tMMP-2= 0.271,PMMP-2=0.800,tMMP-9=0.144,PMMP-9=0.893)。ILK siRNA组MMP-2、 MMP-9明显低于对照组和si-NC组,差异有统计学意义(tMMP-2=5.775、7.562,PMMP-2=0.005、0.002,tMMP-9=7.141、6.200,PMMP-9=0.002、0.003)。ILK表达下调能够抑制口腔鳞癌SCC-25细胞中MMP-2、MMP-9的表达。
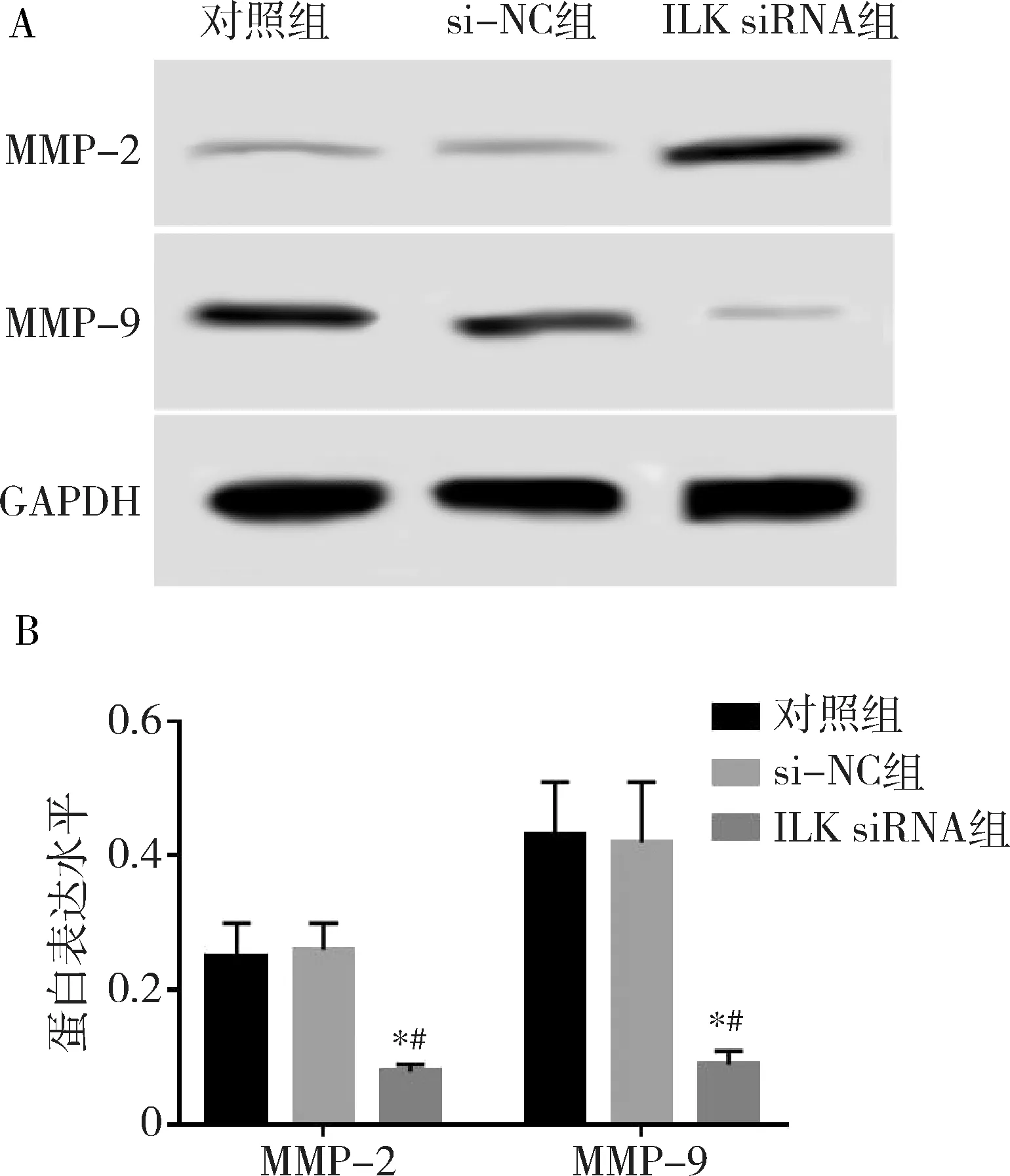
图3 MMP-2、MMP-9表达水平
讨 论
ILK是一种较为保守的细胞内信号相关蛋白,其主要通过调控丝氨酸/苏氨酸活性影响细胞的生长过程,参与肿瘤的发生和发展[5,6]。安阳等[7]通过检测89例肝细胞肝癌患者癌组织及65例正常肝组织中ILK表达发现,ILK在肝癌中的表达水平升高。朱向阳等[8]研究表明,宫颈癌组织中ILK的阳性率高达86%,而正常的宫颈组织中ILK的阳性率仅有23%。魏寅生[9]通过RT-PCR和Western blot法分别检测膀胱癌组织和癌旁组织中ILK mRNA和蛋白表达水平发现,ILK在膀胱癌中表达上调,而干扰ILK表达后,膀胱癌细胞T24凋亡增多,增殖、迁移、侵袭及黏附能力均下降。Que等[10]研究表明,下调ILK表达后,舌鳞癌细胞凋亡增加,同时细胞中上皮间质相关蛋白表达也发生改变, 以上的研究报道提示ILK在癌症组织中表达上调,并且能够调控癌细胞的生长过程。本研究结果显示,干扰ILK表达后的口腔鳞癌细胞增殖受到抑制,侵袭能力下降,迁移能力也明显下降, 这与之前的研究报道相符合,说明在口腔鳞癌细胞中干扰ILK同样能够抑制肿瘤生长和转移,对口腔鳞癌没有发现特异性。
相关调控机制研究表明,ILK参与调控癌细胞生长、转移、侵袭等功能有多种途径,如管永昱等研究表明,ILK在口腔鳞状细胞癌中高表达,可能通过促进肿瘤血管生成,促进肿瘤细胞浸润和转移[11]。动物实验表明,沉默ILK后能够有效抑制人舌鳞癌细胞在体内的转移和增殖能力,其作用机制可能是通过抑制与EMT相关蛋白表达、调控ILK/Akt/GSK3β/Snail通路[12]。癌细胞的侵袭和迁移是癌症转移的基础,是一个极为复杂的过程,受到多种基因和蛋白的共同调控作用。癌细胞通过分泌降解外基质的蛋白酶,进入淋巴管和微血管循环,进而转移到正常的组织和器官中,引起癌症的转移[13~16]。赵明静等[17]研究证实,ILK过表达可通过调控NF-κB途径介导MMP-9表达上调,从而促进肺癌细胞侵袭和迁移。基质金属蛋白酶家族在细胞外基质降解过程中具有重要作用,其至少含有26个家族成员,其中MMP-2、MMP-9是降解Ⅳ型胶原酶的主要蛋白酶,而在细胞外基质中Ⅳ型胶原酶含量最多[18,19]。宋清源等[20]研究表明,沉默MMP-2后,卵巢癌细胞OVCAR-3的侵袭细胞数目从140减少至99,迁移距离从187μm减少至120μm。薄惠等[21]发现黄芩素处理后的口腔鳞状细胞癌细胞中MMP-2蛋白水平降低,细胞的转移能力也下降。本研究结果显示,干扰ILK表达下调口腔鳞癌细胞中MMP-2和MMP-9蛋白水平,证实下调ILK可以通过下调MMP-2和MMP-9发挥抗口腔鳞癌细胞迁移和侵袭的作用。
以上研究表明,沉默ILK可能通过下调细胞中MMP-2和MMP-9的表达,发挥抗口腔鳞癌细胞侵袭及迁移的作用,并且可以在体外降低口腔鳞癌细胞的增殖活性。这为靶向ILK治疗口腔鳞癌提供了理论基础。本研究只在体外进行了细胞实验,存在一定的局限性,后续会在体内进行更为深入的探讨。
