IPV-D抗原检测试剂参考品的制备及标定
2019-04-12谭振国龙润乡罗芳宇谢天宏谢忠平
谭振国 龙润乡 杨 蓉 罗芳宇 李 华 谢天宏 杨 婷 岳 磊 谢忠平
脊髓灰质炎是由3种血清型(Ⅰ、Ⅱ、Ⅲ型)脊髓灰质炎病毒(poliovirus,PV)中任意一型引起的急性传染病。PV侵入中枢神经系统,并在脊髓前角细胞复制,引起麻痹型脊灰病例。目前 PV 在巴基斯坦、阿富汗、尼日利亚和印度仍有传播,使我国脊灰野病毒输入性风险持续存在[1,2]。2011年我国新疆维吾尔自治区发生了由巴基斯坦输入的脊髓灰质炎野病毒引起的暴发疫情[3~6]。全球消灭脊灰形势不容乐观,尤其是与我国相邻国家脊灰疫情呈高发态势,我国发生脊灰野毒株(WPV) 输入的风险增大[7,8]。根据世界卫生组织要求,2008年停止使用脊髓灰质炎减毒活疫苗(OPV),届时需要使用脊髓灰质炎灭活疫苗(IPV)来维持脊灰的免疫水平,直到脊灰病毒消失,不再对人类健康构成威胁[9]。随着全球首剂Sabin株IPV在中国医学科学院医学生物学研究所研制成功,IPV的生产已成为防控脊灰感染流行,维持人群高免疫水平的关键[10]。无论疫苗的生产,还是临床检测都会用到相应的抗原检测试剂,为获得质量可靠、性能稳定的检测试剂,对检测试剂进行质量控制是必须的。在此前提下,笔者单位制备及标定了3套分别为Ⅰ、Ⅱ、Ⅲ型IPV抗原检测试剂的参考品,用于IPV-D抗原检测试剂的质控,现将结果报道如下。
材料与方法
1.参考品的组成:Ⅰ型参考品包含10份阳参、10份阴参、1份灵敏度参考品,1份精密性参考品;Ⅱ型参考品包含10份阳参、10份阴参、1份灵敏度参考品,1份精密性参考品;Ⅲ型参考品包含10份阳参、10份阴参、1份灵敏度参考品,1份精密性参考品。(1)阳性参考品(阳参):经组织培养得到IPV-Ⅰ、Ⅱ、Ⅲ 3个型别的病毒收获液,各型别病毒收获液经甲醛灭活后按不同浓度进行稀释,制备成10份阳性参考品。各型别阳性参考品经核酸检测确认,酶标检测无型别交叉。(2)阴性参考品(阴参):非Polio肠道病毒7份,其他型别IPV-D抗原2份,本型别IPV-C抗原1份。IPV病毒原液56℃ 90min,D抗原可转为C抗原。(3)灵敏度参考品:IPV-Ⅰ、Ⅱ、Ⅲ型病毒原液加入2%BSA作为保护剂,经酶标检测无交叉。(4)精密性参考品:病毒原液按不同浓度进行稀释,选取吸光度值为0.6~0.8浓度稀释后备用。

表1 阴性参考品的组成
2.国家标准品:Sabin株脊髓灰质炎效力检测国家参考品,批号201301。
3.试剂:本室制备的IPV-Ⅰ、Ⅱ、Ⅲ型D抗原检测试剂盒,批号20151117。
4.设备:离心机,水浴锅,隔水式恒温培养箱,二氧化碳培养箱,酶标仪。
5.检测方法:使用本室制备的IPV-D抗原检测试剂盒(ELISA法)检测,国家抗原含量参考品Ⅰ、Ⅱ、Ⅲ型均稀释至8U/ml后,在板上作2倍系列稀释;待标灵敏度参考品Ⅰ、Ⅱ、Ⅲ型均按1∶200稀释后,在板上作2倍系列稀释;每型别阴参10份,每份1孔;阳参10孔,每份1孔;每型别精密性参考品1份,连加10孔。待测样品100毫升/孔,设阴性2孔、阳性2孔、空白1孔,各型待标参考品分别加入IPV-Ⅰ、Ⅱ、Ⅲ型抗原检测板中, 37℃保温2h;0.01MPBST洗板5次,分别加入Ⅰ、Ⅱ、Ⅲ型IPV-HRP,100毫升/孔,37℃保温1h;0.01MPBST洗板5次,TMB37℃显色10min终止反应。在450nm波长处测量样品吸光度值(A值)。
6.稳定性试验:(1)热稳定性试验:将3套参考品37℃放置3天、5天后,取出检测。(2)冻融试验:将3套参考品反复冻融3次、5次后,取出检测。
结 果
1.阳性参考品标定结果:使用3批次IPV抗原检测试剂、9人次对10份阳性参考品进行检测,检测结果均为阳性,阳性参考品符合率为100%,见表2。

表2 阳性参考品标定结果
2.阴性参考品标定结果:3批9人次检测结果,7种非IPV-I型的肠道病毒均没有检出,对IPV-Ⅰ型C抗原及IPV-Ⅱ、Ⅲ型病毒液进行检测,未发现有交叉反应,10份阴性参考品符合率为100%,结果表明本试剂具有良好的特异性,见表3。

表3 阴性参考品标定结果
3.灵敏度参考品标定结果:使用IPV抗原检测试剂、9人次分别对Ⅰ、Ⅱ、Ⅲ型灵敏度参考品进行标定。Ⅰ型灵敏度参考品平均含量参为1413.13DU/ml,95%CI:1329.63~1496.62DU/ml,9次检测值均在此范围内,待标品检测r2值范围为0.97~1.00,平均值为0.99;Ⅱ型灵敏度参考品平均含量参为1684.66DU/ml,95%CI:1499.21~1870.12DU/ml,9次检测值均在此范围内,待标品检测r2范围0.98~1.00,平均值为0.99;Ⅲ型灵敏度参考品平均含量参为1561.95DU/ml,95%CI:1313.80~1810.10DU/ml,9次检测值均在此范围内,待标品检测r2范围0.95~1.00,平均值为0.98。Ⅰ、Ⅱ、Ⅲ型灵敏度参考品r2均>0.95,显示标定线性值较好,符合检测试剂对线性的要求,见表4。
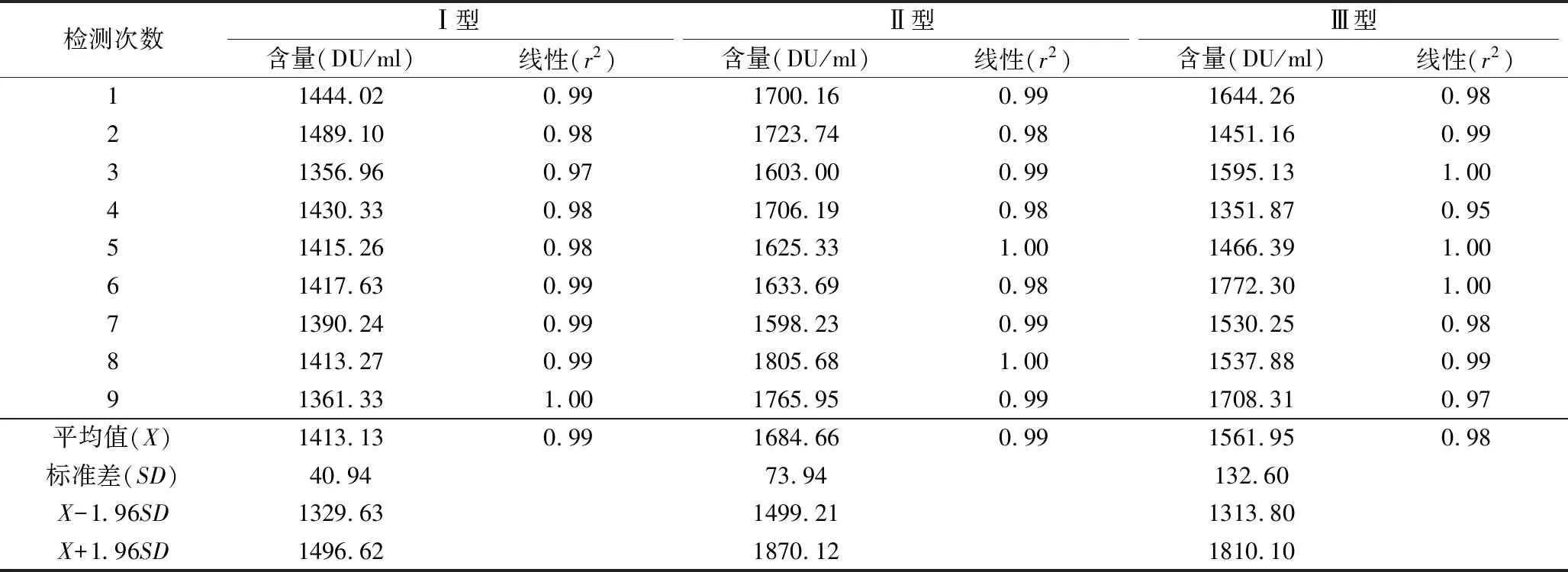
表4 灵敏度参考品标定结果
4.精密性参考品标定结果:检测试剂的精密度用变异系数来衡量。在板上连加10孔精密性参考品,其变异系数(CV,%)=[标准差(SD)/平均值(X)]×100%。9人次检测结果显示Ⅰ型精密度参考品CV值范围在2.57%~7.15%,平均值为4.52%;Ⅱ型精密度参考品CV值范围为4.56%~9.07%,平均值为6.54%;Ⅲ型精密度参考品CV值范围为2.37%~9.87%,平均值为5.68%。各批次CV值均小于15%,符合检测试剂对精密度要求,见表5。

表5 精密性参考品标定结果(%)
5.稳定性实验结果:Ⅰ、Ⅱ、Ⅲ型待标参考品在37℃加速破坏试验或冻融试验后,10份阳参均为阳性,10份阴参均为阴性,精密性参考品的CV值均小于15%,灵敏度参考品的检测下限与-70℃对照组比较,未见下降,各型灵敏度参考品线性良好,均>0.95。各型参考品检测指标均符合质量要求,见表6。
讨 论
酶联免疫吸附试验抗原抗体的结合不是一种简单的化学反应,而是一种生物反应,方法本身变异性较大。生物标准物质是用生物方法实验时,使其表示的效价或活性由不同地点、不同条件、不同操作者得出相对一致性结果的一种工具。因此,标准物质作为生物制品生产检定中必不可少的重要组成部分,在生物制品质量控制和效力评价中发挥重要作用[11]。诊断试剂参考品一般从灵敏度、特异性、精确性、稳定性4个方面进行考察[12,13]。本研究的阳性参考品使用高、中、低不同浓度的病毒原液制备,其目的在于高浓度的阳参用于防止抗原浓度过高引起钩状效应的存在,而使检测出假阴性。低浓度的阳参则是针对弱阳性样品是否能被检出而设置;阴性参考品包含了7份非Polio其他肠道病毒、2份其他型别Polio病毒、1份本型别polio-C抗原。由于肠道病毒之间有较高的同源性,一般抗原检测容易出现交叉反应,笔者选择了ECHO6、 CoxB3、 CoxB5、CoxA16、 ECHO2、CoxA 7、HAV 7种病毒的标准株及疫苗株,以此来排除肠道病毒对IPV-D抗原检测的干扰[12]。使用其他2个型别的Polio病毒,用于检测是否存在型间交叉。Polio病毒有D、C两种抗原,C抗原不能刺激机体产生中和抗体,只有D抗原能刺激机体产生保护性抗体,D抗原可作为IPV体外效力测定的重要指标,它与体内免疫原性有效好的一致关系[9]。因此,阴参中设置的本型别polio-C抗原,用于检测疫苗中是否含有无效的C抗原。
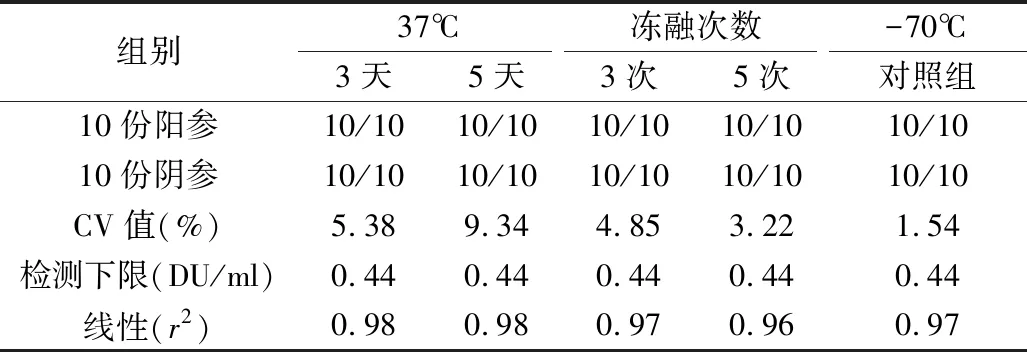
表6 Ⅰ型参考品稳定性试验结果
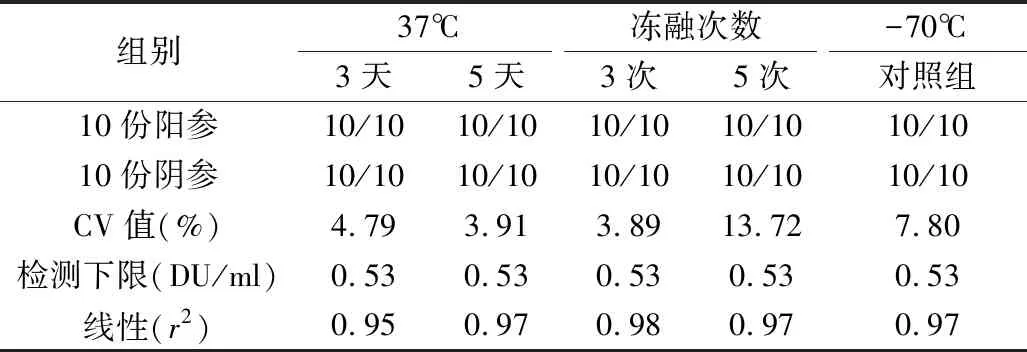
表7 Ⅱ型参考品稳定性试验结果
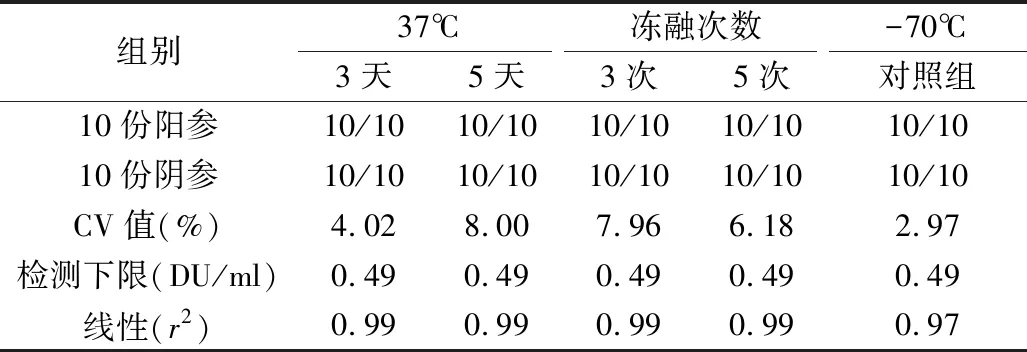
表8 Ⅲ型参考品稳定性试验结果
通过标定灵敏度参考品的含量,在检测过程中一方面可以监测试剂盒的检测下限,另一方面还可以通过已知含量的参考品来计算未知样品的含量。根据国家药典对诊断试剂的要求,用于酶联诊断试剂的精密度(CV值)应不高于15%(n=10)[14]。本研究标定的精密性参考品选取检测吸光度值0.6~0.8的样品来控制检测试剂的孔间差。
稳定性是标准物质的特性量值随时间变化的性质,即在规定的时间间隔和环境条件下,标准物质的特性量值报纸在规定范围的性质[15]。考虑到参考品在保存、使用、运输过程中可能出现的情况,笔者设计了热稳定性试验和冻融试验对参考品的稳定性进行考察。实验结果显示,37℃放置5天或冻融3次仍可达到质控参考品的合格标准,通过分别使用Ⅰ、Ⅱ、Ⅲ型IPV-D抗原检测试剂对Ⅰ、Ⅱ、Ⅲ型抗原参考品进行检测,结果均符合参考品的要求。
综上所述,由本室制备的IPV-D抗原的3个型别的参考品是成功的,能够对IPV-D抗原检测试剂的质量控制起到重要的作用,对疫苗的质量提供了有效保障。
