达氏鲟微卫星标记的开发及性别相关位点的筛选
2019-04-11陈叶雨宋明江赖见生
陈叶雨,刘 亚,杜 军,宋明江,赖见生,林 珏,龚 全
(四川省农业科学院水产研究所,四川 成都 611731)
【研究意义】达氏鲟(Acipenserdabryanus)是我国长江流域特有淡水定居种类,近年来,由于过度捕捞、栖息地破坏以及环境污染等因素,其野生种群数量急剧下降[1],已被列为国家一级重点保护动物和极度濒危物种。自1995年后,长江流域葛洲坝下游已经没有野生达氏鲟的报道[1-2]。因此,人工繁殖及增殖放流是达氏鲟种质资源保护最重要的途径。性别比例平衡是增殖放流过程中的重要考虑因素。由于达氏鲟没有第2性征,外部特征不足以进行性别鉴别,而当前鲟鱼性别鉴定技术(微创手术、内窥镜、超声等)都需要鲟鱼生长到较大个体[3],甚至到性成熟后才较为准确,且通常对鱼体都具有不同程度的损伤性。因此,深入了解达氏鲟的性别决定与分化,利用分子标记的方法进行性别鉴定,对达氏鲟物种保护具有深远的意义。【前人研究进展】目前一些研究通过雌核发育技术推测大多数鲟鱼的性别决定系统为ZZ-ZW型[4-5],但是在鲟鱼中却一直未能鉴定出异形性染色体[6]。然而,无论是野生种群还是人工养殖种群,鲟鱼的性别比例均接近于1∶1,表明其性别决定机制可能主要是由遗传决定[7],这为利用分子标记的手段来进行性别鉴定提供了可能。但目前利用大量的显性标记(AFLP,RAPD等)在不同性别的鲟鱼中进行筛选,结果都未找出性别特异性的分子标记[8-11]。【本研究切入点】微卫星标记(SSR)具有共显性、分辨率高、重复率及可信度高的优点,广泛应用于水产动物育种领域的研究。然而鲟鱼染色体组的多倍性给共显性标记的分析研究带来困难[12],在鲟形目鱼类中已开发的微卫星标记数量相对其他模式水生生物较为稀少。【拟解决的关键问题】本研究利用高通量转录组测序数据为基础,开发达氏鲟多态性微卫星标记并首次进行达氏鲟性别相关位点的筛选,为今后达氏鲟性别鉴定及鲟鱼的性别决定与分化的研究具有重要作用。
1 材料与方法
1.1 实验材料
实验用达氏鲟全部来自四川省农业科学院水产研究所亲鱼样本,共96尾(48尾♀;48尾♂)性成熟个体,平均体重20 kg。剪取部分尾鳍条于100 %乙醇中,-20 ℃保存备用。
1.2 基因组DNA的提取
达氏鲟DNA采用CTAB高盐法进行制备,取1 μl左右的样品进行电泳检测DNA质量,并用分光光度计测定纯度和浓度,保存于-20 ℃冰箱备用。
1.3 微卫星引物设计和多态性验证
利用前期达氏鲟转录组数据微卫星分析结果[13],随机选取多个微卫星位点,根据其两端序列,利用Primer 3软件设计微卫星位点的特异性引物。以达氏鲟基因组DNA为模版,进行PCR扩增,体系为10 μl,包括50 ng基因组DNA,1×PCR缓冲液,Mg2+(1.5 mM),1 UTaq酶,dNTPs 0.2 mM,正反引物均为0.25 μM。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸30 s,32个循环;72 ℃延伸8 min,最后4 ℃保存。PCR扩增完成后,利用8 %的非变性聚丙烯凝胶电泳验证其多态性。多态性良好的引物分别用FAM、HEX、TAMRA 3种荧光标记,随机选取43个达氏鲟个体基因组DNA作为模板进行PCR扩增,在ABI 3730XL测序仪进行毛细管电泳和STR分型以确定达氏鲟微卫星标记在不同个体上的等位基因大小。
根据每个微卫星扩增产物的等位基因大小确定其基因型,用ATetra 1.2软件[14]计算期望杂合度以及Shannon-wiener多样性指数等。
1.4 雌雄差异条带的筛选
利用本研究筛选出的微卫星位点,加上20个四川省水产研究所分子实验室前期自主开发微卫星标记[11]以及已公开发表的达氏鲟或鲟鱼通用微卫星标记71个[15-18],由上海生工生物工程公司合成。根据扩增产物片段大小的差异,各对引物分别标记FAM、HEX、TAMRA 3种荧光中的1种,取48尾雌鱼及48尾雄鱼作为模板,进行PCR。扩增结果送上海生工生物工程公司,在ABI 3730XL测序仪进行毛细管电泳和STR分型,以确定达氏鲟微卫星标记在不同个体上的等位基因大小。
1.5 数据统计与分析
分型结果用Genemarker软件进行读取,并做人工校正,从而得到每个个体在所有位点中的基因型。根据SSR分型结果,用SPSS 13.0软件包中的CompareMeans(平均数比较)法对雌、雄群体的等位基因频率进行平均数配对样本的T检验。
2 结果与分析
2.1 微卫星引物筛选结果及遗传多样性分析
通过对各微卫星位点的多态性分析,本研究共筛选出15个具有多态性的微卫星位点,分别命名为ADX01、ADX08、ADX10、ADX13、ADX23、ADX26、ADX28、ADX31、ADX44、ADX49、ADX54、ADX56、ADX62、ADX64和ADX71。该15个位点在43个达氏鲟个体中均表现出不同程度的多态性,并能对其进行准确的基因分型(图1)。各位点在43个个体中的等位基因数量为3~8,平均等位基因数为4.6(表1)。其中,6个位点以2碱基为重复单元,3个位点为3碱基重复,5个位点为4碱基重复,1个位点为5碱基重复序列。根据微卫星分型结果及遗传多样性参数的计算,该15个微卫星标记的期望杂合度的范围为0.3831~0.8607,平均杂合度为0.7078,Shannon-Wiener多样性指数为0.6541~1.9663,平均值为1.3362,证明本研究筛选的微卫星标记具有多态性。
2.2 106个微卫星位点在达氏鲟中的扩增及分析
利用本研究开发的15对微卫星引物及文献报道的91对引物,在达氏鲟雌雄个体中进行扩增,其中,Ada2,Ada10,Ada11,Ada26,Ag18,Ag49,DS3,DS8,DS25,Anac11,Spl113,Afu34和AciG76共13个位点在此次检测的96个达氏鲟个体中无多态性,其余93个位点均存在多态性。该93个位点在48个雌性个体中的等位基因数为1~10(表2),平均值为4.6;在雄性个体中的等位基因数为2~10,平均值为4.5,其中等位基因数最多的位点为ADX33(表2)。93个位点中,ADX23,AD6,DS18,Ada4,Ada5,Ada9,Ada12,Ada18,Ada24,ADX21,ADX29,ADX70,ADX80共13个位点在雌、雄个体中的等位基因数量存在差异,其余80个位点在雌雄个体之间的等位基因数量相等。
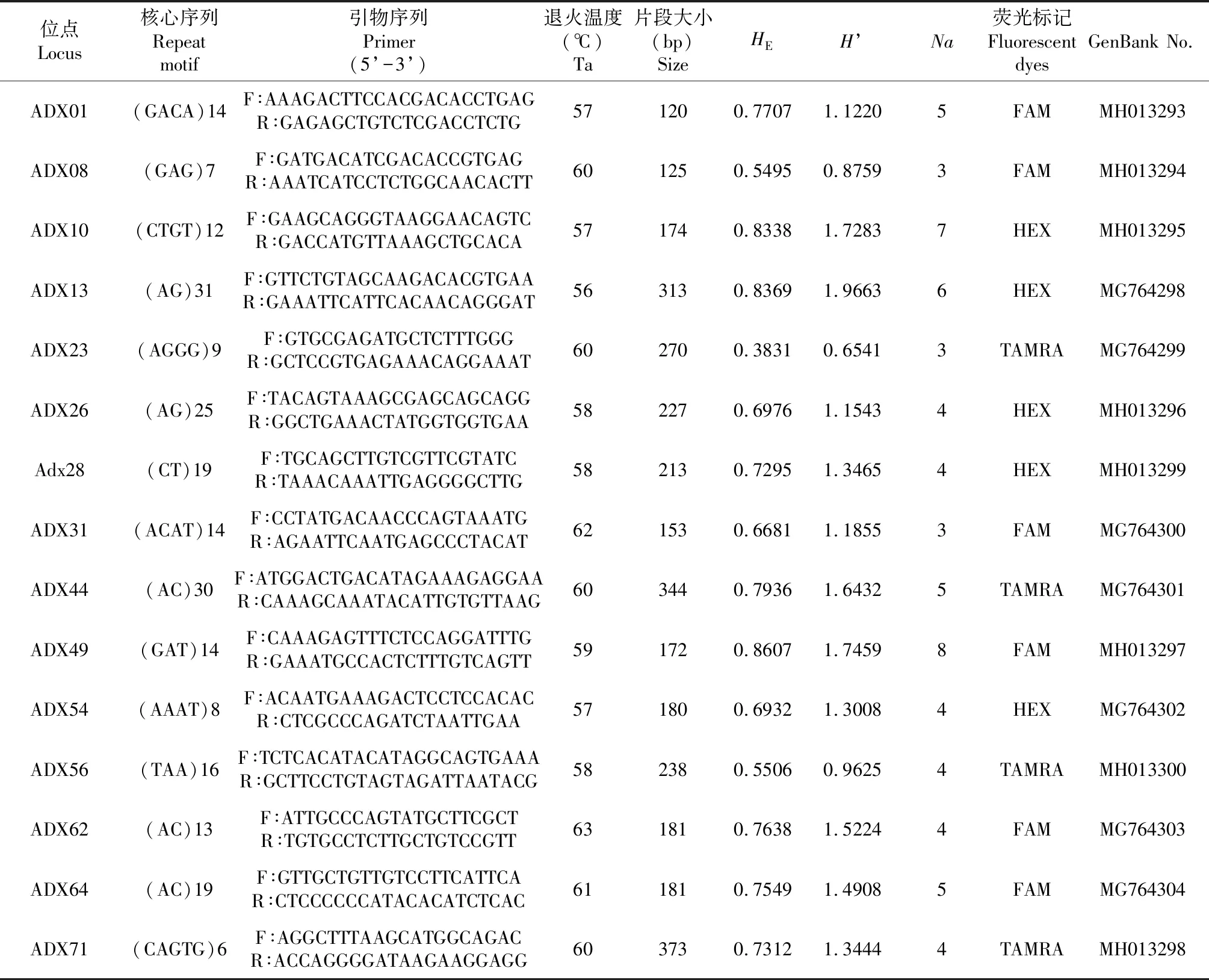
表1 新开发达氏鲟微卫星标记的特征
2.3 达氏鲟性别相关位点的筛选
此次检测的93个多态性微卫星位点在96个雌雄个体中共产生438个等位基因,其中有66个等位基因在96个雌雄个体中出现的频率没有差异,370个等位基因频率在雌雄个体间存在差异但差异不显著。只有1个位点ADX21的2个等位基因ADX21-144 bp和ADX 21-151 bp在雌雄个体间出现的频率差异达到60 %(表2)。其中ADX 21~144 bp在雄性群体中的频率为75 %,显著高于雌性个体的频率15 %,为雄性优势条带,而ADX 21~151 bp在雌性群体中的频率为85 %,显著高于雄性个体的频率25 %,为雌性优势条带。

图1 部分微卫星分型Fig.1 The genotype results of two microsatellite markers
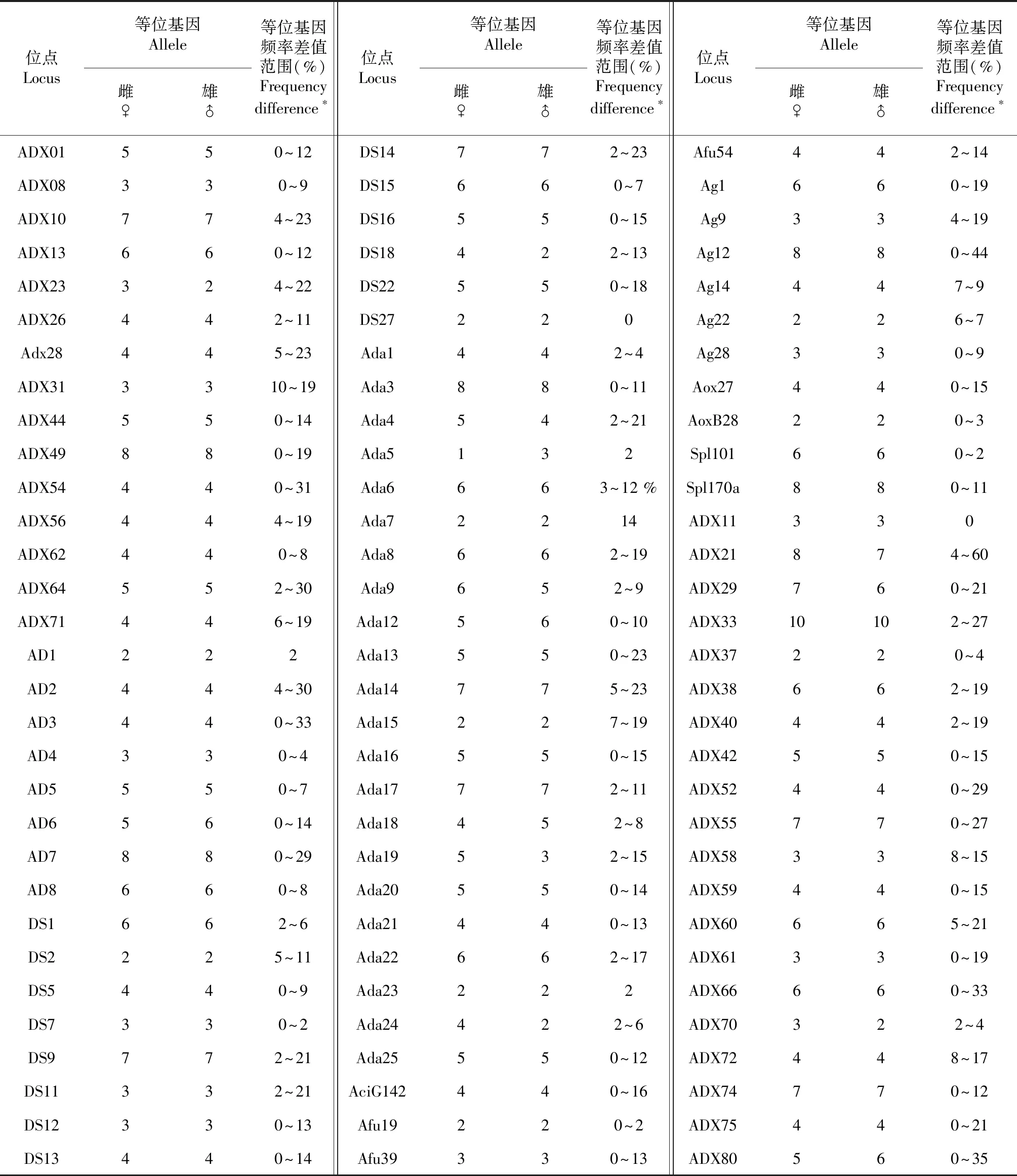
位点Locus等位基因Allele雌♀雄♂等位基因频率差值范围(%)Frequency difference∗位点Locus等位基因Allele雌♀雄♂等位基因频率差值范围(%)Frequency difference∗位点Locus等位基因Allele雌♀雄♂等位基因频率差值范围(%)Frequency difference∗ADX01550~12DS14772~23Afu54442~14ADX08330~9DS15660~7Ag1660~19ADX10774~23DS16550~15Ag9334~19ADX13660~12DS18422~13Ag12880~44ADX23324~22DS22550~18Ag14447~9ADX26442~11DS27220Ag22226~7Adx28445~23Ada1442~4Ag28330~9ADX313310~19Ada3880~11Aox27440~15ADX44550~14Ada4542~21AoxB28220~3ADX49880~19Ada5132Spl101660~2ADX54440~31Ada6663~12 %Spl170a880~11ADX56444~19Ada72214ADX11330ADX62440~8Ada8662~19ADX21874~60ADX64552~30Ada9652~9ADX29760~21ADX71446~19Ada12560~10ADX3310102~27AD1222Ada13550~23ADX37220~4AD2444~30Ada14775~23ADX38662~19AD3440~33Ada15227~19ADX40442~19AD4330~4Ada16550~15ADX42550~15AD5550~7Ada17772~11ADX52440~29AD6560~14Ada18452~8ADX55770~27AD7880~29Ada19532~15ADX58338~15AD8660~8Ada20550~14ADX59440~15DS1662~6Ada21440~13ADX60665~21DS2225~11Ada22662~17ADX61330~19DS5440~9Ada23222ADX66660~33DS7330~2Ada24422~6ADX70322~4DS9772~21Ada25550~12ADX72448~17DS11332~21AciG142440~16ADX74770~12DS12330~13Afu19220~2ADX75440~21DS13440~14Afu39330~13ADX80560~35
注:*等位基因频率差值范围:微卫星每个等位基因在雌雄个体中出现的频率差值,从小到大进行统计的范围。
Note:*The range of frequency difference was caculated orderly according to the distribution of each allele in female and male individuals.
3 讨 论
在水产动物育种中,性别控制的方法通常包括激素、温度和杂交选育等方式。用激素改变性别分化方向的方式最为简单快捷,然而激素处理后的雌鱼对鱼子酱品质的安全影响无法评估。另一种控制性别的方法是调控温度,研究发现有些鱼类,例如罗非鱼[19],在高温下倾向于雄性发育,而低温时则向雌性分化。但不是所有鱼类的性腺分化都受温度控制,研究发现施氏鲟在性腺分化时,温度只改变其分化的时间,并不改变其分化方向[20]。杂交选育也是控制后代性别的方式之一,然而,达氏鲟性成熟时间过长,所以筛选杂交后代性别的周期也相对较长,而且鲟鱼性别决定系统的研究还处于相当初级的阶段,虽有研究发现其性别决定系统可能为ZZ-ZW型[4-5],但是一直未能在鲟鱼中鉴定出性染色体,所以通过杂交的方式在鲟鱼中进行性别选育相对较困难。近年来,随着分子遗传学和分子生物技术的飞速发展,使基因水平上控制动物的性别成为可能。分子标记具有操作简单、对环境依赖小、成本低等优点,最重要的是可以通过不伤害动物的方式来对物种进行性别鉴定、个体识别、亲子鉴定等。
本文首次利用共显性标记微卫星对达氏鲟雌雄个体进行分型,共使用106个微卫星位点和96个雌雄个体,这是目前为止在鲟鱼中使用的最大数量的微卫星标记来进行性别差异性分析。在106个微卫星位点中,有93个位点存在多态性,在48个雌性个体和48个雄性个体中的平均等位基因数分别为4.6和4.5,无显著差异。93个多态性位点中,有92个位点的所有等位基因在雌雄个体中出现的频率均无显著差异,只有1个位点ADX21的2个等位基因ADX 21-144 bp和ADX21-151 bp在雌雄个体间的出现频率差异均达到60 %,分别为雄性优势条带和雌性优势条带,推测该位点可能与达氏鲟的性别有一定关联,有可能与性别决定基因连锁,但其并不是性别特异性的位点,所以今后有必要采用更多的标记来进行雌雄分型分析,进一步找出性别特异性位点或等位基因。
鲟鱼性别连锁位点的研究还处于起步阶段,近年来偶有报道,但目前为止均未找到性别特异性的连锁位点。Wuertz等[8]用AFLP,RAPD和ISSR等技术在西伯利亚鲟,意大利鲟,俄罗斯鲟和小体鲟四种鲟鱼中进行随机性筛选,结果没有发现与性别相关的标记。McCormick等[9]利用RAPD技术在30个湖鲟个体中进行筛选,结果未找到性别特异性标记。类似的结果在欧洲鳇的RAPD标记研究中也有发现[10]。刘洋等[21]用32个微卫星标记分析了性成熟施氏鲟雌雄个体的遗传差异,结果也未找到与性别直接相关的标记。刘雪清等[11]在中华鲟中进行了性别相关的扩增片段长度多态性分子标记筛选,同样未能找到性别特异性的AFLP分子标记。
结合本研究及目前为止所有文献报道的标记筛选结果发现,利用显性标记RAPD、ISSR和AFLP及共显性标记SSR均未能在鲟鱼雌雄个体中找到性别特异性存在的片段。分析原因:①大部分鲟鱼是一种多倍体物种[18],其染色体数量庞大,目前所筛相关标记位点覆盖面不够,同时,鲟鱼多倍性的特点也加大了对其性别连锁标记的筛选难度,今后可以继续扩大标记数量来进行筛选。②鱼类遗传性别决定的作用机制通常包括性染色体上的特定单基因或常染色体上的多基因所决定[22]。相对于高等脊椎动物,鱼类的性染色体决定型相对复杂,除了主要的XX/XY和ZZ/ZW两大系统,还存在复合型的性别决定系统[23]。根据鲟鱼染色体研究结果,目前为止未能在鲟鱼中找到异形的性染色存在[6],所以鲟鱼有可能为多基因决定的性别决定机制,这为性别连锁标记的开发提高了难度。但由于性别决定系统在同属的不同种类之间也可能存在差异,所以后续需要进一步研究达氏鲟染色体组成结构来确定其有无性染色体的存在。根据目前鲟鱼类性别连锁位点的研究结果,提示着通过DNA技术来筛选鲟鱼性别特异性的标记均不能获得成功,将来可能需要更换鲟鱼性别决定系统的研究方法,例如通过雌雄性腺的比较转录组或蛋白质组学测序,特别是对性别分化关键阶段的性腺进行比较组学的测序,来筛选性别决定相关基因,再从性别相关基因中筛选连锁的SSR等标记。
4 结 论
本文利用微卫星标记对达氏鲟雌雄样本进行了分型及差异性分析,虽未鉴定出性别特异性位点,但本研究使用了大量的微卫星标记及验证样本,这为今后利用分子标记分析鲟鱼性别差异位点提供了很重要的参考,同时也为鲟鱼性别决定系统的研究提供了理论基础数据。
