CT-1对脐血间充质干细胞神经分化作用
2019-04-11郎长会彭龙英李莎莎余小华束晓梅
郎长会, 彭龙英, 李莎莎, 余小华, 束晓梅
间充质干细胞(mesenchymal stem cells,MSCs)神经分化的潜能为神经系统疾病的治疗带来曙光[1]。人脐血来源MSCs(hUCB-MSCs)比骨髓来源MSCs更具优势[2]。但目前的难题是干细胞在脑内难以维持足够的数量并分化为神经元。人们力图发现具有支持干细胞神经分化并维持存活的活性因子。心肌营养素1(cardiotrophin-1,CT-1)属生神经细胞因子家族中一员,可支持神经元长期存活,抑制凋亡[3]。我们前一课题证明CT-1可促进胎脑来源NSCs神经元分化及存活[4]。据此,本实验我们将CT-1基因转染hUCB-MSCs,探讨CT-1是否可促进hUCB-MSCs神经分化。
1 材料与方法
1.1 材料 人淋巴细胞分离液(天津颢洋生物科技),hUCB-MSCs 专用培养基(Cyagen biosciences ),红细胞裂解液(Ammonium chloride Stem cell公司),胎牛血清(Gibco公司),胰蛋白酶和PBS(北京中杉),胰岛素、肝素、BHA、维甲酸及bFGF(Sigma公司),神经诱导剂(Neural Induction medium,NIM)参照文献[5](5 μ/ml氯化钾、20 nmol/L孕酮、100 μmBHA、2%DMSO、30 nm亚硒酸钠、5 μg/ml胰岛素、100 μg/L转铁蛋白 );兔抗人CT-1多抗(博奥森),兔抗人nestin、NeuN 及GFAP多抗(Abcam);Adv-CT-1、Adv-EGFP(北京诺赛生物有限公司);小鼠抗CD44-FIFC,小鼠抗IgG1-FIFC,小鼠抗CD29-PE,小鼠抗CD105-PE,小鼠抗人IgG1-PE及小鼠抗人CD34PerCP均购自于BD Biosciences。
1.2 方法
1.2.1 原代hUCB-MSCs培养及鉴定 经产妇及家属知情同意后,于遵义医学院附属医院产科采集标本,参照文献[5,6]对脐血进行原代培养,以1×106/ml的密度接种于10%胎牛血清(fetal bovine serum,FBS)、5 ng/ml碱性成纤维因子(basic fibroblast growth factor,bFGF)的专用培养基中,置于37 ℃,5%CO2培养箱中培养,并传代及扩增。取P3细胞进行实验,流式细胞仪鉴定hUCB-MSCs的表面抗原CD34,CD29,CD44,CD105表达情况。
1.2.2 hUCB-MSCs转染 计数P3细胞,每孔细胞数约5×103/ml种入96孔板,在37 ℃、5% CO2孵箱中培养24 h,按感染复数(Multiplicity of infection,MOI)50、100、200及300 PFU/细胞加入Adv-CT-1(对照组加等量PBS),每孔两个复孔,6 h弃病毒液,转染24 h、48 h、72 h及96 h时荧光显微镜下观察荧光表达,摸索最佳MOI及荧光表达最强时间。
将消化细胞以2×104/ml密度种于24孔板,以1.2.2所得最佳MOI的Adv-CT-1转染hUCB-MSCs,设两个复孔,在24 h、48 h和72 h时分别取出爬片,4%多聚甲醛固定,0.1%Triton X-100处理15 min,山羊血清封闭1 h,加入荧光标记的兔抗人CT-1抗体(1:100),DAPI( 5 μg/ml) 避光染色3 min,荧光显微镜下观察转染情况。
1.2.3 实验分组 将hUCB-MSCs细胞分为4组:(1)神经诱导剂组(NIM):24 h时加入预诱导剂(5 μg/ml bFGF),48 h时加入NIM;(2)CT-1组(Adv-CT-1+NIM):先转入Adv-CT-1,24 h时加入预诱导剂,48 h时加入NIM;(3)空病毒[(EGFP) Adv-EGFP+NIM)]组:先转入Adv-EGFP,24 h时加入预诱导剂,48 h时加入NIM;对照组:48 h时换为无血清培养基。
1.2.4 神经细胞标志物免疫荧光检测 将诱导后细胞做细胞爬片,荧光步骤同前,分别向四组细胞分别加入等量兔抗人nestin(1∶100)、NeuN(1∶100)、GFAP(1∶100),4 ℃过夜,分别加入用CY3标记山羊抗兔(1∶200)孵育1/2 h,DAPI( 5 μg/ml) 避光染色3 min,荧光显微镜下观察;4 d后重复检测。

2 结 果
2.1 hUCB-MSCs培养及鉴定 细胞接种24 h,倒置显微镜下观察到大多数细胞为圆形,少部分细胞已贴壁;5 d可见多角形细胞和大量大而圆的破骨样细胞及杂细胞;12 d后可见大量梭形细胞呈集落样生长;平均约28 d可以传代。传代后约12 h细胞逐渐贴壁,呈均一的梭形细胞,7~10 d可再次传代,P3细胞形态均一,6~7 d 细胞融合率达90%,流式细胞仪检测结果,MSCs 均表达CD29、CD44、CD105,而不表达CD34;说明所培养细胞为hUCB-MSCs。
2.2 hUCB-MSCs转染及Adv-CT-1表达
2.2.1 转染Adv-CT-1 hUCB-MSCs转染24 h后可见到微弱绿色荧光表达,48 h表达增强,72 h之后表达趋于稳定。MOI为100 PFU/细胞时,转染72 h效率较高(87.60%±1.36%),且细胞形态、生长方式与对照组相同,细胞的正常增殖未受影响,荧光表达最理想,为最佳转染复数。当MOI为200(86.40%±3.67%)和300PFU/细胞(91.96%±1.53%)时转染效率逐渐增高,部分细胞开始变圆、漂浮,细胞正常增殖受到影响。
2.2.2 Adv-CT-1表达 转染Adv-CT-1 24 h时其阳性率为65.09%±1.96%(见表1),48 h、72 h及96 h时染转率分别为86.62%±2.08%、91.77%±2.30%、90.25%±1.38%,72 h荧光表达最强,48 h、72 h、96 h与24 h相比差异有统计学意义(P<0.05),虽然72 h与48 h相比差异无统计学意义(P>0.05),但72 h比48 h阳性率高,所以本实验选72 h作为表达时间最强点,96 h与72 h相比差异无统计学意义(P>0.05)。
2.3 诱导神经细胞分化 CT-1组和NIM组经诱导6 h时细胞胞体向胞核方向收缩、变细;EGFP组、对照组变化不明显;诱导4 d时,原梭形的hUCB-MSCs已形成多级分支的细突起,CT-1组改变更加明显,突起逐渐变长,交织成网状,类似神经元样细胞(见图1D);NIM组也出现类似神经样细胞改变,不及CT-1组明显;而对照组无明显变化。
2.4 神经细胞标志物表达
2.4.1 Nestin表达 诱导后6 h,各组Nestin(神经干细胞标志物)大量表达,NIM组、CT-1组、EGFP组及对照组阳性率分别见表2,其中CT-1组阳性率均明显高于其他各组(P<0.05)。至4 d时,Nestin表达量明显减少,CT-1组阳性率降至10.31%±1.79%。
2.4.2 NeuN表达 诱导后6 h,CT-1组NeuN(神经元标志物)少量表达(14.26%±2.20%),4 d时阳性率达48.33%±2.53%(见表3);EGFP组与对照组在6 h(2.72%±1.38%、2.75%±0.42%)与4 d时NeuN(5.09%±1.43 %、2.66%±0.91%)阳性率差异均无统计学意义(P>0.05);各时间点NIM组(8.72%±1.15%、16.43%±0.77%)差异有统计学意义(P<0.05)。
2.4.3 GFAP表达 诱导后6 h,CT-1组GFAP(星型胶质细胞标志物)见微弱表达,其阳性率为16.96%±4.41%(见表4),对照组几乎不表达,随后GFAP表达逐渐升高,至诱导后4 d时阳性率升高至65.83%±5.17%,与其它三组相比差异有统计学意义(P<0.05)。
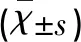
表1 不同时间点CT-1的表达
a:与24 h比较P<0.05 ;b:与48 h比较P>0.05;c:与72 h比较P>0.05
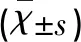
表2 不同时间点各组Nestin阳性率
a:与同时间点CT-1组比较P<0.05

表3 各组各时间点NeuN阳性率
a:与同时间点CT-1组比较P<0.05
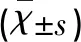
表4 各组各时间点GFAP阳性率
a:与同时间点CT-1组比较P<0.05
3 讨 论
CT-1是近年来发现的一种新型细胞因子,因其对心肌细胞有保护作用而得名。近年来发现其对神经系统也起重要作用。我们前期研究发现,外源性CT-1可促进胎脑来源的干细胞神经分化及存活,转染CT-1后NSCs可持续表达CT-1,移植入脑可减轻大鼠脑损伤并抑制海马苔藓发芽[4],提示CT-1可支持NSCs的分化存活,对神经细胞有保护和营养作用。
有关CT-1对hUCB-MSCs神经分化的作用尚未见报道。CT-1属白介素-6(interleukin-6,IL-6)超家族成员,与睫状神经生长因子(CNTF)、白血病抑制因子(LIF)和心肌营养素样细胞因子(CLC)等同属生神经细胞因子(neuropoietic cytokine)家族,是活性较强的神经元营养因子[7~9]。有报道显示生神经细胞因子对神经细胞有保护和营养作用,其中IL-6可促进少突胶质细胞形成[10];在大鼠脑缺血模型中,人脐血样细胞分泌的细胞因子如LIF可保护神经元和少突胶质细胞,可减少大脑梗死面积及白质损伤[11];生神经生长因子家族中如IL-1、IL-10等可改善大脑局部损伤和免疫细胞浸润引起的炎症反应,可调节NSC再生、增生和NSC移植环境[12]。
我们的实验发现CT-1可诱导hUCB-MSCs向神经方向分化。hUCB-MSCs在 CT-1诱导下呈现神经元细胞形态:胞体向胞核收缩,细胞突起逐渐变长交织成网状。免疫荧光显示CT-1诱导后hUCB-MSCs的神经干细胞(Nestin)、神经元(NeuN)及神经胶质细胞(GFAP)标志增高。目前认为,Nestin表达被认为是神经干细胞或神经祖细胞标志物[13]。GFAP是一种Ⅲ级中间纤维丝蛋白,是星形胶质细胞的骨架蛋白,对神经元的存活、免疫调节及信号传导有重要作用[14]。NeuN只在神经元中表达,是特异性神经元特异物[15]。CT-1可诱导hUCB-MSCs向神经方向分化的潜能为神经系统疾病的替代治疗带来无限曙光。
然而,CT-1是通过什么机制促进hUCB-MSCs神经分化尚不明确。有报道脑源性神经营养因子(brain-derived neurtrophic factor,BDNF)是通过同时活化丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇-3激酶/丝氨酸-苏氨酸蛋白激酶(phosphoinositide-3 kinase/serine-threonine kinase,PI3K/Akt)两条信号通路以促进hUCB-MSCs向神经方向分化[5]。也有报道CT-1对心肌细胞的保护作用是通过同时MAPK和 PI3K/Akt两条信号通路[16,17]。因此推测MAPK和PI3K/Akt信号通路可能参与CT-1诱导hUCB-MSCs神经方向分化机制,需要在后续的实验中进一步验证。

a:对照组细胞仍呈梭形;B:EGFP组,少部分细胞胞体开始变圆;C:NIM组胞体向胞核回缩;D:CT-1组,大部分细胞出现神经样细胞形态(相差显微镜×100)
图1 hUCB-MSCs诱导后6 h细胞形态

诱导后6 h,CT-1组Nestin的阳性率达86.82%±4.29%。图从左到右分别为蓝色荧光为DAPI,红色荧光为目的蛋白,蓝色荧光与红色荧光的组合
图2 CT-1组和对照组诱导6 h后Nestin的表达率(荧光显微镜×100)
