腺病毒介导rhbFGF基因转染胰岛后促进小鼠被膜下移植的研究
2019-04-10蒋煊朱群燕徐福远蒋必颖王敏秀赵应征吴岚岚傅红兴李校堃
蒋煊,朱群燕,徐福远,蒋必颖,王敏秀,赵应征,吴岚岚,傅红兴,李校堃
(1.温州医科大学 药学院,浙江 温州 325035;2.义乌市中医院 药剂科,浙江 金华 322000)
胰岛移植已在临床糖尿病治疗中显示了良好的治疗效果,但其结果受多个因素影响。移植部位缺氧和诱导的炎症反应会导致移植早期胰岛的显著损失,受体中移植胰岛的血管再生决定了胰岛的存活和功能[1-3]。碱性成纤维细胞生长因子(bFGF)有利于促进胰岛移植后的血管生成和伤口愈合。但由于bFGF半衰期短,易受环境变化(温度、pH等)的影响,限制了其临床应用[4-7]。
细胞转基因技术近年来在科研和临床领域发展迅速,其中以腺病毒为载体可提高基因传递效率,易感染受体并高水平的表达目的基因[8]。本研究中我们采用腺病毒作为载体,结合实验室前期胰岛分离和移植的工作基础[9-10],将rhbFGF-flag-GFP基因转染到胰岛中,并通过肾被膜下移植观察移植物微血管重建和糖尿病治疗疗情况。期望获得移植物快速微血管重建的方法,为转基因胰岛的临床应用提供参考。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:雄性Balb/c小鼠100只(SPF级),8~10周龄,由温州医科大学实验动物中心提供。
1.1.2 试剂和器材:rhbFGF-flag-GFP腺病毒(上海汉恒生物科技有限公司);胶原酶V、链脲佐菌素(STZ)、二乙酸荧光素(FD)、碘化吡啶(PI)、胎牛血清(Sigma公司,美国);异氟烷(Baxter公司,美国);CMRL 1066、Ficoll-1077、Ficoll-1119、Hanks(温州市怡康细胞移植技术开发有限公司);DKZ-450B电热恒温振荡水槽(上海森信实验仪器有限公司);离心机ST 8R、二氧化碳培养箱3111(赛默飞世尔科技有限公司);NIKON YS100显微镜(南京江南永新光学有限公司)。
1.2 实验方法
1.2.1 糖尿病模型建立:造模前Balb/c小鼠禁食12~16 h,称重并测定空腹血糖,腹腔注射2% STZ(200 mg/kg),72 h后测血糖≥11.0 mmol/L为糖尿病造模成功,模型稳定一周后选取血糖20~30 mmol/L的小鼠进行肾被膜下胰岛移植。
1.2.2 胰岛分离纯化:参考前期工作基础[9-10],简述如下:取Balb/c小鼠,颈椎脱臼法处死,U型切口剪开腹部肌肉层;夹闭胆总管入十二指肠口;逆行胆总管灌注V型胶原酶溶液2.5 mL,膨胀的胰腺放入含2 mL同浓度V型胶原酶的50 mL离心管中,在(37.0±0.5)℃恒温水浴中振摇消化呈乳糜状,用Ficoll-1077、Ficoll-1119进行密度梯度纯化,得到高纯度的小鼠胰岛,用CMRL 1066(含10%胎牛血清和青链霉素)在37 ℃ 5% CO2培养箱中培养。
1.2.3 胰岛活性测定[11]:取胰岛细胞团约60个,先后加入PI、FD各8 μL,避光混匀后在荧光显微镜下观察细胞染色情况,显示绿色为活细胞,红色为死亡细胞,估算整个胰岛团中绿色面积占组织总面积的比例,取全部细胞团的平均值即为胰岛活性。
1.2.4 胰岛腺病毒感染[12]:将胰岛置于12孔培养板中培养6 h后,分别以感染复数(MOI)为50、100、300和1000的腺病毒滴度进行胰岛体外感染,感染后将胰岛分散于含2 mL CMRL1066完全培养基的培养皿中,37 ℃培养12 h;用完全培养基洗涤胰岛3次,1000 rpm离心除去游离病毒,加入2 mL完全培养基继续培养6 h;通过荧光显微镜检测胰岛活性;并取活性最佳组胰岛进行肾被膜下移植。
1.2.5 肾被膜下胰岛移植:将胰岛随机分成两组,分别为感染rhbFGF-flag-GFP腺病毒组和感染GFP腺病毒组。移植前参考Lembert等[13]制定的方法计算移植所需胰岛当量。移植手术参考文献[14],简述如下:用异氟烷麻醉Balb/c糖尿病鼠,脱毛并用酒精消毒手术区域,用眼科剪在皮肤和肌肉上开1 cm小口暴露右肾。用针在肾被膜上刺个小口,并使用自制的移植工具将胰岛移植到肾背膜下。缝合切口并用聚维酮碘消毒,皮下注射1 mL生理盐水补液。
1.2.6 术后护理及血糖监测:术后小鼠每24 h皮下注射100 μL头孢唑啉钠预防感染,持续一周,术后7 d内每24 h测定血糖,之后每3天测定一次血糖,持续一个月,连续两次测定血糖值超过16.7 mmol/L则宣告移植物失效。
1.2.7 口服糖耐量试验(OGTT):胰岛移植第14日,取5只小鼠各测一次OGTT。参考文献[15],小鼠禁食12 h后,将葡萄糖溶于双蒸水(浓度为300 mg/mL)后给其灌胃,每克小鼠剂量为2.0 mg,于灌胃后20、40、60、90、120 min测定血糖值,以正常鼠和糖尿病鼠相同测定方法作对照,对比各时间点血糖峰值,评价移植后胰岛功能和移植效果。
1.2.8 肾被膜下胰岛组织学评价:取胰岛移植后第14天的小鼠,持续异氟烷吸入麻醉下剪开腹部皮肤和肌肉层,破心处死,取含胰岛的肾脏组织并用4%多聚甲醛液固定至少24 h,经脱水、包埋、切片、染色,显微镜下观察含胰岛肾组织的HE和免疫组化染色结果。
1.3 统计学分析
2 结果
2.1 纯化后胰岛纯度和活性
8只Balb/c小鼠一次纯化可得到(1365±324)个胰岛;胰岛形态圆整,经DTZ染色后,纯度达(95.33±2.62)%。培养后的胰岛经FD-PI染色后,可见胰岛大部分体积呈绿色,活性达(85.31±2.90)%。
2.2 腺病毒感染后胰岛活性
胰岛在不同MOI的rhbFGF- flag-GFP腺病毒感染后,经体外培养12、36 h和60 h后的活性结果如图1和表1所示。在培养12 h时,未感染腺病毒基因的胰岛活性明显高于感染的胰岛(P<0.01),说明腺病毒感染在早期对于胰岛活性有损害;经继续培养至60 h后,胰岛经100 MOI腺病毒感染组的活性有所恢复,与未感染组胰岛无明显差异(P=0.75),因此选择该滴度作为胰岛感染和移植所需的腺病毒滴度。

图1 胰岛经腺病毒感染并培养不同时间后的活性结果(FD-PI染色,×40)。注:活细胞经FD染色显绿色荧光,死细胞经PI染色显红色荧光

表1 腺病毒感染后胰岛活性结果(%)
2.3 胰岛移植后血糖变化
各组小鼠胰岛移植后血糖持续30 d的变化结果如图2所示。单独移植400 IEQ以及感染rhbFGF- flag-GFP腺病毒的200 IEQ胰岛移植后糖尿病小鼠血糖在24 h内降至正常,移植后小鼠血糖控制稳定,并可长时间维持血糖在正常水平(>30 d)。单独200 IEQ以及感染单纯GFP腺病毒的胰岛移植后,部分小鼠的血糖在48 h内有所下降,但并未降至正常,且血糖值波动明显,这说明200 IEQ感染rhbFGF-flag-GFP腺病毒胰岛的肾被膜下移植能够有效控制血糖并减少移植所需胰岛用量。
2.4 糖耐量试验结果
各移植组小鼠在移植后14 d分别测定糖耐量试验(OGTT),结果如图3所示。200 IEQ感染rhbFGF-flag-GFP腺病毒的胰岛移植后,小鼠在葡萄糖灌胃后血糖变化结果明显好于糖尿病小鼠和单独200 IEQ胰岛移植后小鼠(P<0.01),而与正常小鼠和单独400 IEQ胰岛移植后的血糖值变化无明显差异(P=0.63),说明200 IEQ感染rhbFGF-flag-GFP腺病毒胰岛移植后胰岛功能良好,能控制血糖至正常值范围。
2.5 肾被膜下胰岛组织染色结果
肾被膜下胰岛HE和免疫组化染色结果,如图4所示。移植后第14日胰岛在肾被膜下保持了良好的细胞形态;200 IEQ感染rhbFGF- flag-GFP基因组和单独400 IEQ胰岛移植组的胰岛素分泌较单独200 IEQ更旺盛;200 IEQ感染rhbFGF-flag-GFP基因组的CD 31表达,较单独400 IEQ移植组和200 IEQ移植组多,说明转基因组微血管增生更多。

图2 各组小鼠经肾被膜下胰岛移植后血糖连续30 d的变化结果

图3 各移植组小鼠在移植后第14天的OGTT结果
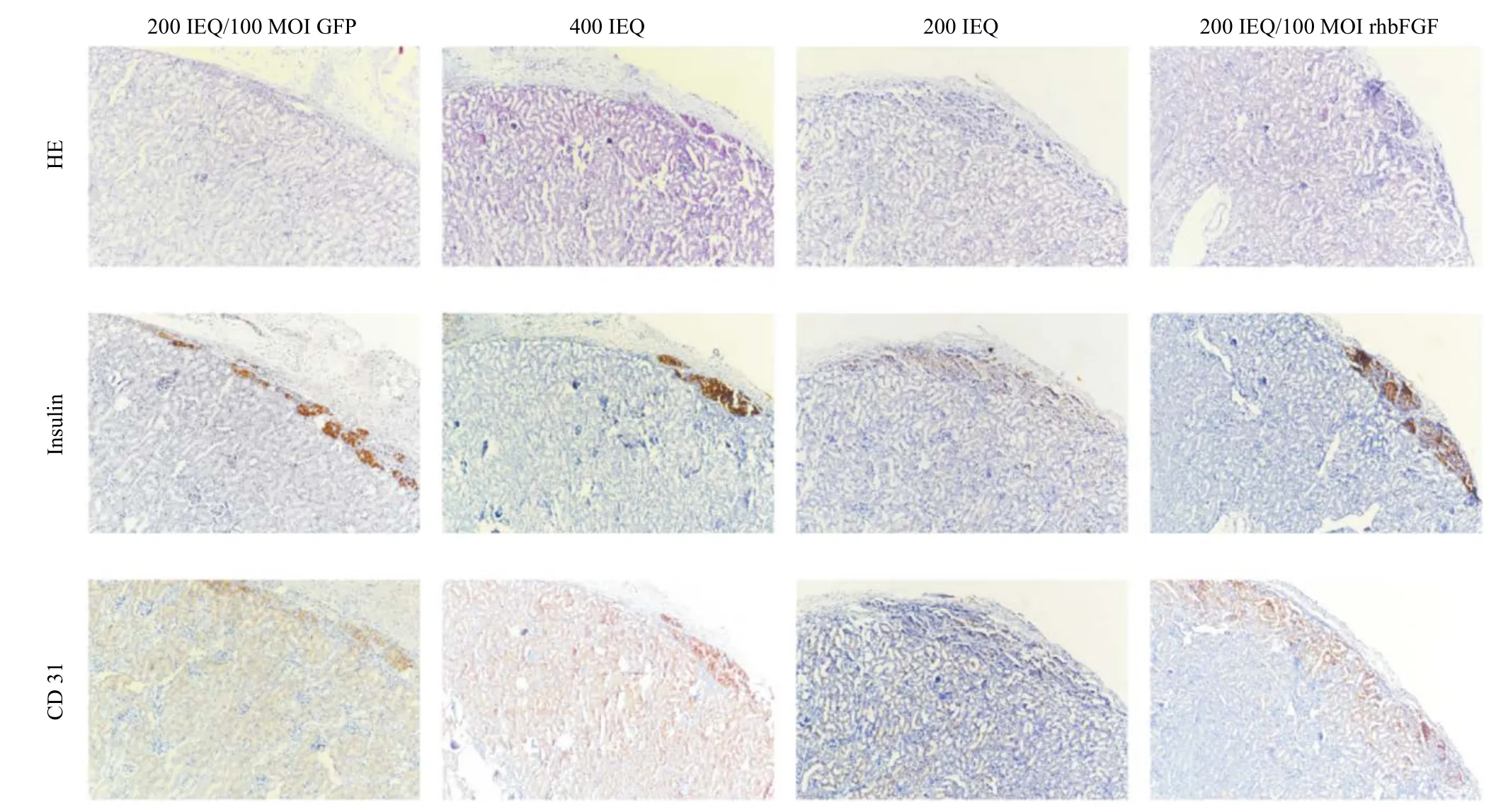
图4 肾被膜下移植胰岛移植后第14天的HE和免疫组化结果(×100)
3 讨论
胰岛在分离和纯化过程中破坏了原有的血管连接,胰岛移植后的微血管重建缓慢[16-17],导致胰岛活力和功能降低。根据前期实验研究发现,bFGF与胰岛共培养后能够增强其活性并有一定的抗凋亡作用,且可促血管再生[18]。为了促进胰岛移植后的微血管重建和增强胰岛功能,在本研究中我们探讨了感染rhbFGF基因的胰岛的肾被膜下再移植。结果表明,感染100 MOI rhbFGF-flag-GFP腺病毒的胰岛经肾被膜下移植后,使用半量胰岛也能取得很好的降血糖结果,且胰岛功能良好;CD31染色也显示移植物在移植部位的微血管重建明显增加。此说明感染rhbFGF-flag-GFP基因的胰岛移植后,微血管重建和胰岛功能均有改善。本研究提供了一种促进胰岛移植后微血管重建的思路,为临床上提高胰岛移植成功率提供参考。
