生物炭对红壤和褐土中镉形态的影响
2019-04-09周涵君韩秋静秦燚鹤张晓远吴福如叶协锋
周涵君,韩秋静,马 静,秦燚鹤,张晓远,吴福如,卢 剑,叶协锋*
(1 河南农业大学烟草学院/国家烟草栽培生理生化研究基地/烟草行业烟草栽培重点实验室,河南郑州 450002;2 云南省临沧市烟草公司,云南临沧 677000;3 四川省烟草公司凉山州公司,四川西昌 615000;4 四川省烟草公司西昌市公司,四川西昌 615000)
随着工业、城市污染的加剧和农用化学品种类、数量的增加,土壤重金属污染日益严重。2014年4月17日我国环境保护部和国土资源部联合发布了《全国土壤污染状况调查公报》,指出我国重金属污染主要涉及Cd、As、Pb等污染物质,其中土壤重金属污染超标率最高的是Cd,达到7.0%[1]。Cd作为生物体的非必需元素,生物毒性极强,极大地影响了作物生长发育和品质形成,直接危害到区域生态系统的稳定,不仅制约了农业的可持续发展,更为严重的是,Cd会通过食物链传递进而危害人体健康[2-3]。因此,重金属污染土壤的修复问题已被国内外很多学者关注。
随着环境科学和土壤科学领域对不同介质中重金属迁移和积累行为研究的深入,认为仅以重金属总量考察土壤重金属的潜在环境风险是远远不够的,重金属对环境危害的大小更大程度上取决于其形态分布,尤其是具有生物有效性形态的含量和存在比例[4-5]。Tessier等[6]将土壤重金属按生物活性的大小划分为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态五种形态。Cd在土壤中的赋存形态受土壤pH、有机质、CEC等多种因素的影响[7]。大量研究表明,土壤有效态Cd含量与土壤pH和有机质含量呈显著负相关关系,土壤pH升高,土壤有机质、粘土矿物和水合氧化物表面的负电荷增多,土壤对Cd2+的吸附能力增强,而土壤pH降低时,碳酸盐结合态Cd溶解释放转化为可溶性Cd2+,导致Cd的生物有效性增加[8-10]。
近年来在修复重金属污染土壤的领域,对生物炭的研究备受关注。生物炭是农林业废弃物在高温隔绝氧气的条件下炭化而成富含炭的固体物质,具有丰富的活性含氧官能团、发达的孔隙结构和较大的比表面积[11],生物炭不仅由于其特殊的孔隙结构对重金属具有较强的吸附效果[12-13],其较高的pH和碳含量对土壤重金属也有显著的降低作用[14-15]。目前,生物炭修复重金属污染土壤的研究更多针对酸性土壤,生物炭对碱性重金属污染土壤中重金属形态分布及生物有效性的研究鲜有报道。因此,本文以两种不同类型的土壤为例 (酸性红壤和碱性褐土),对施加生物炭后土壤Cd形态变化进行对比研究,明确生物炭对不同类型土壤中Cd的稳定化机制,为生物炭修复改良不同类型Cd污染土壤提供理论参考。
1 材料与方法
1.1 供试材料
供试两种类型土壤分别取自重庆市石柱县大田耕层和河南农业大学第三科教园区 (郑州市惠济区),将土壤自然风干后,过2 mm筛。土壤基本性状如表1所示。供试生物炭类型为烟秆炭,购自河南省三利能源有限公司,在450℃低氧条件下制作,pH为9.67、全碳75.60%、有机碳603.50 g/kg、CEC 85.65 cmol/kg、总Cd含量0.088 mg/kg。
1.2 试验设计
1.2.1 污染土壤制备 称取两种过2 mm筛的自然风干土壤各40 kg分别装于20 L塑料盒中,将Cd(NO3)2溶液加入土壤中,使土壤外源Cd含量达到5 mg/kg,添加去离子水调节土壤含水量为田间最大持水量的70%,于室温25℃条件下,平衡两周。风干过2 mm筛待用。
1.2.2 土壤室内培养 使用人工Cd污染土壤,每盆装土1000 g,分别添加生物炭0、5、10、20 g,每个处理3次重复,均匀混合后调节土壤含水量为田间最大持水量的70%,在室温 (25℃) 条件下培养50天左右,每隔2天用称重法补充维持土壤水分,培养1、4、7、14、21、35、49天时取样,每次取样15 g,样品于室内自然风干,过筛,保存备用。
1.3 测定项目与方法
1.3.1 土壤pH和有机碳含量的测定 土壤pH测定水土比2.5∶1,土壤有机碳含量测定采用重铬酸钾外加热法。
1.3.2 土壤重金属形态分级方法 1) 可交换态:称取土壤1.0000 g于50 mL离心管中,加入1 mol/L MgCl2(用 HCl和 NH3·H2O 调 pH = 7) 溶液 8 mL,25℃下150 r/min振荡1 h,离心分离,用0.45 μm滤膜滤取上清液作为原子吸收测定液。洗涤残渣,离心分离,弃去上清液,残渣备用。
2) 碳酸盐结合态:取备用残渣,用去离子水冲洗两遍,加入1 mol/L CH3COONa (用CH3COOH调pH = 5)溶液8 mL,25℃下150 r/min振荡5 h,离心分离,用0.45 μm滤膜滤取上清液作为原子吸收测定液。洗涤残渣,离心分离,弃去上清液,残渣以备下步提取用。
3) 铁锰氧化物结合态:取上步备用残渣,加入0.04 mol/L NH2OH·HCl [25% (V/V) CH3COOH]溶液20 mL,于水浴振荡机(96 ± 3)℃间歇振荡浸提6 h,取出冷却,25℃下150 r/min振荡30 min,离心分离,用0.45 μm滤膜滤取上清液作为原子吸收测定液。洗涤残渣,离心分离,弃去上清液,残渣以备下步提取用。
4) 有机质结合态:取上步残渣,加入0.02 mol/L HNO3溶液3 mL和30%的H2O2(用HNO3调pH = 2)溶液5 mL,室温放置1 h后,于水浴振荡机(85 ± 2)℃间歇振荡2 h,补加30%的H2O2(用HNO3调pH =2) 溶液5 mL,继续间歇振荡3 h,冷却后加入3.2 mol/L CH3COONH4[20% (V/V) HNO3]溶液5 mL,用去离子水稀释至20 mL,25℃下150 r/min振荡30 min,离心分离,用0.45 μm滤膜滤取上清液作为原子吸收测定液。
5) 残渣态:取上步骤残渣,采用5∶1的HF(40%) 和 HClO4(70%) 消解。
上述所得浸提液用原子吸收光谱仪 (日本日立,Z-2000) 测定。每个样品设3个重复,为保证实验的准确性,样品测定过程中同时加入土壤标准物质,加标回收率为89%~103%。
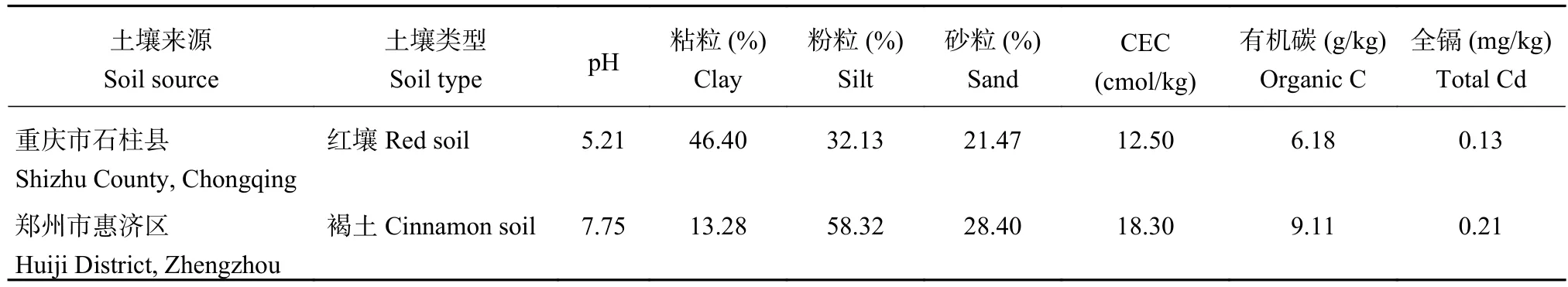
表 1 供试土壤基本性状Table 1 Basic properties of the tested soils
1.4 数据处理
采用Excel2010软件进行数据的基本处理,SPSS22.0统计分析软件进行数据分析。
2 结果与分析
2.1 施用生物炭后土壤pH的变化
施用生物炭后,土壤pH的动态变化如表2所示。红壤中施用生物炭后,在整个培养期,土壤pH均在前14天快速升高,在21天以后变化趋于平稳,且红壤的pH随生物炭施用量的增加呈明显升高的趋势,生物炭添加量表现为2% > 1% > 0.5% >0%。在培养21天以后,1%和2%生物炭添加量土壤pH显著高于0.5%和0%添加量。2%生物炭添加量在培养14天以后,土壤呈碱性,整个培养期,土壤pH升高了1.06个单位。在褐土中施入生物炭,土壤pH在整个培养期有升高的趋势,但变化规律不明显,均在7.3~7.9范围内波动,处理之间差异不显著。
在酸性红壤中施加生物炭能显著提高土壤pH,主要是由于生物炭的灰分中含有较多的盐基离子,如钙、镁、钾、钠等,且都呈可溶态,施入土壤后使土壤的盐基饱和度大幅度提高,土壤中盐基离子可以进行交换反应,降低土壤H+及交换性Al3+水平,同时,生物炭含有碱性物质,当生物炭加入土壤后这些碱性物质能够很快释放出来,中和了部分土壤酸度,使土壤pH升高[16]。生物炭对褐土pH也有提高作用,但效果不显著,由于褐土本身呈弱碱性至碱性,碱性生物炭施入土壤后,土壤体系对环境变化有一定的缓冲作用,因此褐土土壤pH与施用生物炭的关系不显著。
2.2 土壤有机碳含量的变化
由图1可知,随着培养时间的延长,土壤有机碳含量均呈现升高的趋势,但升高趋势较缓且平稳。施用生物炭后,两种土壤有机碳含量均呈现升高的趋势。红壤有机碳含量随生物炭施用量的增加大幅度升高,例如,在培养14天时,添加生物炭1%和2%处理的土壤有机碳含量分别比不添加生物炭增加6.39 g/kg和13.35 g/kg,培养至第49天时,添加生物炭2%处理的土壤有机碳含量是不添加生物炭处理的2.03倍。在整个培养期,褐土的土壤有机碳含量均呈现出高于红壤有机碳含量的趋势,说明在褐土中施用大量生物炭,土壤有机碳含量增加幅度较大,可能是由于褐土本身具有相对较高的有机碳含量。
施用生物炭能显著提高土壤有机碳含量,主要是由于生物炭本身的碳含量高,且生物炭表面存在的部分易分解有机碳可作为一种能源物质被土壤微生物利用[17],从而使生物炭进入土壤初期就具有较高的降解速率。随着培养时间的延长,生物炭表面被钝化且生物炭的强吸附性使土壤中部分微生物被附着在生物炭孔隙内,减少了土壤有机碳与微生物的接触面,从而使后期土壤有机碳含量变化较平稳[18]。
2.3 土壤Cd形态分布的变化
不同类型土壤中Cd形态变化如图2所示。红壤中施用生物炭后,土壤可交换态Cd含量在培养的前7天呈快速下降趋势,随后下降较缓慢,整个培养期间,土壤可交换态Cd含量降幅为0.31~0.82 mg/kg。褐土中土壤可交换态Cd含量在培养初期均小幅上下波动,培养末期含量降低,培养期间,土壤可交换态Cd含量降幅为0.26~0.41 mg/kg。酸性红壤中未施用生物炭对照处理可交换态Cd含量一直处于较高的范围内,为3.48~3.89 mg/kg,施加生物炭后其含量明显降低,尤其是添加生物炭2%处理,整个培养期含量为1.24~2.00 mg/kg。在培养49天时,添加生物炭0.5%、1%和2%处理分别是对照的83.95%、55.79%和35.63%。与酸性红壤相比,碱性褐土可交换态Cd含量整体处于较低的范围,为2.04~2.90 mg/kg。在褐土中施用生物炭后,土壤可交换态Cd含量也有降低趋势,但降幅较小,培养至49天时,添加生物炭0.5%、1%和2%处理土壤可交换态Cd含量分别比对照下降了0.09、0.32和0.54 mg/kg。
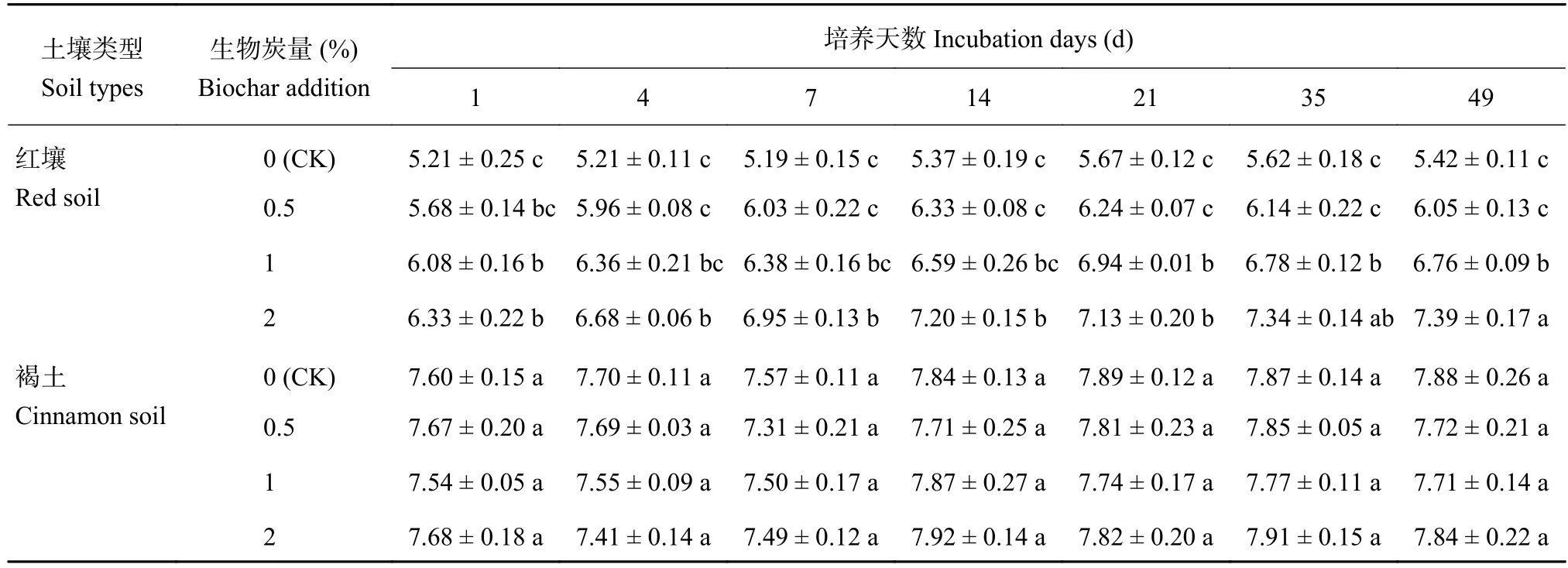
表 2 施用生物炭后土壤pH的变化Table 2 Dynamic changes of soil pH after biochar application
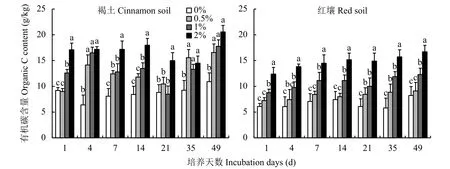
图 1 施用生物炭后土壤有机碳含量的变化Fig. 1 Changes of soil organic carbon content following biochar application
在整个培养期,施用生物炭的碱性褐土中,土壤碳酸盐结合态Cd含量呈现先升高后降低再升高的波浪形变化趋势,最终达到高于培养初期的水平。施加生物炭的酸性红壤中,土壤碳酸盐结合态Cd含量随着培养期的延长呈现持续升高的趋势,前7天快速升高,随后增速变缓。培养至14天时,添加生物炭2%处理土壤碳酸盐结合态Cd含量明显高于其他处理。在整个培养期,对照土壤碳酸盐结合态Cd含量未出现明显波动,且其含量最低,始终在0.26~0.29 mg/kg的范围内。在培养至第7天时,添加生物炭0.5%、1%和2%处理的土壤碳酸结合态Cd含量分别比培养初期提高了14.58%、17.92%和31.66%,培养至35天时,分别是其对照的1.40、2.44和3.46倍,培养至49天时,添加生物炭2%处理的土壤碳酸盐结合态Cd含量高达1.06 mg/kg,高于其他各处理。在碱性褐土中施入生物炭,土壤碳酸盐结合态Cd含量也呈升高的趋势,但升高幅度明显小于酸性红壤。
培养初期,不同处理土壤Fe、Mn氧化物结合态Cd含量呈现小幅波动,在培养末期均呈现升高的趋势。红壤中施用生物炭后,土壤Fe、Mn氧化物结合态Cd含量明显大幅升高,培养至35天,添加生物炭0.5%、1%和2%处理分别是对照的1.59、2.08和3.25倍,培养至49天时,添加生物炭2%处理的土壤Fe、Mn氧化物结合态Cd含量高达1.84 mg/kg。碱性褐土中施用生物炭后,土壤Fe、Mn氧化物结合态Cd含量升高幅度较小,培养至35天时,添加生物炭0.5%、1%和2%处理分别是对照的1.11、1.16和1.29倍。
土壤有机结合态Cd含量在整个培养期变化幅度均相对较小。在红壤中施入生物炭,土壤有机结合态Cd含量提高幅度相对较大,例如培养1天时,添加生物炭0.5%、1%和2%处理分别是对照的1.09、1.63和2.03倍。在碱性褐土中施入生物炭,土壤有机结合态Cd含量也呈现升高的趋势,但升高幅度较小。
在整个培养期,褐土中残渣态Cd含量呈现先升高后降低再升高的变化趋势,红壤中残渣态Cd含量在培养前7天呈快速升高的趋势,之后变化平缓。培养末期,褐土和红壤中残渣态Cd含量均表现为缓慢增加。添加生物炭0%、0.5%、1%和2%处理的红壤残渣态Cd含量分别增加了0.03、0.13、0.16和0.12 mg/kg,褐土残渣态Cd含量分别增加了0.07、0.05、0.09、0.13 mg/kg。
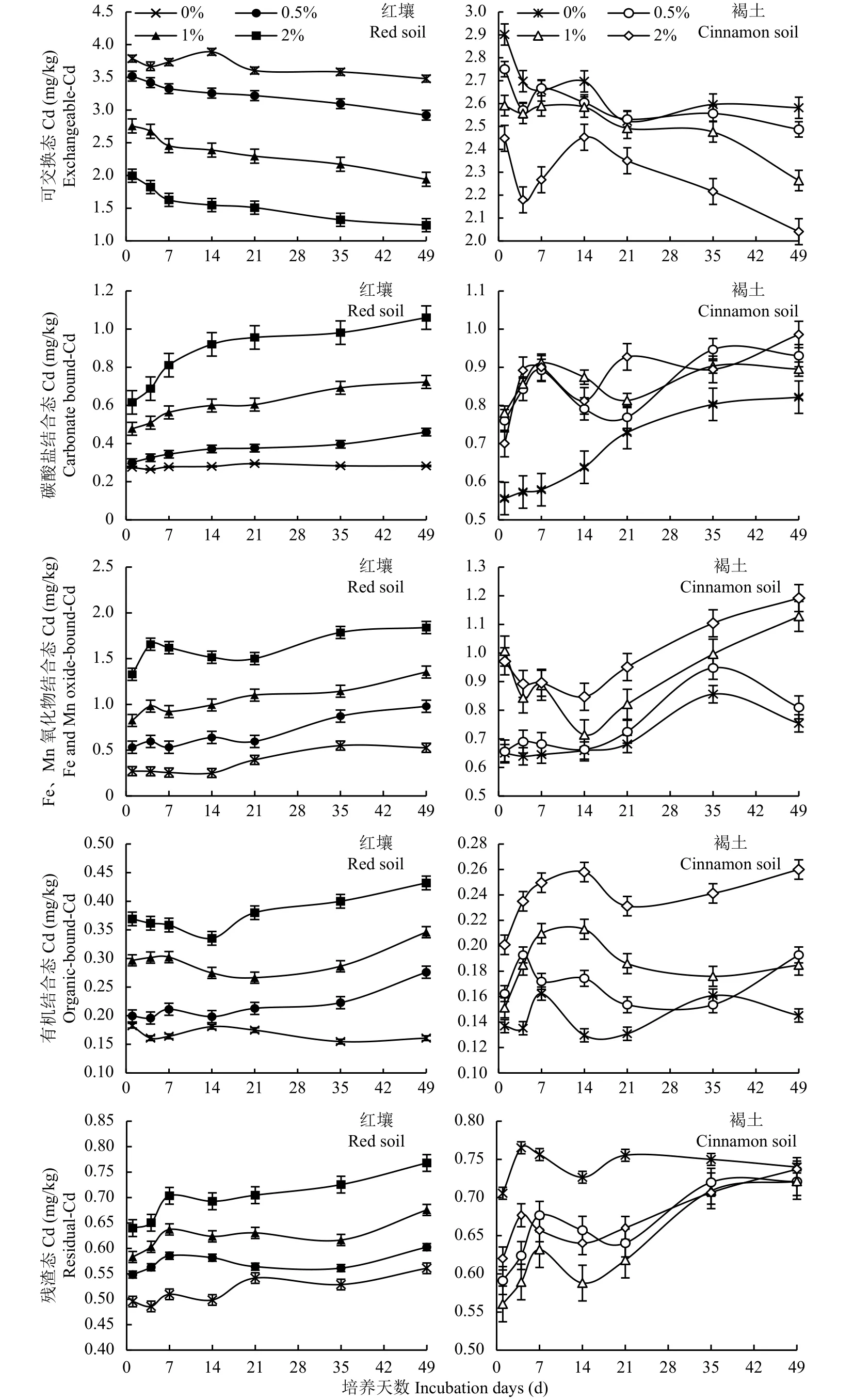
2.4 生物炭对土壤不同形态Cd比例的影响
培养结束时,土壤各形态Cd在土壤中所占比例如图3所示,土壤可交换态Cd所占比例最大,其次是土壤Fe、Mn氧化物结合态Cd,有机结合态Cd最低。红壤中,对照土壤可交换态Cd所占比例最大,达到69.46%,随着生物炭的施用,土壤可交换态Cd所占比例大幅度降低,添加生物炭2%处理降至23.22%。褐土中可交换态Cd所占比例随生物炭的施用也呈降低趋势,但降低幅度较小,添加生物炭0.5%~2%处理比对照降低了2.82%~12.07%。施用生物炭后,土壤碳酸盐结合态Cd和Fe、Mn氧化物结合态Cd占比均明显升高,褐土的碳酸盐结合态Cd和Fe、Mn氧化物结合态Cd分别比对照升高了0.94%~2.61%、0.80%~7.90%,红壤的碳酸盐结合态Cd和Fe、Mn氧化物结合态Cd所占比例分别比其对照增加了3.14%~14.21%、8.20%~23.96%。
2.5 土壤Cd形态与土壤pH、有机碳含量和生物炭施用量的相关性
由表3可以看出,褐土中,土壤有机碳含量与土壤可交换态Cd呈极显著负相关关系,与土壤碳酸盐结合态Cd,土壤Fe、Mn氧化物结合态Cd,土壤有机结合态Cd呈极显著正相关关系。红壤中,土壤pH和有机碳含量均与土壤可交换态Cd呈极显著负相关关系,与土壤其他四种形态Cd呈极显著正相关关系。生物炭施用量与土壤可交换态Cd之间存在极显著负相关关系 (碱性褐土r= -0.786,酸性红壤r= -0.967,P< 0.01),与土壤碳酸盐结合态Cd、土壤Fe、Mn氧化物结合态Cd和土壤有机结合态Cd存在极显著正相关关系。在酸性红壤中,各形态Cd与生物炭施用量的相关系数均大于在碱性褐土中的相关系数。
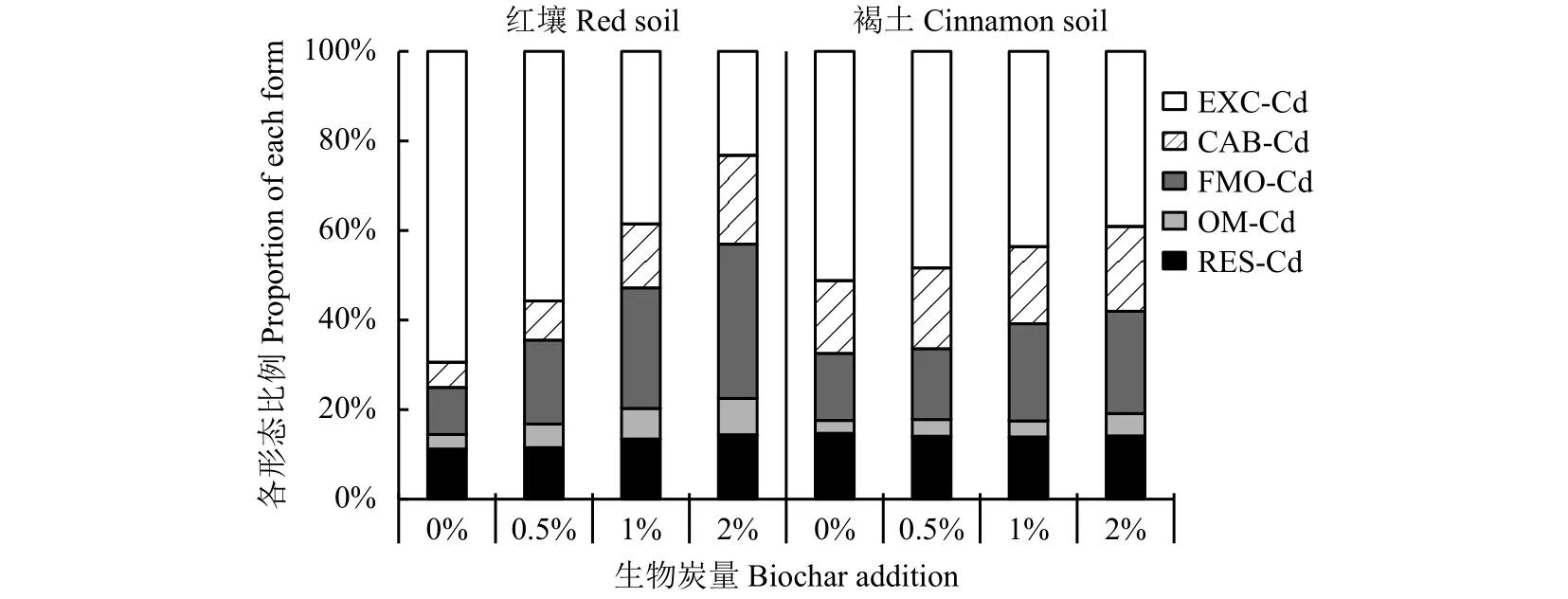
图 3 生物炭施用对不同形态Cd所占比例的影响Fig. 3 Effect of biochar application on proportion of different forms of Cd
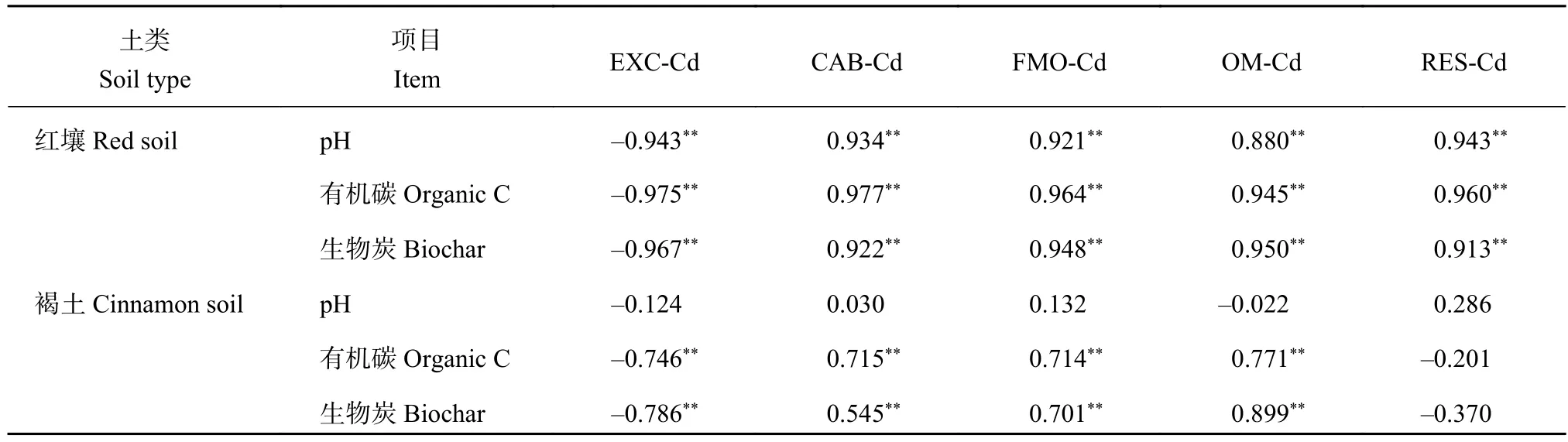
表 3 土壤各形态Cd与土壤pH、有机碳含量和生物炭施用量的关系Table 3 Relationship between soil Cd forms and soil pH, organic carbon content and rate of biochar
3 讨论
土壤重金属形态及有效性与其在土壤中的稳定时间长短密切相关[19],重金属在土壤中的时间越长,其有效态含量越低,并逐渐趋于稳定[20]。本研究结果表明,红壤中施用生物炭后,土壤可交换态Cd含量在培养的前7天呈快速下降趋势,随后下降较缓慢;褐土中施用生物炭后,培养14天后土壤可交换态Cd呈缓慢下降趋势。其他形态Cd含量也是在培养前7到14天变化较剧烈,随后变化趋于平稳,与秦余丽等[15]研究结果相似。褐土的碳酸盐结合态Cd含量和有机结合态Cd含量在培养前21天内表现出先升高后降低的趋势,Fe、Mn氧化物结合态Cd含量呈现相反的变化趋势,说明在培养过程中,土壤中各形态Cd之间一直处于动态平衡的转化中。
环境中重金属的存在特征是揭示重金属迁移转化规律和生物有效性大小的重要指标。在Tessier等[6]提出的分组法中,交换态为生物易利用态,碳酸盐结合态、铁锰氧化物结合态、有机结合态为中等可利用态,残渣态主要为矿物质结合态,极其稳定,属于生物难利用态,对重金属的迁移和生物可利用性贡献不大。已有研究表明[15,21],降低Cd在土壤中的有效态含量和迁移性,从而减少Cd向植物体的迁移和积累,是控制土壤Cd通过食物链传递产生危害的一个重要环节,而土壤pH、土壤有机质含量和CEC含量是影响土壤Cd生物有效性的重要因素。pH是土壤化学性质的综合反映,pH改变可导致土壤中重金属赋存形态改变[22]。本研究表明,在红壤中施加生物炭后,土壤pH与土壤可交换态Cd含量呈极显著负相关关系,即在酸性土壤中,土壤有效态Cd含量随着土壤pH的升高而降低,原因可能是由于施加生物炭后,生物炭本身较高的pH使土壤pH明显升高,而土壤pH升高时,一方面使土壤中粘土矿物、水合氧化物和有机质表面的负电荷也增加,因而对Cd2+的吸附力增强,也会促进CdCO3和Cd(OH)2沉淀的生成[23],同时生成的Cd沉淀也是施入生物炭使土壤碳酸盐结合态Cd含量升高的原因。另一方面,土壤pH升高时H+浓度减小,降低了H+和Cd2+在吸附位点上的竞争,使得土壤中的有机质、铁锰氧化物等与重金属的结合更紧密。研究结果中,红壤和褐土有机碳含量均与土壤可交换态Cd呈极显著负相关关系,与土壤碳酸盐结合态Cd,土壤Fe、Mn氧化物结合态Cd和有机结合态Cd呈极显著正相关关系,由于生物炭施入土壤中,生物炭具有的较大比表面积及生物炭表面大量的含氧官能团 (羧基和酚羟等),不仅对土壤Cd具有较强的吸附作用,其大量的官能团还通过络合或螯合作用与土壤溶液中的Cd2+反应形成难溶性络合物。其次生物炭的施用还使褐土和红壤有机碳含量大幅度增加,土壤有机碳会和土壤粘土矿物、氧化物等无机颗粒结合成有机胶体和有机-无机复合胶体,增加土壤的表面积和表面活性,使得其对重金属离子具有较强的吸附能力[24]。生物炭本身还具有较高的CEC含量,生物炭在土壤中存在自由颗粒并能够在其微团聚体内部富集,与土壤颗粒形成土壤团聚体和有机无机复合体,使得土壤CEC增大,对阳离子的吸附能力更强[25],从而表现出土壤对重金属Cd的固持作用。生物炭施用量与红壤的残渣态Cd含量呈极显著正相关关系,但相关系数最小,与褐土的残渣态Cd含量无显著相关关系,高瑞丽等[26]也得到相似的研究结果。
在整个培养期,红壤可交换态Cd含量的变化范围大于褐土可交换态Cd含量的变化范围,首先可能是由于褐土的有机碳含量和盐基饱和度均高于红壤,而有机碳对土壤重金属具有净化机制,且较高的CEC能够降低土壤有效态Cd含量,使褐土在老化过程中就已经钝化了大量Cd,可能也与成土母质密切相关,褐土中含有大量的水云母和蛭石等2∶1型硅酸盐矿物,使其在施用生物炭前就具有较大的比表面积和较强的吸附能力;其次是在有机碳较低的土壤中,施用生物炭对提高土壤CEC的作用特别明显,而在有机碳含量高的褐土中生物炭对提高土壤CEC的作用相对较弱[27],使得施加生物炭后红壤的可交换态Cd含量变化范围较大。红壤中施用大量生物炭后,Fe、Mn氧化物结合态Cd含量明显高于褐土,是由于红壤中富含大量的铁铝氧化物,施入的生物炭提高土壤pH可使土壤中的CdOH+与吸附位点的亲和力增强,促使重金属离子向铁锰氧化物结合态转化。整个培养期,两种类型土壤的有机结合态Cd所占比例均最低,与刘丽娟等[28]、吴岩等[29]的研究结果相似,可能是由于培养时间较短,虽然生物炭的施入能促使Cd向螯合态转变,但转化效率较低。
综上所述,生物炭可以降低红壤和褐土中有效态Cd含量,使土壤碳酸盐结合态Cd含量,土壤Fe、Mn氧化物结合态Cd含量,有机结合态Cd含量和残渣态Cd含量升高,但由于红壤和褐土性质不同 (土壤pH、有机质含量、粘粒含量等),使生物炭对红壤的修复效果优于对褐土的修复效果,因此,可以考虑将生物炭作为一种酸性Cd污染土壤修复改良材料。虽然目前室内及田间模拟试验表明在短期内生物炭对土壤具有一定的改良作用,但生物炭对土壤的长期效应还需进一步研究。
4 结论
1) 生物炭对褐土pH的提高作用不显著。
2) 红壤pH随生物炭施用而升高,培养21天后,生物炭施加量大于1%的处理土壤pH显著高于其他处理;培养14天后,施加2%的生物炭,土壤由酸性变为弱碱性。
3) 添加生物炭主要增加了碳酸盐结合态Cd含量,显著降低了可交换态Cd含量。培养7天后,施用生物炭大于1%时,红壤碳酸盐结合态Cd含量增幅大于其他处理,培养49天后,红壤可交换态Cd含量降低0.31~0.82 mg/kg,处理2%的碳酸盐结合态Cd含量最高,为1.06 mg/kg。
4) 土壤有机碳含量和生物炭施用量均与两种土壤可交换态Cd呈极显著负相关,与土壤碳酸盐结合态Cd,土壤Fe、Mn氧化物结合态Cd和土壤有机结合态Cd呈极显著正相关,但红壤的各相关系数均大于褐土的各相关系数。
