肿瘤相关巨噬细胞促进宫颈癌侵袭转移的机制研究
2019-04-03陈晓静王薇周琛斐魏文斐吴湘光严瑞明张延梅梁罗娇吴砂梁莉钟梅余艳红
陈晓静,王薇,周琛斐,魏文斐,吴湘光,严瑞明,张延梅,梁罗娇,吴砂,梁莉,钟梅,余艳红
0 引言
肿瘤微环境(tumor microenvironment, TME)是肿瘤细胞赖以生存和发展的微生态系统,其独特的生物学特性对于肿瘤发生发展与转移复发具有重要作用[1-2]。肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)在肿瘤间质中高度浸润,是TME中的重要炎性细胞,与肿瘤进展、转移和不良预后密切相关[3-4]。巨噬细胞在局部微环境的作用下获得其独特表型特征,根据其表型不同可分为杀伤肿瘤的经典激活型巨噬细胞(M1)和促进肿瘤的替代激活型巨噬细胞(M2)[5]。M2型TAMs可通过上调肿瘤细胞促癌基因的表达,增强其侵袭转移能力[6]。本研究观察了M2型TAMs在宫颈癌进程中的分布情况,探索了M2型TAMs对宫颈癌细胞生物学行为的影响及其可能机制,为抑制TME促宫颈癌侵袭迁移提供新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 组织样本 95例宫颈组织蜡块样本均来自南方医科大学南方医院病理科的组织样本库(2011—2013年),包含正常宫颈组织16例、宫颈上皮内瘤变41例(19例CINⅠ、22例CINⅡ~Ⅲ)和宫颈鳞状上皮细胞癌38例。
1.1.2 细胞系 人宫颈癌细胞系SiHa和C33a、人单核巨噬细胞系THP1均购自美国典型培养物保藏中心(ATCC)。
1.1.3 主要试剂 DMEM培养基(Gibco,美国Thermo Fisher Scientific公司),胎牛血清FBS(四季青,浙江天杭生物科技有限公司),抗CD163抗体(北京中杉金桥公司),抗E-cadherin抗体、抗N-cadherin抗体、抗Vimentin抗体、抗MMP-9抗体(美国Cell Signaling Technology公司),SP二步法试剂盒(北京中杉金桥公司),MMP-9引物合成(上海英潍捷基生物公司),超敏ECL发光液(北京Biosharp公司)。
1.2 方法
1.2.1 免疫组织化学检测 组织芯片经枸橼酸钠修复液(pH6.0)进行抗原修复(高压修复,5 min),抗CD163抗体(浓度1∶800)4℃孵育过夜,二抗室温孵育30 min,DAB显色液反应2 min。
1.2.2 Western blot检测 提取细胞总蛋白变性处理后,蛋白上样量25 μg,用8%聚丙烯酰氨凝胶电泳分离。一抗(E-cadherin 1:1 000; N-cadherin 1:1 000; Vimentin 1:1 000; MMP-9 1:500)4℃孵育过夜,二抗(浓度1:5 000)室温孵育1 h,超敏ECL发光液显色并拍照。
1.2.3 RT-qPCR检测 提取总RNA,取2.5 μg总RNA反转录成cDNA。RT-qPCR扩增条件如下:95℃预变性5 min,95℃变性5 s,59℃退火30 s,72℃延伸30 s,40次循环。
1.2.4 划痕实验 将细胞按2×105个/孔接种于培养板,待细胞形成单层后,采用10 μl Tip滴头在培养板呈直线形划痕单层细胞,划痕形成后采用磷酸盐缓冲液 (PBS)冲洗2次,并记录不同时间段(0 h、48 h)划痕区域细胞的迁移情况。
1.2.5 Transwell侵袭实验 经预处理的细胞消化,用无血清培养基DMEM重悬细胞,Transwell上室铺有Matrigel胶并加入1×105个细胞,下室加800 μl含10%FBS的培养基,8 h后取出小室,棉签擦净上室面的Matrigel胶及未穿透的细胞,4%多聚甲醛固定20 min,结晶紫染色20 min,流水洗涤5 min,正置相差显微镜下观察拍照。
1.3 统计学方法
采用SPSS20.0软件,组间数据采用独立样本t检验和单因素方差分析(one-way ANOVA)进行检验。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 TAMs浸润数目与宫颈病变程度呈正相关
利用不同病变程度的宫颈组织病理切片,以CD163标记M2型TAMs,结果显示CD163主要表达于细胞间质,其浸润程度随宫颈病变的进展而增加,见图1;进一步分析CD163的表达强度与宫颈病变临床特征的关系发现,CD163+TAMs在宫颈癌组织中的表达与FIGO分期(P=0.012)、淋巴结转移(P=0.009)呈正相关,但与患者年龄、组织分化程度无关(均P>0.05),见表1。以上结果提示CD163+TAMs与宫颈上皮恶性转化和进展密切相关。
2.2 TAMs促进宫颈癌细胞侵袭和迁移
悬浮的人THP1单核细胞用佛波酯(PMA)处理后,增殖停止并贴壁,被诱导为未分化的巨噬细胞M0;再加入IL4和IL13,活化为M2型TAMs,CD163表达明显增高,见图2,用于后续研究。
实验分为Blank、THP1-上清液(conditioned media, CM)和TAMs-CM刺激组。细胞形态学观察显示,TAMs-CM刺激后,宫颈癌细胞系SiHa和C33a形态发生显著改变,见图3。Blank和THP1-CM刺激组细胞为“立方形、边缘圆钝”的上皮细胞结构,细胞间融合度高;TAMs-CM刺激宫颈癌细胞系SiHa和C33a呈现瘦长的间质细胞样改变,表现为“长梭形、伪足伸长、甚至出现单个细胞迁移,细胞间融合度降低”。
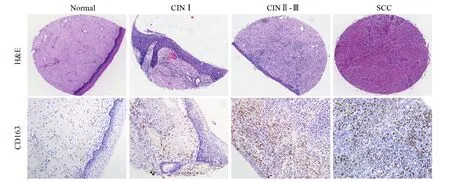
图1 CD163在宫颈病变中的表达情况 (×200)Figure1 Expression of CD163 in cervical lesions (×200)
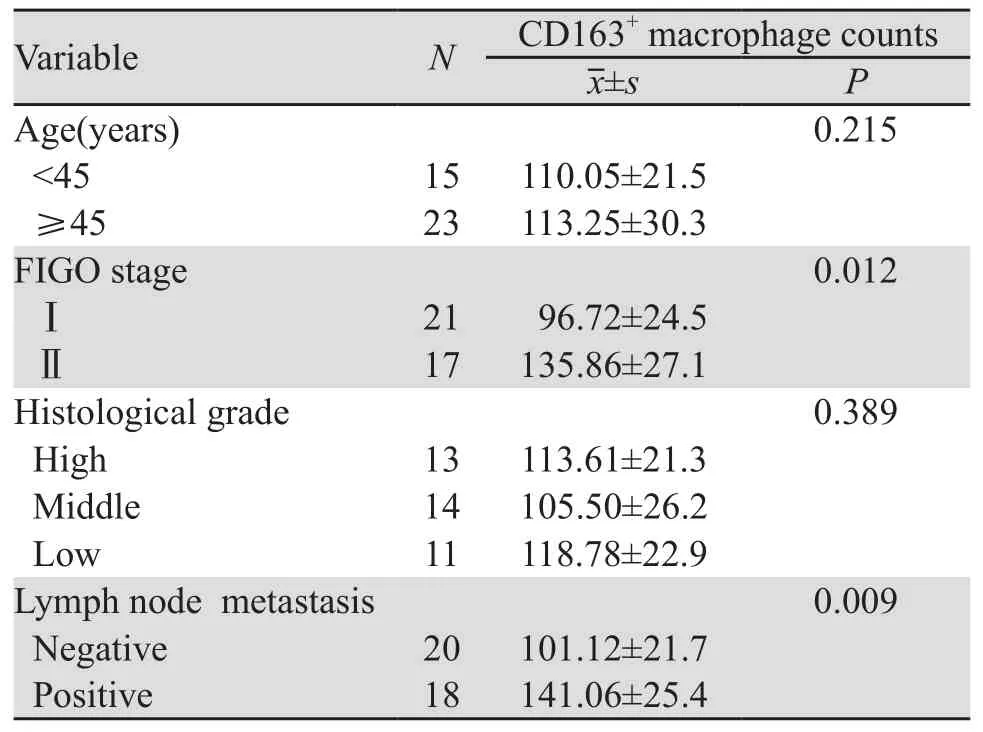
表1 CD163与宫颈癌临床病理参数的相关性分析Table1 Correlation of CD163 expression with clinicopathologic features of cervical cancer patients
划痕实验结果显示,TAMs-CM刺激后,宫颈癌细胞系SiHa和C33a迁移能力较Blank、THP1-CM刺激组显著增强,差异有统计学意义(P=0.023,P=0.015),见图4A。Transwell侵袭实验结果显示,TAMs-CM刺激后,宫颈癌细胞系SiHa和C33a的穿膜细胞数较Blank和THP1-CM刺激组显著增加,差异有统计学意义(P=0.007,P=0.010),见图4B,表明TAMs可显著增强宫颈癌细胞的体外侵袭能力。
2.3 TAMs诱导宫颈癌细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT)
Western blot结果显示,与Blank和THP1-CM刺激组相比,TAMs-CM组SiHa和C33a细胞上皮标志蛋白E-Cadherin的表达下调,间质标志蛋白N-Cadherin和Vimentin的表达上调,见图5,提示TAMs可诱导宫颈癌细胞发生EMT。
2.4 TAMs对宫颈癌细胞系MMP-9的表达调控作用
利用Western blot及RT-qPCR分别检测不同条件巨噬细胞对宫颈癌细胞系SiHa和C33a的MMP-9蛋白和RNA表达水平的影响,结果提示TAMs-CM作用于SiHa和C33a宫颈癌细胞系后,MMP-9显著上调,与对照组THP1-CM相比,差异有统计学意义,见图6A。RNA水平的检测也得到一致的结果,见图6B。提示TAMs促进宫颈癌细胞的恶性变可能是通过上调MMP-9的表达实现的。
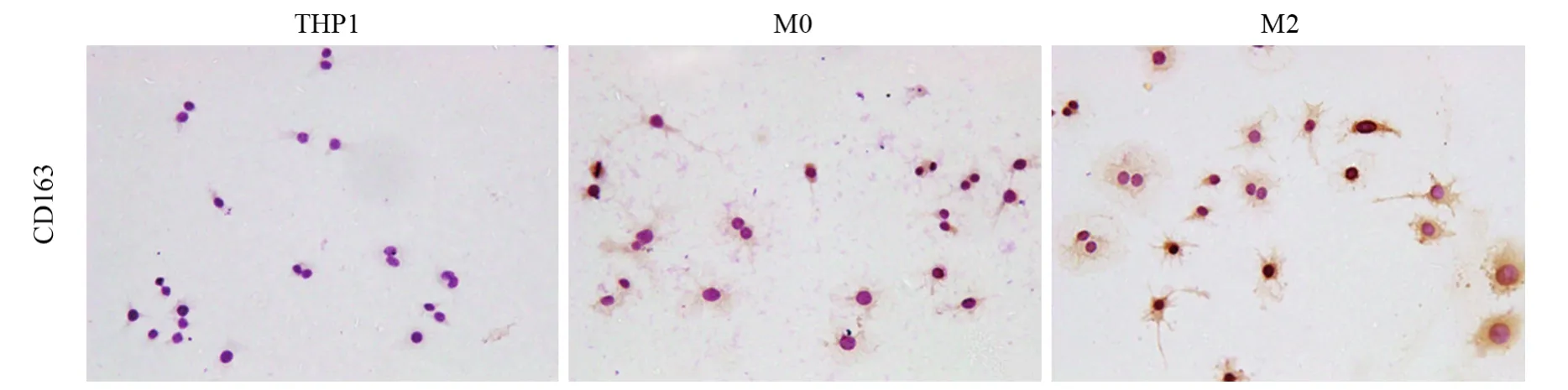
图2 免疫细胞化学法(ICC)检测不同激活状态的巨噬细胞CD163的表达Figure2 Immunocytochemistry(ICC) detection of CD163 expression in macrophages with different activation states
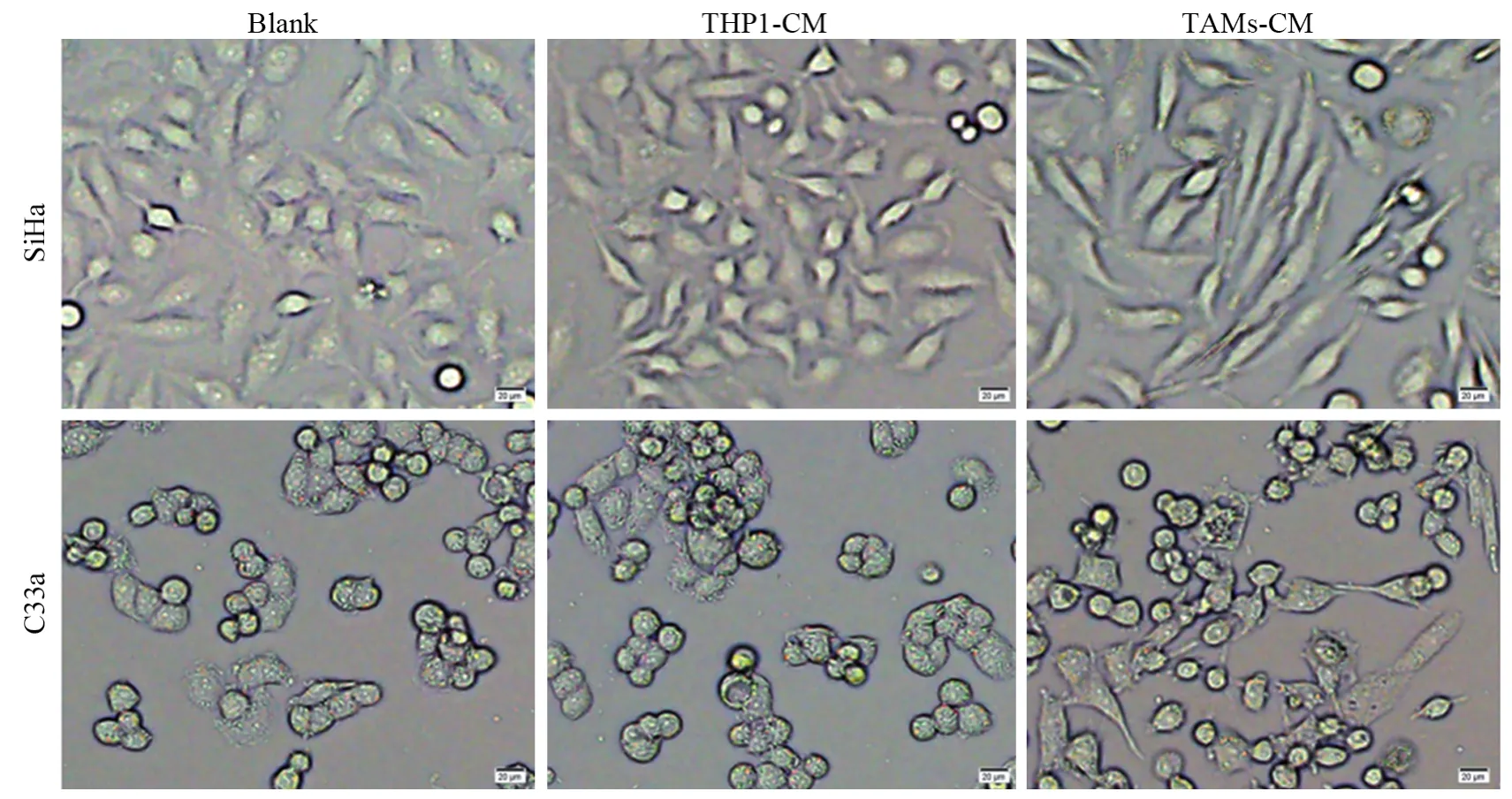
图3 Blank、THP1-CM和TAMs-CM刺激组中SiHa和C33a细胞的形态学改变Figure3 Morphological changes of SiHa and C33a cells in Blank, THP1-CM and TAMs-CM stimulation groups
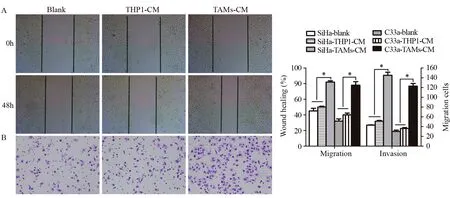
图4 划痕(A)及Transwell(B)实验检测TAMs对宫颈癌细胞株SiHa迁移和侵袭行为的影响Figure4 Effect of TAMs on migration and invasion of cervical cancer SiHa cell lines detected by scratch(A) and Transwell(B) assays
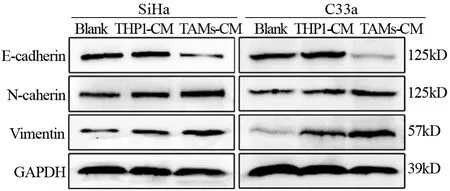
图5 TAMs对宫颈癌细胞系上皮间质转化(EMT)的影响Figure5 Effect of TAMs on EMT of cervical cancer cell lines
3 讨论
炎性反应微环境在肿瘤的进展中发挥着重要作用,巨噬细胞是肿瘤微环境中浸润性炎性细胞的主要成分。研究表明,TAMs与多种恶性肿瘤的发生发展存在直接关系[3,6-7]。本研究结果提示,组织中CD163+TAMs浸润程度随着宫颈癌变病程进展而明显增高,并与宫颈癌FIGO分期及盆腔淋巴结转移的发生呈明显正相关,提示TAMs浸润增多及其伴随的炎性反应微环境加重可能参与宫颈癌病变的发生发展。可见,M2型TAMs在肿瘤组织中的募集提示宫颈癌的不良预后。因此,研究TAMs影响宫颈癌细胞的作用机制并作出针对性干预对于指导宫颈癌临床预后具有重要意义。
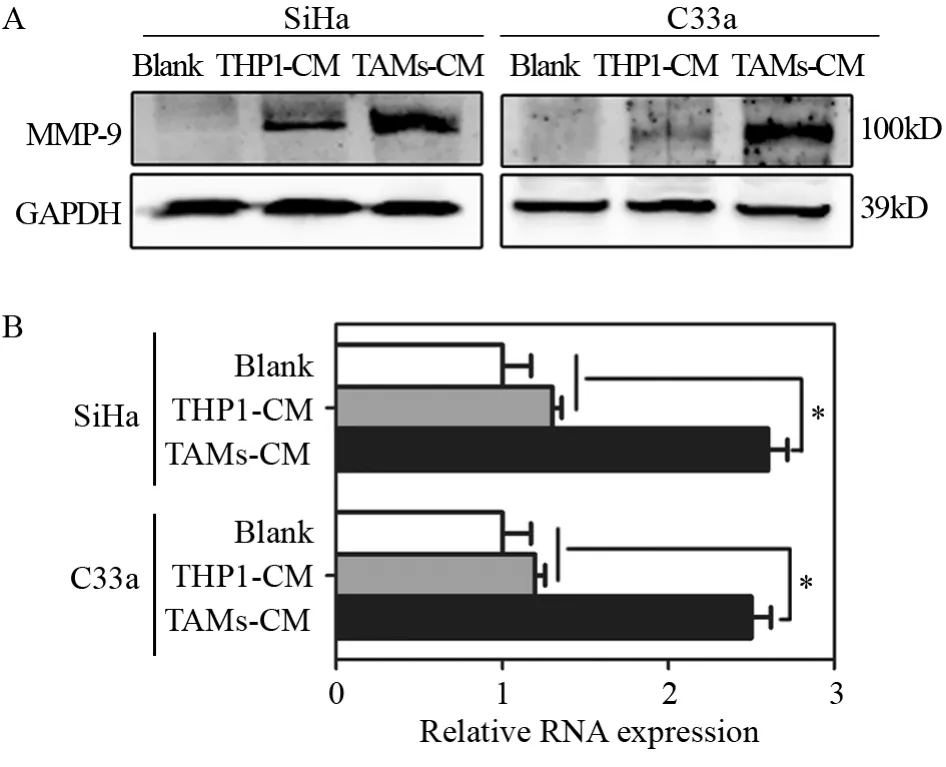
图6 Western blot(A)和RT-qPCR(B)实验检测TAMs对宫颈癌细胞系MMP-9表达的影响Figure6 Effect of TAMs on MMP-9 expression in cervical cancer cell lines detected by Western blot(A) and RT-qPCR(B) assays
局部浸润和远处转移是恶性肿瘤最重要的特征之一,其中EMT在该过程中发挥关键作用,是恶性肿瘤获得侵袭表型的重要步骤,并成为近年来的研究热点[8-10]。研究表明,TAMs可分泌多种EMT相关细胞因子如TGF-β、CCL18、EGF等[11-12]。在口腔鳞癌中,TAMs可通过激活Gas6/Axl-NF-kB通路发挥促肿瘤作用并介导EMT的发生[13]。TAMs还能通过TGF-β和β-catenin通路介导EMT的发生[14]。本研究中,TAMs-CM刺激的宫颈癌细胞形态发生显著改变,胞体由“立方形、边缘圆钝”的形态变为长梭形,伪足不同程度增多且变得细长,细胞融合度降低,甚至出现单个细胞迁移,失去上皮细胞特性,显示更多的间质细胞样特性,提示发生了一定程度的EMT。我们通过功能实验验证,发现TAMs-CM刺激组的长梭形宫颈癌细胞侵袭和迁移显著增强,而且发生EMT表型变化,提示宫颈癌细胞发生形变后,细胞间黏附变差,侵袭转移能力增强。由此我们推测TAMs可改变宫颈癌细胞的生物学行为,在宫颈癌进展中起着重要作用。
MMPs是一类高度保守的Zn2+依赖的内源性蛋白水解酶家族,在肿瘤细胞侵袭和转移灶的形成过程中起重要作用[15]。MMP-9是MMPs家族最重要的成员,在癌细胞介导的细胞外基质降解中起关键作用,可破坏基底膜从而促进癌细胞的浸润和转移[16]。MMP-9在乳腺癌、胰腺癌、前列腺癌等多种肿瘤细胞高表达,与不良预后密切相关[17-19]。有研究认为,MMP-9的表达是宫颈癌发生的早期事件[20-21]。另外,MMP-9在机体免疫调控中亦扮演重要角色。有研究证实MMP-9加强肿瘤免疫逃逸进而促进肿瘤进展[22]。有研究发现,高表达MMP-9的肿瘤细胞恶性程度更高[23],与我们的研究结果相吻合。肿瘤细胞招募TAMs造成炎性反应微环境,而招募的巨噬细胞又可促进肿瘤细胞的侵袭转移,形成恶性循环[24]。TAMs-CM刺激后的宫颈癌细胞高表达MMP-9,且侵袭迁移能力显著增强,进一步提示MMP-9可能作为中枢环节参与TAMs与肿瘤细胞之间的调控机制。
综上所述,我们提出一个新的宫颈癌侵袭转移的调控机制:TME中TAMs上调宫颈癌细胞MMP-9的表达,从而促进宫颈癌细胞的侵袭、转移。靶向TME中TAMs及MMP-9的治疗,将为宫颈癌的治疗和预后提供新的指导依据与干预视角。
