丙酮酸激酶同工酶M2在胆囊癌组织中的表达及其对胆囊癌细胞生物学活性的影响
2019-04-03陈建安陈思玉刘丽文陈晓龙朱威威何玉婷孙冉冉任志刚崔光莹余祖江
陈建安,陈思玉,刘丽文,陈晓龙,朱威威,余 炎,何玉婷,孙冉冉,任志刚,李 娟,崔光莹,余祖江
郑州大学第一附属医院感染科 郑州 450052
胆囊癌(gallbladder cancer,GBC)是胃肠道系统中第七位高发的恶性肿瘤,同时也是胆道系统中最常见和最具侵袭性的肿瘤[1]。由于其早期无明显症状,故诊断困难,加之易发生远处转移,胆囊癌患者的5 a生存率低于5%[2-3]。到目前为止,外科手术切除仍是最有效的治疗方法,但是大多数患者在确诊时已经失去了最佳手术时间[4]。因此,阐明GBC发生发展机制,探索有效的预后生物分子标志物,可能对胆囊癌的靶向治疗有一定的作用。有研究[5]报道,肿瘤细胞能够通过一种异常的糖代谢行为来躲避细胞凋亡程序,增强自身的增殖和侵袭能力,这种异常的糖代谢行为叫作Warburg效应,是肿瘤得以发生发展的关键因素。 丙酮酸激酶同工酶M2(pyruvate kinase M2,PKM2)是丙酮酸激酶的同种型之一,也是糖酵解的关键限速酶。近年来大量研究[6-8]证明PKM2与胃癌、舌癌和肝癌等多种肿瘤的发生发展有关;且PKM2过表达与这些患者的预后不良有关,但PKM2在胆囊癌中的表达及作用鲜有报道。为此,作者进行了如下研究。
1 材料与方法
1.1细胞株和主要试剂人胆囊癌GBC-SD和NOZ细胞株购自中国科学院细胞库。DMEM培养基购自美国 Gibco 公司,标准胎牛血清购自美国HyClone 公司,PKM2和GAPDH抗体购自武汉三鹰生物技术有限公司,PKM2 siRNA(序列为5’-CCAUAAUCGUCCUCACCAATT-3’)及阴性对照siRNA(序列为5’-CCAGUUUACCUAACGCAAUTT-3’)由上海吉玛制药公司设计合成,脂质体转染试剂盒购自美国Invitrogen公司, MTT试剂购自碧云天生物技术有限公司,Matrigel胶和Transwell小室购自美国BD公司,DAB溶液购自美国Boster公司,葡萄糖测试试剂盒购自中国普利莱基因技术有限公司,ATP检测试剂盒购自美国Cayman Chemical公司;乳酸检测试剂盒购于美国Sigma公司。
1.2胆囊癌组织与癌旁正常组织中PKM2蛋白表达的免疫组化检测收集2009年4月至2014年4月在郑州大学第一附属医院行胆囊癌手术切除患者的胆囊石蜡包埋组织,包括53例胆囊癌组织和27例癌旁正常组织。组织经过脱苯脱蜡抗原修复等步骤,加兔抗人PKM2抗体(按1∶200稀释)室温孵育2 h,PBS洗片后加羊抗兔二抗室温孵育1 h,用DAB溶液显示信号。由两名病理学家以双盲法进行阅片,在200倍显微镜下选取3个视野,参照Remmele评分系统[9]按染色区域百分比进行评分:无染色为阴性(-),<25%为+,25%~为,50%~为,>75%为。该研究得到了郑州大学第一附属医院伦理委员会的批准。
1.3细胞培养及转染GBC-SD和NOZ细胞复苏后放在含体积分数10%胎牛血清和100 U/mL青霉素、100 mg/L链霉素的DMEM培养基、37 ℃、体积分数5%CO2的培养箱中进行培养。分别收获对数生长期的GBC-SD和NOZ细胞接种于6孔板,用脂质体2000分别转染PKM2 siRNA、阴性对照siRNA,48 h后进行后续实验。
1.4细胞增殖的MTT法检测将转染48 h后的细胞以每孔5×104个/mL的密度接种于96孔板,培养1、2、3、4和5 d后分别加入5 g/L无菌MTT溶液20 μL。37 ℃孵育4 h后弃去上清继续培养4 h,每孔加入DMSO 150 μL,振荡混匀,检测490 nm处的吸光度值。每组均设3个复孔。
1.5细胞中PKM2表达的免疫荧光法检测将GBC-SD和NOZ细胞以每孔2×105个/mL的密度接种于24孔板,孵育24 h后取出细胞爬片,待40 g/L多聚甲醛固定及体积分数10%山羊血清室温孵育2 h后,加入体积分数1% PBS稀释的PKM2(按1∶50稀释)并4 ℃摇床过夜。PBS洗3遍,加荧光二抗IgG室温孵育1h。荧光显微镜下拍照,定位PKM2的表达。
1.6细胞中PKM2表达的Westernblot检测用RIPA裂解蛋白提取试剂(碧云天生物技术有限公司)和蛋白酶抑制剂(美国罗氏公司)收集细胞和细胞裂解物,取等量的蛋白质在SDS-PAGE电泳后转移至PVDF膜上,用含50 g/L脱脂乳和体积分数0.1%吐温20 TBS封闭1 h,分别加入PKM2一抗(按1∶1 000稀释)、β-actin一抗(按1∶5 000稀释),4 ℃摇床过夜,TBST洗涤3次,经二抗孵育1 h并洗涤后,将膜暴露。结果用Image J软件进行分析。以目的蛋白和内参条带灰度值的比值表示目的蛋白的相对表达水平。
1.7细胞体外侵袭能力的Transwell小室检测将50 μL Matrigel胶铺在孔径为8 μm的24孔Transwell小室的上室,37 ℃放置8 h。上室加入105个细胞,总体积200 μL,下室加入300 μL含血清培养基,每组设置3个复孔,48 h后取出小室,甲醇固定并用结晶紫染色孵育10 min后,去除上层小室侧的未迁移的细胞,观察达到迁移杯底下面的细胞。显微镜下选取5个视野,计算每个视野的平均细胞数。
1.8细胞糖代谢的检测将转染48 h后的细胞以每孔105个接种于12孔板,并加入1 mL DMEM培养基,6 h后将培养基改为低糖的DMEM培养。24 h后分别用葡萄糖测试试剂盒、乳酸检测试剂盒和ATP检测试剂盒测定葡萄糖、乳酸和ATP的浓度。
1.9统计学处理采用SPSS 23.0和GraphPad 6.0进行分析。应用秩和检验比较胆囊癌和癌旁正常组织中PKM2蛋白表达的差异,应用两独立样本t检验比较PKM2 siRNA和阴性对照组细胞中PKM2蛋白表达水平、细胞增殖、侵袭和糖代谢水平的差异。检验水准α=0.05。
2 结果
2.1胆囊癌和癌旁正常组织中PKM2蛋白的表达水平见表1。免疫组化结果显示胆囊癌组织中PKM2蛋白的相对表达量高于癌旁组织,差异有统计学意义(Z=4.760,P<0.001)。

表1 胆囊癌及癌旁正常组织中PKM2蛋白的表达
Z=4.760,P<0.001
2.2PKM2siRNA转染对胆囊癌细胞增殖能力的影响见图1。由图1可知,转染PKM2 siRNA后,GBC-SD和NOZ细胞的增殖能力均下降。
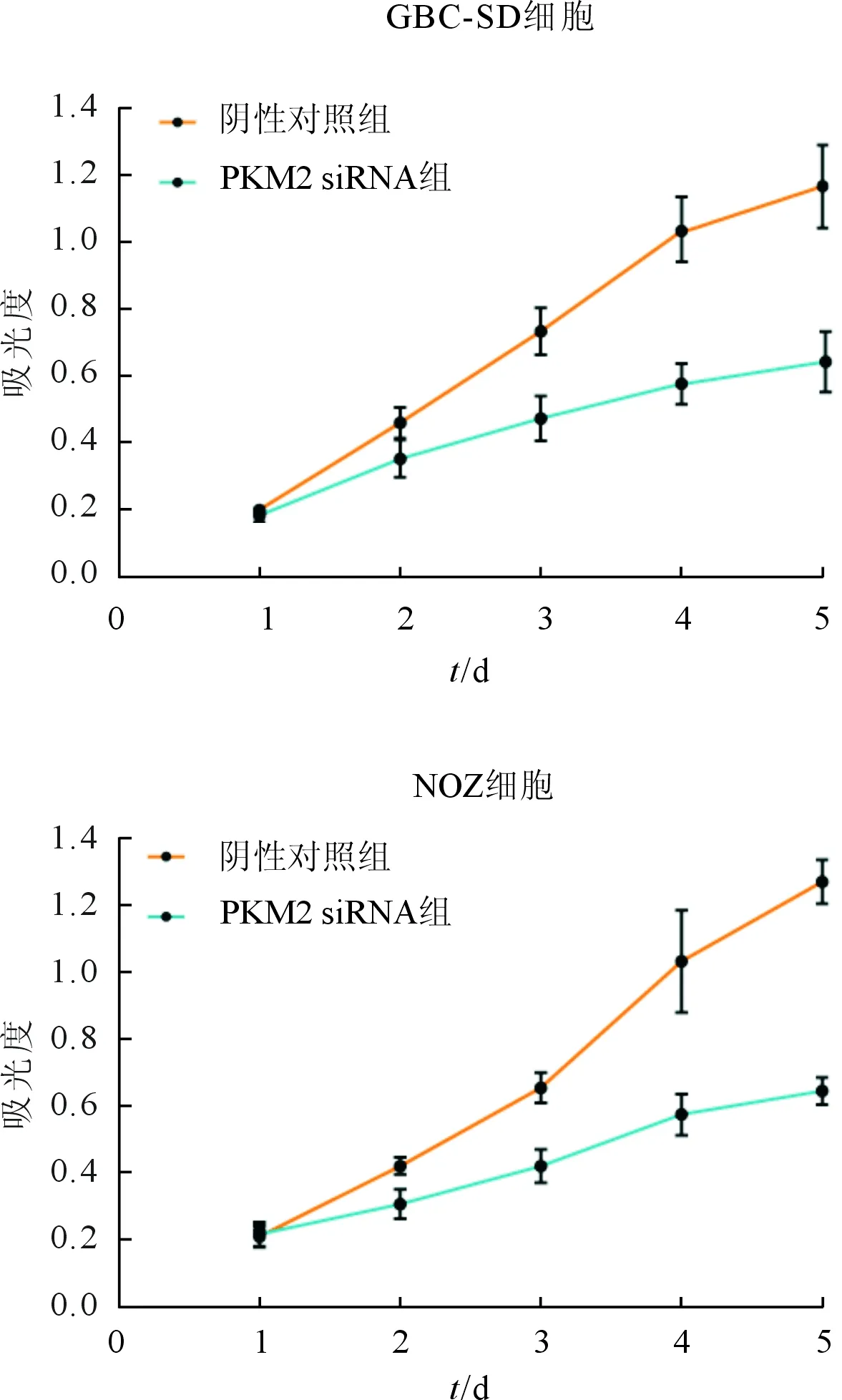
图1 胆囊癌细胞增殖曲线
2.3PKM2siRNA转染时胆囊癌细胞中PKM2蛋白的定位及表达的影响见图2和表2。免疫荧光结果显示PKM2蛋白只在GBC-SD和NOZ细胞的胞质中表达,胞核中无表达。Western bolt结果显示PKM2 siRNA组GBC-SD、NOZ细胞中PKM2蛋白的相对表达量均低于阴性对照组。
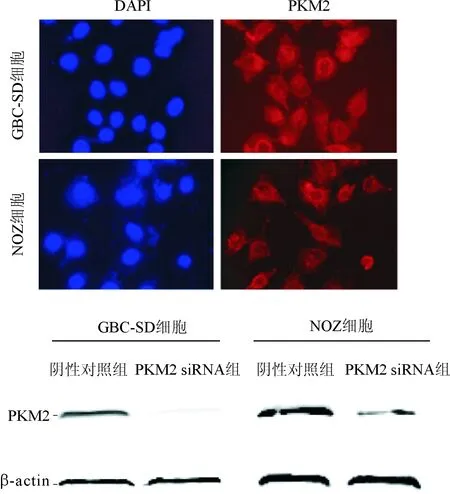
图2 转染细胞中PKM2蛋白的 免疫荧光(上)、Western bolt(下)检测结果
组别nGBC-SD细胞NOZ细胞阴性对照组30.96±0.030.98±0.01PKM2 siRNA组30.17±0.030.22±0.04t32.25231.926P<0.001<0.001
2.4PKM2siRNA转染对胆囊癌细胞侵袭能力和细胞糖代谢能力的影响见图3和表3。由图3和表3可知,PKM2 siRNA组GBC-SD和NOZ细胞侵袭能力均受到抑制,葡萄糖消耗量、细胞外乳酸生成和ATP消耗量均下降。
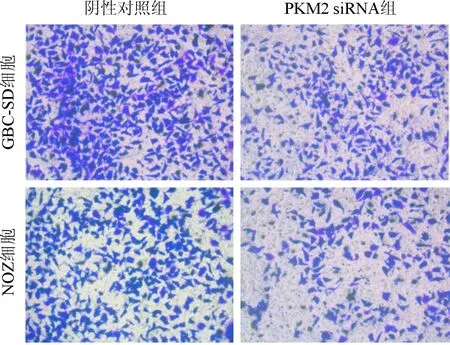
图3 细胞侵袭实验(×100)
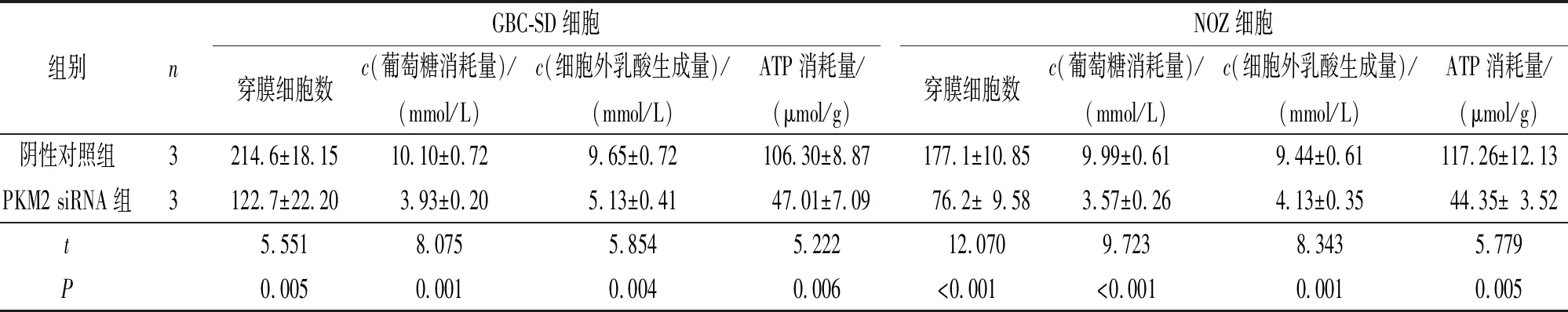
组别nGBC-SD细胞穿膜细胞数c(葡萄糖消耗量)/(mmol/L)c(细胞外乳酸生成量)/(mmol/L)ATP消耗量/(μmol/g)NOZ细胞穿膜细胞数c(葡萄糖消耗量)/(mmol/L)c(细胞外乳酸生成量)/(mmol/L)ATP消耗量/(μmol/g)阴性对照组3214.6±18.1510.10±0.729.65±0.72106.30±8.87177.1±10.859.99±0.619.44±0.61117.26±12.13PKM2 siRNA组3122.7±22.203.93±0.205.13±0.4147.01±7.0976.2±9.583.57±0.264.13±0.3544.35±3.52t5.5518.0755.8545.22212.0709.7238.3435.779P0.0050.0010.0040.006<0.001 <0.0010.0010.005
3 讨论
我国胆囊癌发病率居胆道肿瘤首位,位列消化道肿瘤第7位,且好发于50~70岁,与慢性胆囊炎、胆石症具有密切的关系[10]。由于胆囊癌早起缺乏特异性的临床表现,以及缺少有价值的临床检测方法,其诊断常被延误。因此,探索新的能够早期预测胆囊癌的生物学分子指标具有重要的临床意义。
即使在有氧条件下,大多数肿瘤细胞仍然选择糖酵解方式获取能量,这种现象被称为Warburg效应[11];该文献报道,Warburg效应在恶性肿瘤进展中具有重要作用,有望成为肿瘤治疗的重要靶点。丙酮酸激酶是糖酵解过程中的主要限速酶之一,能够使磷酸烯醇式丙酮酸和ADP变为丙酮酸和ATP。与线粒体呼吸不同的是,丙酮酸激酶的能量再生与氧气供应无关[12]。PKM2是丙酮酸激酶的一种重要的同工酶,常在一些分化的组织中以及在具有高核酸合成率的细胞中表达,如肺组织、脂肪组织和正常增殖细胞、胚胎细胞,尤其是肿瘤细胞[13-14]。
有研究[15]报道PKM2在癌细胞葡萄糖代谢过程中具有重要的作用,也可作为蛋白激酶、转录因子等调控肿瘤细胞的增殖和转移,是肿瘤代谢和细胞功能的枢纽蛋白分子。同时PKM2在许多癌细胞中高表达,与恶性肿瘤进展及转移有着密不可分的关系。朱珠等[16]的研究结果显示,PKM2能够通过调控肿瘤细胞糖代谢来促进胃癌的发生发展。Wei等[17]的研究证实,沉默PKM2后,乳腺癌细胞的增殖能力显著下降,并且细胞凋亡率增加。何中林等[18]发现在肝癌组织中,PKM2的高表达提示预后不良。本研究结果表明,PKM2在胆囊癌组织中高表达。利用干扰RNA手段沉默PKM2的表达后,GBC-SD和NOZ细胞的增殖能力、侵袭能力均显著下,同时两种细胞的葡萄糖消耗量、细胞外乳酸生成量和ATP消耗量均明显减少,上述结果提示PKM2可能是通过介导Warburg效应促进胆囊癌细胞的增殖和侵袭。
综上所述,PKM2可能与胆囊癌细胞的增殖、侵袭等密切相关,可作为一个潜在的提示胆囊癌进展的生物标志物和治疗干预的靶标。
