下调SIRT1表达对子宫内膜癌细胞增殖及凋亡的影响
2019-04-03王晓华
王晓华,李 辉,李 俊,杨 旭
1)云南省第二人民医院产科 昆明 650021 2)云南省第二人民医院妇科 昆明 650021 3)云南省第二人民医院心血管病中心 昆明 650021
恶性肿瘤是一个世界范围内的公共卫生问题。子宫内膜癌为常见的上皮性恶性肿瘤,严重威胁女性的生命健康。子宫内膜癌的发病机制与癌基因、抑癌基因异常表达有关,研究其发病机制对于肿瘤治疗具有重要意义[1]。沉默信息调节因子1(silence information regulator 1,SIRT1)属于Sirtuin蛋白家族成员,是酵母沉默信号调节因子2在人体组织中的类似物,在人体多种组织和器官中均有表达,能够调控细胞增殖、炎症、新陈代谢等病理生理过程[2-3]。SIRT1在人鳞状上皮细胞癌、基底细胞癌等肿瘤组织中高表达,参与癌细胞生长过程[4-5]。目前已经有报道[6]显示,SIRT1在子宫内膜癌组织中的阳性率高于正常子宫内膜组织,SIRT1在子宫内膜癌中可能发挥癌基因的作用。本研究探讨下调SIRT1对子宫内膜癌细胞增殖及凋亡的影响,为靶向治疗子宫内膜癌提供理论依据。
1 材料与方法
1.1材料子宫内膜癌细胞Ishikawa购自上海复祥生物科技有限公司。SIRT1 shRNA重组慢病毒和阴性对照shRNA慢病毒由北京英茂盛业生物科技有限公司构建。活化的Caspase-3(Cleaved Caspase-3)抗体、CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)抗体购自美国Abbkine公司,活化的转录因子6(activating transcription factor 6,ATF6)抗体购自上海钰博生物科技有限公司,细胞周期蛋白D1(Cyclin D1)抗体、P21抗体购自武汉伊莱瑞特生物科技股份有限公司,SIRT1抗体购自上海安妍生物有限公司,山羊抗HRP标记的二抗购自美国Abcam公司,PrimeScript RT reagent Kit购自TaKaRa公司,SYBR Green Real-time PCR试剂盒购自美国Thermo公司。
1.2实验分组Ishikawa细胞分为空白对照组、干扰组和阴性对照组。细胞培养于含体积分数10%胎牛血清的RPMI 1640培养液中,同时在细胞培养液中添加青链霉素双抗。空白对照组不处理,干扰组和阴性对照组细胞分别感染SIRT1 shRNA和阴性对照shRNA慢病毒,MOI=30,在荧光显微镜下观察其感染效率高于85%。
1.3qRT-PCR测定SIRT1mRNA的表达取3组细胞,Trizol法抽提RNA,以PrimeScript RT reagent Kit反转录合成cDNA。PCR引物均由生工生物工程(上海)股份有限公司合成,序列为:SIRT1 上游 5’-CTTGCCTCATCTGCATTTT-3’,下游 5’-ATT AGGCCAGCATTTTCTCA-3’;GAPDH上游 5’-AG GTGAAGGTCGGAGTCAAC-3’, 下游 5’-CGCTCCT GGAAGATGGTGAT-3’。反应程序:90 ℃ 30 s;95 ℃5 s,60 ℃ 30 s,40个循环。用SYBR Green Real-time PCR试剂盒对SIRT1表达水平进行定量,以GAPDH作为参照,依照2-ΔΔCt法计算SIRT1 mRNA表达水平。实验重复3次,下同。
1.4Westernblot测定SIRT1蛋白的表达取3组细胞,以RIPA裂解液裂解细胞,提取总蛋白。每孔上样50 μg蛋白,上样前加入等体积2×Loading buffer煮沸5 min,设置积层胶中90 V电压电泳,分离胶中120 V电压电泳,电泳2.5 h。将蛋白在200 mA恒流条件下转移到PVDF膜上,经体积分数5%牛血清白蛋白室温封闭120 min后,加1∶600稀释后的SIRT1抗体于4 ℃条件下孵育10 h,加1∶2 000稀释后的二抗在室温中孵育约2 h。用ECL发光试剂盒发光后显影。以软件Quantity One分析SIRT1、GAPDH条带的灰度值,SIRT1蛋白表达水平=SIRT1条带灰度值/GAPDH条带灰度值。
1.5MTT检测细胞增殖3组细胞接种于96孔板(每孔约3 000个细胞),培养48 h后,添加MTT(每孔20 μL),37 ℃结合反应3 h。移液枪吸除上清后,每孔添加100 μL DMSO反应10 min,酶标仪测定490 nm的吸光度值,设空白对照组细胞的存活率为100%,分析各组细胞存活率的变化。
1.6PI单染法检测细胞周期取3组细胞,以胰蛋白酶消化配制成单细胞悬液,用体积分数70%的乙醇固定后,添加PI染液(终浓度为50 mg/L),300目尼龙网过滤,用流式细胞仪检测细胞周期分布。
1.7AnnexinV-FITC/PI法检测细胞凋亡取3组细胞,以PBS洗2次,加胰蛋白酶消化制成单细胞悬液,在细胞中添加400 μL的结合缓冲液,再依次添加Annexin V-FITC、PI各5 μL,用流式细胞仪检测细胞凋亡,上机检测前再添加100 μL的结合缓冲液。
1.8Westernblot检测细胞中CleavedCaspase-3、CHOP、ATF6、CyclinD1、P21蛋白表达水平用Western blot检测3组细胞中Cleaved Caspase-3、CHOP、ATF6、Cyclin D1、P21蛋白水平(Cleaved Caspase-3一抗按1∶800稀释,余均按1∶1 000稀释),具体步骤同1.4。
1.9统计学处理用SPSS 21.0处理数据,用两独立样本t检验比较阴性对照组和干扰组存活率的差异,用单因素方差分析比较3组间其他指标的差异,组间两两比较用SNK-q检验,检验水准α=0.05。
2 结果
2.1 3组细胞SIRT1表达水平及增殖能力的比较结果见图1和表1。与空白对照组和阴性对照组相比,感染SIRT1 shRNA慢病毒的细胞(干扰组)SIRT1 mRNA和蛋白表达水平降低,提示成功构建了SIRT1表达下调的子宫内膜癌细胞模型。下调SIRT1后子宫内膜癌细胞的增殖能力降低。
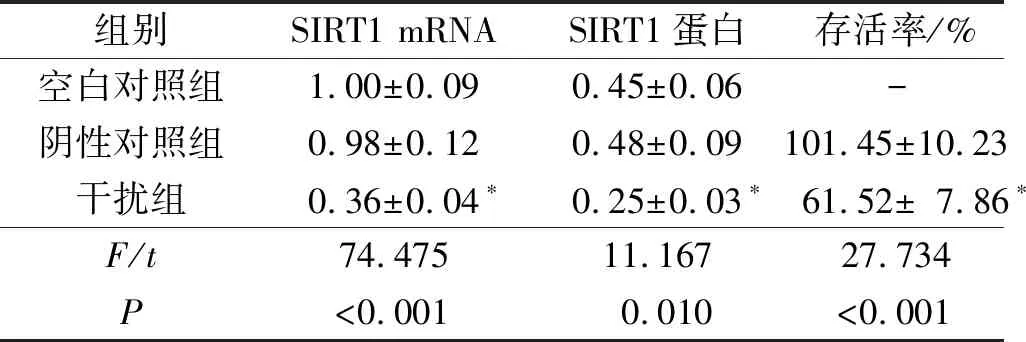
组别SIRT1 mRNASIRT1蛋白存活率/%空白对照组1.00±0.090.45±0.06-阴性对照组0.98±0.120.48±0.09101.45±10.23干扰组0.36±0.04∗0.25±0.03∗61.52±7.86∗F/t74.47511.16727.734P<0.0010.010<0.001
*:与其他2组比较,P<0.05
2.2 3组细胞周期分布及相关因子表达的比较结果见图2和表2。与空白对照组和阴性对照组相比,干扰组G0/G1期细胞比例升高,S期细胞比例下降,细胞中Cyclin D1蛋白表达水平降低,P21蛋白表达水平升高。

1~3:分别为空白对照组、阴性对照组和干扰组
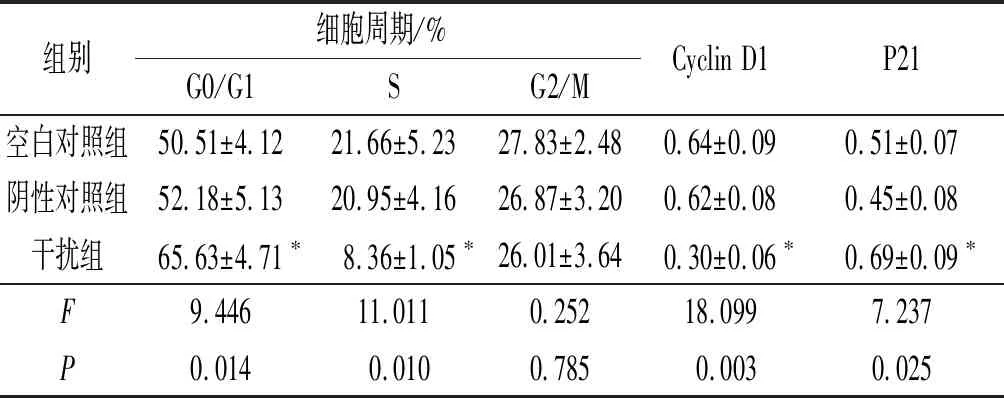
组别细胞周期/%G0/G1SG2/MCyclin D1P21空白对照组50.51±4.1221.66±5.2327.83±2.480.64±0.090.51±0.07阴性对照组52.18±5.1320.95±4.1626.87±3.200.62±0.080.45±0.08干扰组65.63±4.71∗8.36±1.05∗26.01±3.640.30±0.06∗0.69±0.09∗F9.44611.0110.25218.0997.237P0.0140.0100.7850.0030.025
*:与其他2组比较,P<0.05
2.3 3组细胞凋亡率及凋亡相关蛋白表达的比较结果见图3和表3。与空白对照组和阴性对照组相比,干扰组凋亡率升高,细胞中Cleaved Caspase-3、CHOP、ATF6蛋白表达水平升高。

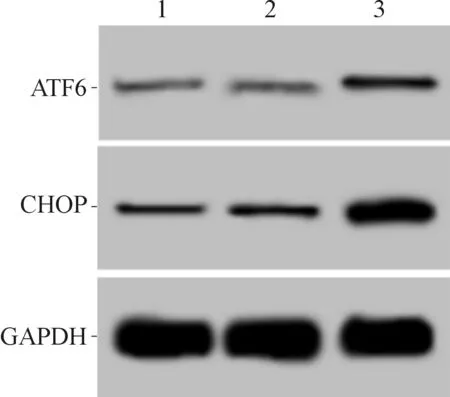
1~3:分别为空白对照组、阴性对照组和干扰组
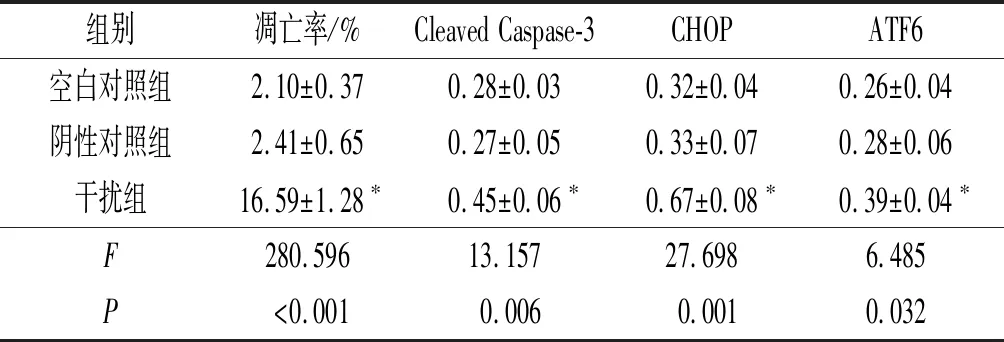
组别凋亡率/%Cleaved Caspase-3CHOPATF6空白对照组2.10±0.370.28±0.030.32±0.040.26±0.04阴性对照组2.41±0.650.27±0.050.33±0.070.28±0.06干扰组16.59±1.28∗0.45±0.06∗0.67±0.08∗0.39±0.04∗F280.59613.15727.6986.485P<0.0010.0060.0010.032
*:与其他2组比较,P<0.05
3 讨论
SIRT1是一种依赖辅酶Ⅰ的组蛋白脱乙酰蛋白酶,其可以通过组蛋白H1上的赖氨酸残基K26、组蛋白H4上赖氨酸残基K16、组蛋白H3上赖氨酸残基K9的脱乙酰化对组蛋白进行修饰,能够调控细胞衰老、神经保护、细胞生长等相关蛋白的表达[7-9]。SIRT1在淋巴瘤、前列腺癌、膀胱癌等肿瘤组织中高表达,并且可以调控多种肿瘤细胞的生长[10-13]。已有研究[14]显示,SIRT1在子宫内膜癌组织中高表达,可能在子宫内膜癌中发挥癌基因的作用。本实验表明,下调SIRT1后子宫内膜癌细胞的增殖能力降低,提示下调SIRT1可抑制子宫内膜癌细胞的生长。
细胞周期有序进展是细胞生长的基础。一个完整的细胞周期是指从上一次有丝分裂结束到下一次有丝分裂结束。G0/G1期向S期进展是细胞周期调控的关键点,受细胞内多种蛋白的共同调控,其中Cyclin D1是促进细胞从G0/G1期向S期转变的关键调控因子,其在G0/G1期合成水平升高。而P21可以抑制Cyclin D1蛋白功能,阻碍细胞从G0/G1期向S期进展[15-17]。研究[18-19]显示,沉默SIRT1可以将前列腺癌、卵巢癌等肿瘤细胞阻滞在G0/G1期。本实验表明,下调SIRT1后,子宫内膜癌细胞中Cyclin D1蛋白表达水平降低,P21表达水平升高,G0/G1期细胞比例升高,说明下调SIRT1能够将子宫内膜癌细胞周期阻滞在G0/G1期。
凋亡是重要的细胞生物学特性,受细胞内一系列基因的调控。内质网应激是近年来发现的与细胞凋亡有关的机制,缺氧、氧化应激、药物等都可以诱导细胞内质网应激,这些刺激因素可以引起内质网胞浆与胞核之间的信号转导[20]。ATF6是内质网穿膜蛋白,在内质网应激发生时可以迅速被活化,诱导内质网应激元件基因如CHOP等的表达,促进细胞凋亡发生[21]。Caspase-3是Caspase凋亡级联反应的下游执行因子,以酶原的形式存在于细胞内,只有被活化后才能够发挥促进细胞凋亡的作用[22]。多个研究[23-24]显示,SIRT1发挥抗细胞凋亡作用与减轻细胞内质网应激有关,目前在心肌细胞、神经细胞等细胞中已经证实。本实验表明,下调SIRT1可诱导子宫内膜癌细胞凋亡,促进细胞中ATF6、CHOP表达,诱导细胞中活化的Caspase-3蛋白表达,提示下调SIRT1可以通过内质网应激途径诱导子宫内膜癌细胞凋亡。
综上所述,SIRT1可能在子宫内膜癌中发挥癌基因作用,靶向SIRT1可能是治疗子宫内膜癌的有效途径。本实验未对其具体的靶向调控机制进行研究,后续实验会在体内和体外进行更深入的探讨。
