霍山石斛茎的食用安全性评价
2019-04-01,,,,
,,,,
(1.合肥工业大学食品与生物工程学院,安徽合肥 230009;2.霍山县天下泽雨生物科技发展有限公司,安徽六安 237266)
霍山石斛(DendrobiumhuoshanenseC. Z. Tang et S. J. Cheng)俗称米斛,为兰科多年生草本植物,主产于大别山区的安徽省霍山县及周边地区,其茎作为食用部位具有悠久的历史[1]。现代研究表明,霍山石斛茎不仅含有氨基酸、维生素、蛋白质等多种营养成分,还富含多糖、类黄酮、多酚等活性因子[2-3],具有增强机体免疫力、抗氧化、抗肿瘤、降血糖等诸多功能[4-5]。
近年来,随着人们生活水平的提高和霍山石斛人工栽培规模的扩大,霍山石斛作为食品原料的应用范围越来越广,但其食用安全性尚未得到国家认定,因此严重制约了霍山石斛作为食品原料使用的产业发展。李滨等[6]曾对霍山石斛进行了急性毒性、亚急性毒性和遗传毒性评价,但该研究未明确霍山石斛的受试部位。
为了准确评价霍山石斛常见食用部位的安全性,本文依据《新食品原料申报与受理规定》,以霍山石斛茎(DHS)为受试原料进行了急性毒性、遗传毒性、基于90 d动物喂养试验的亚慢性毒性和致畸作用的评价,以期为霍山石斛茎作为新食品原料使用提供更加全面的科学依据。
1 材料与方法
1.1 材料与仪器
霍山石斛茎 霍山县天下泽雨生物科技发展有限公司;SPF级Wistar断乳大鼠145只(70±10 g)、SPF级昆明小鼠95只(20±2 g) 山东大学实验动物中心,实验动物生产许可证号:SCXK(鲁)20130009,实验动物使用许可证号,SYXK(鲁)20100011,实验动物饲料生产许可证号:SCXK(京)2014-0008;鼠伤寒沙门氏菌TA97、TA98、TA100、TA102菌株 中国军事医学科学院;氯化钠、氯化钾、环磷酰胺、敌克松其等试剂 均为分析纯,国药集团化学试剂有限公司。
DGF30/7-I电热鼓风干燥箱 南京实验仪器厂;CA-800全自动血细胞计数仪 日本埃尔玛CIS公司;RM2235石蜡切片机 德国莱卡公司;CT15RT高速冷冻离心机 上海天美科学仪器有限公司;TS100倒置显微镜 日本NIKON公司;SW-CJ-1FD超净工作台 苏州净化设备有限公司。
1.2 实验方法
所有动物试验均依据2003版《保健食品检验与评价技术规范》在山东大学完成。
1.2.1 小鼠急性毒性试验 采用最大耐受剂量法(MTD)进行试验。选取健康昆明小鼠20只,雌雄各半。精密称定10 g霍山石斛茎干燥粉末,加入适量蒸馏水混匀,并定容至60 mL。将小鼠禁食16 h后,以0.30 mL/10 g·bw的剂量给小鼠灌胃3次,每次间隔4 h,即总剂量为15.0 g/kg·bw。在正常饮食的条件下连续观察14 d,并记录小鼠的中毒表现和死亡情况,观察期后将受试动物解剖,检查肝脏、脾脏、肾脏、心脏、肺、胃、肠等主要器官的变化。
1.2.2 遗传毒性试验
1.2.2.1 Ames试验 选取健康雄性成年Wistar大鼠5只(体重(70±10) g),适应性培养后按500 mg/kg·bw剂量一次腹腔注射200 g/L的多氯联苯溶液(玉米油),继续饲养5 d,禁食12 h后处死大鼠,于超净工作台内取出大鼠肝脏并称重,用冰冷的0.1 mol/L KCl溶液连续冲洗以除去血红蛋白,加入0.1 mol/L KCl溶液适量,剪碎、匀浆、离心后,取上清液作为S9组分,备用。试验菌株为经鉴定符合要求的鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100、TA102。称取1.25 g霍山石斛茎干燥粉末样品,用蒸馏水混匀并定容至25 mL,配制成50000 μg/mL的样品原液,灭菌,用无菌双蒸水依次稀释至:50000、10000、2000、400、80 μg/mL。在已融化并于45 ℃水浴保温的琼脂中依次加入0.1 mL试验菌液(2×109个/mL)、0.1 mL样品溶液、0.5 mL S9混合液,混匀后迅速倒入制备好的底层培养基上,平放固化。同时设自发回变组、溶剂对照组和阳性对照组,每组3个平行。其中自发回变组不做其他处理;溶剂对照组加入同体积双蒸水;不加S9混合液时,加入同体积敌克松作为TA97、TA98、TA102的阳性对照,叠氮钠为TA100的阳性对照;加S9混合液时,加入同体积2-氨基芴为TA97、TA98、TA100的阳性对照,1,8-二羟蒽酮为TA102的阳性对照。将上述平皿置于37 ℃下培养48 h,统计每皿回变菌落数,整套实验在相同条件下重复两次。
1.2.2.2 小鼠骨髓嗜多染红细胞微核试验 取SPF级雌雄各半的昆明小鼠50只,随机分成5组,每组10只,即受试物剂量低、中、高剂量组(1.667、3.333、6.667 g/kg·bw),同时设蒸馏水为阴性对照组、40 mg/kg·bw的环磷酰胺(CP)为阳性对照组,灌胃体积为0.40 mL/10 g·bw。两次给予受试物,每次间隔24 h,末次给予受试物6 h后处死小鼠,取胸骨或股骨,挤出骨髓液并与小牛血清混匀,涂片,自然干燥,甲醇固定、Giemsa染色、磷酸盐缓冲液(pH6.8)冲洗晾干,光学显微镜下检查。每只小鼠计数1000个嗜多染红细胞(PCE),记录含微核的细胞数,并计算微核细胞率,以千分率表示;每只小鼠观察200个嗜多染红细胞,同时计数正染红细胞(NCE),计算PCE与NCE的比值,并进行统计学处理。
1.2.2.3 小鼠精子畸形试验 取SPF级性成年雄性昆明小鼠25只,随机平均分为5组,即受试物剂量低、中、高剂量组、阴性对照组和阳性对照组。按1.2.2.2给药,连续经口灌胃受试物5 d。灌胃结束30 d后,脊椎脱臼处死小鼠,取两侧附睾放入盛有适量生理盐水的小烧杯中,纵向剪开,静止片刻后轻轻摇动,经四层擦镜纸过滤,取滤液制片,干燥后经甲醇固定、伊红染色(1 h)、蒸馏水冲洗、干燥后,镜检。每只小鼠计数1000个结构完整的精子,观察精子形态和畸形类型,计算精子畸形率,并进行统计学分析。
1.2.3 90 d经口喂养试验 选用SPF级Wistar断乳大鼠80只(体重(70±10) g),雌雄各半,随机平均分为4组,包括3个受试样品的低、中、高剂量组和一个阴性对照组。按人体推荐量的100、200、300倍剂量,设低、中、高3个受试样品组剂量分别为1.67、3.33和5.00 g/kg·bw。受试样品掺入饲料中,并添加适量酪蛋白使各组饲料蛋白含量与常规饲料一致,各剂量组样品掺入饲料的质量分数分别为2.08%、4.17%和6.25%。三个试样品处理组大鼠分别喂养以上饲料,阴性对照组喂养常规饲料,所有大鼠单笼喂养,自由饮食,连续90 d。每天记录动物的一般临床表现和行为表现,以及中毒体征、程度、持续时间和死亡情况。每周记录体重、饲料摄入量,计算食物利用率。试验结束时,计算大鼠体重增长量、总摄食量和总食物利用率,并处死大鼠,留取部分血液用全自动血液分析仪进行血液学指标(血红蛋白、红细胞、白细胞、中性粒细胞、单核细胞和淋巴细胞)检测,其余血液离心后,取血清用全自动生化分析仪进行生化学指标(谷草转氨酶、谷丙转氨酶、尿素氮、肌酐、甘油三酯、胆固醇、血糖、血清白蛋白和总蛋白)测定。同时,对所有大鼠进行体检,将重要器官和组织固定保存,将脏器(肝、脾、肾、胸腺、睾丸)称重,计算相对重量(脏/体比值),并进行病理组织学检查(肝、肾、脾、胃及十二指肠、胸腺、睾丸或卵巢)。
1.2.4 致畸试验 将60只Wistar大鼠孕鼠随机分为4组,即阴性对照组和低、中、高3个受试样品组,每组15只。按1.2.3中所述制备饲料,3个受试物处理组孕鼠分别在受孕的第7~16 d喂养以上饲料,阴性对照组喂养常规饲料。孕鼠单笼喂养,自由饮食,并分别于受孕的0、7、12、16、20 d称量孕鼠体重,每天观察并记录动物的行为、表现、中毒和死亡现象。孕鼠于妊娠第20 d,经麻醉后解剖,迅速取出子宫并称重,检查并记录活胎数、吸收胎数、早死胎数及晚死胎数,以及胎鼠性别、体长、体重、尾长。
从每窝活胎鼠中取出一半胎鼠置于95%乙醇中固定3周后,取出胎仔,流水冲洗,放入20 g/L的KOH 溶液中至透明后取出,于茜素红应用液中染色48 h,再依次放入透明液A(甘油∶氢氧化钾∶蒸馏水=10∶1∶79)中2 d,透明液B(甘油∶蒸馏水=1∶1)中2 d,使软组织基本褪色而骨骼染红,于体视显微镜下先作整体观察,然后依次检查头骨、脊柱骨、骨盆、四肢骨、腕骨、掌骨、趾骨、肋骨、胸骨等。将每窝的另一半活胎鼠置于Bouins液(2,4,6-三硝基酚∶40%甲醛∶冰乙酸=15∶4∶1)中固定两周后,沿腹中线剪开腹腔、胸,依次检查心脏、肺脏、横膈膜、肝脏、胃、肠、肾脏、膀胱、输尿管、子宫或睾丸等脏器的大小、位置及发育情况,并将肾脏切开,观察有无肾盂扩大与积水,必要时还需对心脏内部结构进行检查。
1.3 数据处理
采用SPSS 17.0 统计软件对数据分别进行One-way ANOVA分析及Dunnett检验,分析比较各组实验数据及数据间的显著性差异关系,检验水准α=0.05。
2 结果与分析
2.1 小鼠急性经口毒性试验结果
急性经口毒性试验是检测实验动物在一次或在24 h内多次经口给予受试样品后,动物在短期内表现出的健康损害效应的实验方法[7]。鉴于霍山石斛悠久的食用传统,本研究采用最大耐受量(MTD)方法进行试验。结果表明,将霍山石斛茎样品以15.0 g/kg·bw的剂量给小鼠灌胃,连续14 d后,雄性小鼠体重由初始的20.24 g增长至32.99 g,雌性小鼠体重由初始的19.40 g增长至28.44 g,两种性别小鼠均未见死亡和明显的中毒症状。肝脏、脾脏、肾脏、心脏、肺、胃、肠等主要器官均未见明显异常改变。因此,霍山石斛茎对雌雄小鼠急性经口毒性试验的最大耐受剂量(MTD)均大于15.0 g/kg·bw,相当于人体推荐剂量的900倍,根据急性毒性分级,属于无毒级。
2.2 遗传毒性试验结果
2.2.1 Ames试验 Ames试验被广泛用于受试样品的致突变作用检测[8-9]。结果(表1)表明,霍山石斛茎在加或不加S9时,各剂量组回变菌落数均未超过自发回变菌落数的2倍,即致变比MR≤2,且无剂量-效应关系,根据GB15193.4-2014《食品安全国家标准细菌回复突变试验》,判断为致突变阴性,即霍山石斛茎对鼠伤寒沙门氏菌TA97、TA98、TA100、TA102菌株未呈现遗传毒性。

表1 霍山石斛茎Ames试验结果
2.2.2 小鼠骨髓嗜多染红细胞微核试验 嗜多染红细胞(Polychromatic erythrocyte,PCE)是细胞质内含有核糖体的未成熟红细胞,Giemsa染色呈灰蓝色。正染红细胞(Normochromatic erythrocyte,NCE)为核糖体已消失的成熟红细胞,Giemsa染色呈淡橘红色[10-11]。PCE与NCE的比值(PCE/NCE)代表未成熟红细胞与成熟红细胞的比值,是评价细胞毒性的指标[12]。微核是染色体或染色单体的无着丝点断片或因纺锤丝受损伤而丢失的整个染色体,通过测定骨髓PCE中含微核的细胞数量,计算微核率,并结合PCE与NCE比值可快速检测外源诱变因素导致的染色体畸变[13-14]。
由表2可见,阴性对照组PCE微核率小于5‰,霍山石斛样品各剂量组微核率与阴性对照组比较,无显著性差异;环磷酰胺阳性组微核率大于30 ‰,与阴性对照组相比,有极显著性差异(p<0.01),且霍山石斛样品各剂量组PCE/NCE比值与阴性对照组相比无显著差异。可见,霍山石斛茎对小鼠骨髓嗜多染红细胞微核率及PCE与NCE比值均无影响。

表2 霍山石斛茎对小鼠骨髓微核率和PCE/NCE的影响Table 2 Effects of DHS on the frequency of micronucleus and PCE/NCE of
2.2.3 小鼠精子畸形试验 生殖系统对于致突变物的敏感性高,所以常选用小鼠精子畸形试验探讨外源物质的生殖细胞毒性及对生殖细胞的致突变作用[15]。由表3可见,环磷酰胺阳性对照组小鼠精子畸形率明显升高,与阴性对照组相比差异极显著(p<0.01),而霍山石斛样品各剂量组与阴性对照组相比,小鼠精子畸形率无显著性差异,说明霍山石斛茎对小鼠精子畸形率无明显影响。

表3 霍山石斛茎对小鼠精子畸形率的影响Table 3 Effects of DHS on abnormal rate in mouse
2.3 大鼠90 d喂养试验结果
2.3.1 霍山石斛茎对大鼠体重和食物利用率的影响 在毒理学安全性评价中,动物体重和食物利用率是评价受试物是否导致动物某些指标异常及动物生长发育正常与否的重要指标。90 d喂养试验过程中,各组动物生长发育、活动均正常,未见中毒和死亡现象;与阴性对照组相比,各剂量组动物每周体重、体重增加量、进食量和食物利用率均无统计学差异;90 d喂养结束时,与阴性对照组相比,各剂量组动物总体重增加量、总进食量和总食物利用率均无统计学差异(见表4),说明霍山石斛茎不会影响大鼠体重、进食量和食物利用率。
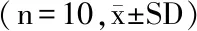
表4 喂养结束后大鼠总体重增加量及食物利用率Table 4 Total body weight gain and food utilization rates of rats after
2.3.2 霍山石斛茎对大鼠血液学指标的影响 红细胞及血红蛋白,白细胞数量及不同类型细胞所占比例是血液学的主要指标[16]。表5显示,红细胞及血红蛋白在各试验组中没有差异,白细胞数量及不同类型细胞所占比例在不同试验间也无统计学差异,说明霍山石斛茎对于大鼠血液学指标无不良影响。
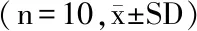
表5 霍山石斛茎对对大鼠血液学指标的影响Table 5 Effect of DHS on hematological parameter of
2.3.3 霍山石斛茎对大鼠血液生化指标的影响 血糖(GLU)、尿素氮(BUN)、肌酐(GREA)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)和胆固醇(TC)是血液重要的生化指标[17-22]。由表6可知,霍山石斛茎高、中、低三个剂量组大鼠的血液生化指标与阴性对照组相比,无统计学差异,说明90 d喂养过程中霍山石斛茎并未影响大鼠的血液生化指标。
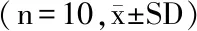
表6 霍山石斛茎对大鼠血液生化指标的影响Table 6 Effect of DHS on blood biochemical paremeters of
2.3.4 霍山石斛茎对大鼠病理学结果 脏器系数又称脏/体比值,可反映在外界因素影响下脏器的水肿、增生、萎缩或充血等变化,是判断外源物质作用靶器官的重要依据[23-24]。由表7可知,脏器的脏/体比值与阴性对照组相比无显著性差异,表明霍山石斛茎对脏器无不良影响。组织病理学检查发现,除高剂量组和对照组各有一只雄鼠肝细胞有轻度损伤外,其余动物肝脏、肾脏、脾脏、胃、十二指肠、胸腺、睾丸或卵巢组织未见有意义的病理学改变,说明霍山石斛茎(人工栽培)对受检脏器无明显损害。
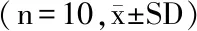
表7 霍山石斛茎对大鼠脏体比的影响Table 7 Effect of DHS on the organ-to-body weight ratio of
2.4 致畸试验
致畸试验是利用大鼠孕期胚胎的器官发育与分化是否异常及异常程度来评价外源物质的致畸作用[25-26]。由表8显示可知,不同剂量组与阴性对照组相比其体重均稳定增加,至20 d各组体重增加无明显差异。表9表明,与阴性对照组相比,各剂量组孕鼠卵巢重量、胎盘重量、子宫连胎重、平均黄体数、胚胎平均着床数、平均窝活胎均无显著性差异。对活胎鼠的发育进行观察和镜检发现(表10),与阴性对照组相比,各剂量组活胎鼠的性别比例、体重、身长和尾长均无显著性差异;各剂量组胎鼠头部、躯干、四肢外观均未观察到明显畸形,胎鼠头部器官(舌、腭、鼻、眼、脑),胸腔器官(肺脏、心脏、横膈膜)及腹腔器官(肝、胃、肾、肠道、膀胱)均未发现异常;对照组和剂量组的枕骨、肋骨、椎骨、四肢骨均未见畸形,除阴性对照组和剂量组的个别动物胸骨骨化不全外,各组胎鼠的胸骨缺失率和畸形均无显著性差异。以上试验结果均说明,霍山石斛茎对于孕鼠及胎鼠发育及分化无不良影响,提示霍山石斛茎(人工栽培)对大鼠无致畸作用。

表8 霍山石斛茎对孕鼠体重的影响Table 8 Effect of DHS on the body weight of pregnant

表9 霍山石斛茎对孕鼠及胚胎发育的影响Table 9 Effect of DHS on the development of pregnant rat and

表10 霍山石斛茎对胎鼠的影响Table10 Effect of DHS on
3 结论
急性经口毒性试验表明霍山石斛茎对于雌雄小鼠的最大耐受剂量(MTD)均大于15.0 g/kg·bw,属于无毒级。Ames试验判断霍山石斛茎对鼠伤寒沙门氏菌四株试验菌株均未呈现遗传毒性,小鼠骨髓嗜多染红细胞微核试验判断霍山石斛茎对小鼠骨髓嗜多染红细胞微核率及嗜多染红细胞与正染红细胞(PCE/NCE)的比值均无影响,小鼠精子畸形试验判断霍山石斛茎各剂量组小鼠精子畸形率与阴性对照组相比无显著性差异,表明霍山石斛茎无遗传毒性。90 d喂养试验发现,霍山石斛对大鼠的体重、进食量、食物利用率、脏器绝对重量、脏/体比值、血液学指标、血液生化指标、病理组织学检查均无显著性差异,表明霍山石斛茎不具有亚慢性毒性。与阴性对照组相比,霍山石斛茎各剂量组对大鼠孕鼠体重增长、胚胎早期发育及胎鼠的生长发育、胎鼠的骨骼、内脏和外观发育均无明显不良影响,表明霍山石斛茎对大鼠无致畸作用。综上所述,霍山石斛茎在试验剂量范围内不具有毒性,食用安全。
